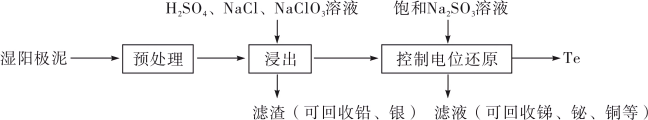
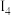1 . 碲(Te)是一种重要的稀有分散元素,广泛应用于冶金、石油、化工、航空、电子等领域。以某冶炼厂的湿阳极泥(含水26%,主要含锑、砷、铅、铋、银和少量铜、碲等)为原料回收碲的流程如下:
请回答下列问题:
(1)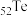 的基态原子的电子排布式为
的基态原子的电子排布式为___________ 。
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是___________ ;氧化后的原料还需粉碎、过筛,目的是___________ 。
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为___________ 、___________ ;添加 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、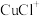 而被浸出的离子方程式
而被浸出的离子方程式___________ 。
(4)电解时为防止除Te以外的单质生成,需控制电位的范围为___________ ;加入饱和 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成___________ (填化学式)。
(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为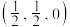 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为___________ 。若Te的原子半径为rpm,碲化锌晶胞中面心与顶点的碲原子相切,晶体的密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
___________  (列出计算式)。
(列出计算式)。
| 物质 | 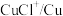 | 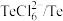 | 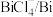 | 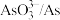 | 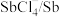 |
| 氧化还原电位(E)/V | 0.342 | 0.568 | 0.16 | 小于0.16 | 小于0.16 |
(1)
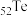 的基态原子的电子排布式为
的基态原子的电子排布式为(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为
 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、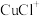 而被浸出的离子方程式
而被浸出的离子方程式(4)电解时为防止除Te以外的单质生成,需控制电位的范围为
 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为
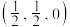 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数
 (列出计算式)。
(列出计算式)。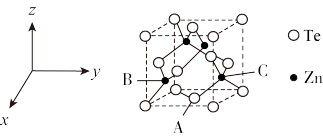
您最近一年使用:0次
2 . X、Y、Z、W是同周期主族元素,四种元素均是短周期元素,W元素形成的某种单质具有强氧化性,可用于杀菌消毒。四种元素与锂组成的盐是一种新型锂离子电池的电解质,结构如图所示,下列说法正确的是
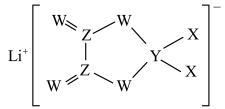

| A.组成这种新型电解质的所有元素均处于元素周期表p区 |
| B.Z元素的含氧酸不可能使酸性高锰酸钾溶液褪色 |
| C.最简单氢化物的沸点: X>W |
| D.同周期中第一电离能比W元素小的有4种元素 |
您最近一年使用:0次
17-18高二上·四川遂宁·期末
名校
3 . 现有四种元素的基态原子的电子排布式如下:①[Ne]3s23p3; ②[Ne]3s23p4;③1s22s22p63s23p5。则下列有关比较中正确的是
| A.最高正化合价:①>③>② |
| B.单质氧化性:①>②>③ |
| C.电负性:①>③>② |
| D.最高价氧化物的水合物的酸性:③>②>① |
您最近一年使用:0次
2018-01-31更新
|
403次组卷
|
5卷引用:云南省昆明市官渡区第二中学2023-2024学年高三上学期开学化学试题
(已下线)云南省昆明市官渡区第二中学2023-2024学年高三上学期开学化学试题四川省遂宁市2017-2018学年高二上学期期末考试化学试题山西省大同市第三中学2017-2018学年高二下学期4月月考化学试题内蒙古集宁一中2017-2018学年高二下学期第二次月考理科考试综合化学试题湖北省十堰市六县市区一中教联体2023-2024学年高二上学期12月联考化学试题
4 . 下表列出了W、X、Y三种短周期元素的各级电离能数据(用 、
、 ......表示)。关于W、X、Y三种元素的下列推断中,不正确的是
......表示)。关于W、X、Y三种元素的下列推断中,不正确的是
 、
、 ......表示)。关于W、X、Y三种元素的下列推断中,不正确的是
......表示)。关于W、X、Y三种元素的下列推断中,不正确的是元素 | 电离能 | ||||
|
|
|
| …… | |
W | 496 | 4562 | 6912 | 9543 | |
X | 738 | 1451 | 7733 | 10540 | |
Y | 578 | 1817 | 2745 | 11575 | |
| A.W元素单质的还原性最强 | B.X元素位于元素周期表第ⅡA族 |
| C.最高价氧化物对应水化物的碱性:X>W | D.Y元素的最高正化合价为+3价 |
您最近一年使用:0次
2023-04-27更新
|
148次组卷
|
2卷引用:云南师范大学附属中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
5 . 对Na、Mg、Al的有关性质的叙述正确的是:
| A.碱性:NaOH< Mg(OH)2< Al(OH)3 | B.第一电离能:Na< Mg <Al |
| C.还原性:Na> Mg >Al | D.电负性:Na> Mg >Al |
您最近一年使用:0次
2020-11-12更新
|
566次组卷
|
63卷引用:云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题
云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题云南省玉溪市通海三中2018-2019学年高二上学期10月考试化学试题云南省广南县二中2021-2022年学年高二下学期开学考试化学试题(已下线)09—10年泰州中学高二下学期期末考试化学卷(已下线)2013-2014宁夏银川一中高二下学期期末考试化学试卷2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2014-2015宁夏银川市唐徕回民中学高二下学期3月月考化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2014-2015学年陕西省宝鸡中学高二下学期期末化学试卷A2014-2015学年吉林省汪清县第六中学高二下学期期末考试化学试卷2015-2016学年福建省泉州市晋江市平山中学高二上期末化学试卷2015-2016学年宁夏六盘山中学高二下第一次月考化学卷2015-2016学年山西太原五中高二下3月第二次周练化学卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2015-2016学年山东省淄博市高青一中高二4月月考化学试卷2015-2016学年山西省右玉一中高二5月月考化学试卷2015-2016学年吉林东北师大附属实验高二下期末化学试卷2015-2016学年吉林梅河口五中高二下期末化学试卷2015-2016吉林东北师大附属实验学校净月实验学校高二下期末化学卷2015-2016学年山西省朔州市右玉一中高二下5月月考化学试卷2016-2017学年四川省阆中中学高二上教学质检化学试卷2016-2017学年宁夏吴忠中学高二下学期第一次月考化学试卷2016-2017学年宁夏育才中学孔德校区高二下学期第一次(3月)月考化学试卷安徽省蚌埠市第二中学2016-2017学年高二下学期期中考试化学试题河北省馆陶县第一中学2016-2017学年高二下学期期中考试化学试题湖北省孝感市七校教学联盟2016-2017学年高二下学期期末考试化学试题新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题福建省福州市八县(市)协作校2016-2017学年高二下学期期末考试化学试题河北省深州中学2016-2017学年高二下学期期末考试化学试题内蒙古包头市第三十三中学2016-2017学年高二下学期期末考试化学试题福建省福州市八县协作校2016-2017学年高二下学期期末化学试题吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题福建省福州三中2017-2018学年高二上学期期末考试化学试题甘肃省玉门市第一中学2018-2019学年高二上学期期中考试化学试题山东省泰安市宁阳一中2018-2019学年高二上学期阶段性考试三(12月)化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题黑龙江省鸡西市鸡东县第二中学2018-2019学年高二5月月考化学试题福建省泉州市泉港区第一中学2018-2019学年高二下学期期末考试化学试题新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题新疆石河子第二中学2018-2019学年高二下学期第一次月考化学试题黑龙江省哈尔滨市第三中学校2019-2020学年高二上学期期末考试化学试题2020届高三化学二轮物质结构题型专攻——原子结构与性质【基础专练】黑龙江省哈尔滨市第三中学2019-2020学年高二上学期第一模块(期末)考试化学试题吉林省延边市长白山第一高级中学2019-2020学年高二下学期验收考试化学试卷吉林省长春市第二十九中学2019-2020学年高二上学期期末考试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题新疆乌鲁木齐市第四中学2019-2020学年高二下学期期末考试化学试题广西防城港市防城中学2019-2020学年高二下学期期中考试化学试题四川省平昌县驷马中学2020-2021学年高二上学期九月月考化学试题江苏省东台创新高级中学2019-2020学年高二下学期4月份月检测化学试题山东省淄博市般阳中学2020-2021学年高二上学期期中考试化学试题四川省乐山十校2020-2021学年高二上学期半期联考化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题河南省宏力学校2018-2019学年高二下学期期中考试化学试题内蒙古集宁新世纪中学2020-2021学年高二下学期期末考试化学试题广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题新疆博尔塔拉蒙古自治州蒙古中学2020-2021学年高二下学期期中考试化学试题 四川省绵阳第一中学2022-2023学年高二上学期9月教学质量监测理科化学试题福建省永春美岭中学2021-2022学年高二下学期期中测试化学试题新疆乌鲁木齐市第101中学2021-2022学年高二下学期期末考试化学试题四川省乐山市沫若中学2022-2023学年高二上学期第一次月考化学试题河南省焦作市2022-2023学年第四中学高二下学期3月月考 化学试卷新疆阿克苏市实验中学2022-2023学年高二下学期第一次月考化学试题
6 . 中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物。回答下列问题:
(1)氮、磷、钾三种元素的第一电离能由大到小的顺序是____ (用元素符号表示)。
(2)叠氮酸(HN3)是一种弱酸,可电离出H+和N 。
。
①N 的立体构型是
的立体构型是____ 形;与N 互为等电子体的一种分子是
互为等电子体的一种分子是____ (填分子式)。
②叠氮化物能与Co3十形成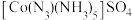 ,该配合物中心离子的配位数为
,该配合物中心离子的配位数为____ ;基态钻原子的价层电子排布式为____
(3)磷能形成多种含氧酸,某资料认为次磷酸的结构如图。按此结构,P原子采用的杂化方式为_____ ,次磷酸分子中σ键与π键数目之比为 _____ ,次磷酸属于____ 酸(填“强”或“弱”),1mol次磷酸最多能与____ molNaOH发生中和反应。
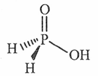
(4)已知钾的一种化合物KIC12受热可分解,倾向于生成晶格能更大的物质。则下列化学反应更易发生的是____
A.KICl2=KCl+ICl B.KICl2=KI+Cl2
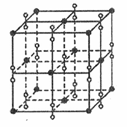
(5)钾在氧气中燃烧时得到多种氧化物,其中一种是面心立方结构,晶胞结构如下图所示。若该氧化物的密度是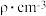 ,则晶胞中最近的两个钾离子间的距离为
,则晶胞中最近的两个钾离子间的距离为_____ pm(只要求列算式,不必计算出数值,用NA表示阿伏加德罗常数的值)。
(1)氮、磷、钾三种元素的第一电离能由大到小的顺序是
(2)叠氮酸(HN3)是一种弱酸,可电离出H+和N
 。
。①N
 的立体构型是
的立体构型是 互为等电子体的一种分子是
互为等电子体的一种分子是②叠氮化物能与Co3十形成
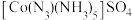 ,该配合物中心离子的配位数为
,该配合物中心离子的配位数为(3)磷能形成多种含氧酸,某资料认为次磷酸的结构如图。按此结构,P原子采用的杂化方式为

(4)已知钾的一种化合物KIC12受热可分解,倾向于生成晶格能更大的物质。则下列化学反应更易发生的是
A.KICl2=KCl+ICl B.KICl2=KI+Cl2
(5)钾在氧气中燃烧时得到多种氧化物,其中一种是面心立方结构,晶胞结构如下图所示。若该氧化物的密度是
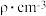 ,则晶胞中最近的两个钾离子间的距离为
,则晶胞中最近的两个钾离子间的距离为
您最近一年使用:0次
7 . 某种双核钴配合物阳离子的结构如图。X的第一电离能在第二周期主族元素中位居第二,Y的核外电子只有一种运动状态,Z的一种同素异形体是极性分子。下列说法错误的是
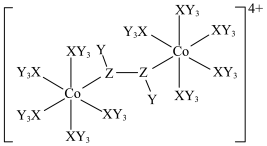
| A.简单氢化物的稳定性:Z>X |
| B.电负性:Z>X>Y |
| C.Co位于元素周期表ds区,在该阳离子中呈+2价 |
| D.从结构推测该配合物阳离子不稳定,且具有一定的氧化性 |
您最近一年使用:0次
2024-04-02更新
|
572次组卷
|
4卷引用:2024届东北三省三校高三下学期第二次联合模拟考试理综重组卷-高中化学
8 . 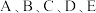 形成简单离子的最外层电子排布均为
形成简单离子的最外层电子排布均为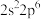 ,且半径依次减小。C、D、E原子中均仅有一个未成对电子。
,且半径依次减小。C、D、E原子中均仅有一个未成对电子。 单质为双原子分子,化学性质稳定。
单质为双原子分子,化学性质稳定。 组成典型的离子化合物
组成典型的离子化合物 ,其晶体结构类似于
,其晶体结构类似于 晶体。下列说法正确的是
晶体。下列说法正确的是
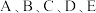 形成简单离子的最外层电子排布均为
形成简单离子的最外层电子排布均为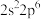 ,且半径依次减小。C、D、E原子中均仅有一个未成对电子。
,且半径依次减小。C、D、E原子中均仅有一个未成对电子。 单质为双原子分子,化学性质稳定。
单质为双原子分子,化学性质稳定。 组成典型的离子化合物
组成典型的离子化合物 ,其晶体结构类似于
,其晶体结构类似于 晶体。下列说法正确的是
晶体。下列说法正确的是A.简单气态氢化物的稳定性: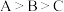 |
B.简单离子的氧化性: |
C.第一电离能: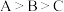 |
D. 单质与 单质与 的最高价氧化物对应的水化物均可发生反应 的最高价氧化物对应的水化物均可发生反应 |
您最近一年使用:0次
2023-08-24更新
|
253次组卷
|
2卷引用:云南省保山市2021-2022学年高二下学期期末考试理综化学试题
9 . 元素周期表被认为是“科学共同的语言”,它的发现使化学学习和研究变得有规律可循。其简洁有序的背后,是众多科学家艰苦奋斗的结果。下图是元素周期表的一部分,请按要求回答下列问题:

(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷的原子结构示意图为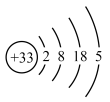 ,砷在周期表中的位置是
,砷在周期表中的位置是___________ 。我国“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。原子半径:Ga___________ As(填“>”或“<”)。
(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。硅元素位于元素周期表金属与非金属的分界处,请写出硅单质的一种用途___________ 。
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硫化硒(SeS)可用于治疗脂溢性皮炎。硫元素和硒元素简单气态氢化物热稳定性较强的为___________ (填化学式)。
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是___________ 。
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力着。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族,有关“类钫”的预测说法正确的是
(6)小赵同学在研究元素周期表时发现,碳元素有“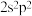 ”这一信息,观察元素周期表后,寻找规律,推测某元素“
”这一信息,观察元素周期表后,寻找规律,推测某元素“ ”中
”中 可能的含义是
可能的含义是___________ 。

(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷的原子结构示意图为
 ,砷在周期表中的位置是
,砷在周期表中的位置是(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。硅元素位于元素周期表金属与非金属的分界处,请写出硅单质的一种用途
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硫化硒(SeS)可用于治疗脂溢性皮炎。硫元素和硒元素简单气态氢化物热稳定性较强的为
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力着。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族,有关“类钫”的预测说法正确的是
| A.“类钫”在化合物中显+1价 |
| B.“类钫”单质具有强氧化性 |
| C.“类钫”最高价氧化物对应的水化物为弱碱 |
| D.“类钫”单质能与冷水剧烈反应 |
(6)小赵同学在研究元素周期表时发现,碳元素有“
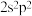 ”这一信息,观察元素周期表后,寻找规律,推测某元素“
”这一信息,观察元素周期表后,寻找规律,推测某元素“ ”中
”中 可能的含义是
可能的含义是
您最近一年使用:0次
10 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态 Y 原子有3个未成对电子,基态Z原子的价电子数等于其电子层数,这四种元素可形成离子化合物| 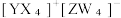 下列叙述正确的是
下列叙述正确的是
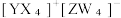 下列叙述正确的是
下列叙述正确的是| A.氧化性:Y2>W2 | B.电负性:Y>X>Z |
| C.YW3的空间结构为平面三角形 | D.第一电离能:Y<W |
您最近一年使用:0次
2023-10-17更新
|
476次组卷
|
4卷引用:云南省部分名校2023-2024学年高三上学期10月联考理科综合化学试题