1 . 某微粒的核外电子排布式为1s22s22p6,下列关于该微粒的说法一定正确的是( )
| A.质子数为10 | B.单质具有还原性 |
| C.是单原子分子 | D.电子数为10 |
您最近一年使用:0次
2018-06-27更新
|
316次组卷
|
5卷引用:云南省绿春县高级中学2019-2020学年高二上学期期末考试化学试题
名校
2 . 下列各原子或离子的电子排布式错误的是( )
| A.Na+:1s22s22p6 | B.F:1s22s22p5 |
| C.Cl-:1s22s22p63s23p5 | D.Mn:1s22s22p63s23p63d54s2 |
您最近一年使用:0次
2018-06-25更新
|
153次组卷
|
4卷引用:云南省石屏县一中2017-2018学年高二下学期六月份月考化学试题
名校
3 . 下列原子半径的大小顺序正确的是( )
①2s22p2 ②3s23p3 ③2s22p4 ④3s23p2
①2s22p2 ②3s23p3 ③2s22p4 ④3s23p2
| A.③>④>②>① | B.④>③>②>① |
| C.④>③>①>② | D.④>②>①>③ |
您最近一年使用:0次
2018-06-25更新
|
79次组卷
|
2卷引用:云南省石屏县一中2017-2018学年高二下学期六月份月考化学试题
名校
4 . 关于原子核外电子排布的下列叙述正确的是( )
| A.原子核外电子的能量按K、L、M、N电子层的顺序依次减小 |
| B.原子核外次外层电子数不超过18个,倒数第三层不超过32个 |
| C.某原子的K电子层为最外层,该电子层最多可容纳8个电子 |
| D.某原子核外有三个电子层,其L层为次外层,最多可容纳18个电子 |
您最近一年使用:0次
2018-06-25更新
|
169次组卷
|
3卷引用:云南省石屏县一中2017-2018学年高一下学期六月份月考化学试题
5 . 周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子。
回答下列问题:
b、c、d中第一电离能最大的是________ (填元素符号),e的价层电子轨道示意图为________________ 。
回答下列问题:
b、c、d中第一电离能最大的是
您最近一年使用:0次
名校
6 . 具有以下结构的原子一定属于p区元素的是( )
①最外层有3个电子的原子 ②最外层电子排布式为ns2的原子 ③最外层有3个未成对电子的原子 ④最外层电子形成全满结构的原子
①最外层有3个电子的原子 ②最外层电子排布式为ns2的原子 ③最外层有3个未成对电子的原子 ④最外层电子形成全满结构的原子
| A.②③ | B.①③ |
| C.②④ | D.①④ |
您最近一年使用:0次
2018-05-02更新
|
785次组卷
|
7卷引用:云南省红河县一中2020-2021学年高二下学期6月份考试化学试题
7 . 下列说法中正确的是( )
| A.主族元素的价电子全排布在最外层的ns或np轨道上 |
| B.过渡元素的原子,价电子排布全部为(n-1)d1~10ns2 |
| C.d轨道不可以参与化学键的形成 |
| D.所有元素的共同特点是原子的价电子都排布在最外电子层上 |
您最近一年使用:0次
2018-05-02更新
|
143次组卷
|
2卷引用:云南省元阳县一中2020-2021学年高二下学期6月份考试化学试题
名校
解题方法
8 . 纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1价和+2价的化合物。
(1)写出基态Cu+的核外电子排布式___________________________________ 。
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为________ 。
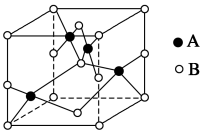
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过________ 键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是____ 。与NH3分子互为等电子体的一种微粒是________ 。
(4)CuO的熔点比CuCl的熔点____ (填“高”或“低”)。
(1)写出基态Cu+的核外电子排布式
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为

(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过
(4)CuO的熔点比CuCl的熔点
您最近一年使用:0次
2018-02-11更新
|
206次组卷
|
7卷引用:云南省石屏县第一中学2021-2022学年高二下学期3月份考试化学试题
名校
9 . 以下电子排布式是基态原子的电子排布的是( )
①1s12s1 ②1s22s12p1 ③1s22s22p63s2 ④1s22s22p63s23p1
①1s12s1 ②1s22s12p1 ③1s22s22p63s2 ④1s22s22p63s23p1
| A.①② | B.①③ | C.②③ | D.③④ |
您最近一年使用:0次
2018-02-11更新
|
1146次组卷
|
11卷引用:云南省金平县第一中学2019-2020学年高二上学期期末考试化学试题
云南省金平县第一中学2019-2020学年高二上学期期末考试化学试题宁夏吴忠市2017-2018学年高二人教版选修3化学同步练习:第1章 原子结构与性质综合练习1人教版2017-2018学年高二化学选修三同步训练:1.1 原子结构(第2课时)云南省泸水五中2018-2019学年高二上学期期中考试化学试题【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题云南省鹤庆三中2018-2019学年高二下学期期末考试化学试题山西省运城市永济涑北中学2019-2020学年高二下学期3月月考化学试题陕西省咸阳百灵学校2019-2020学年高二下学期第二次月考化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第一节 原子结构云南省玉溪市江川区第一中学2021-2022学年高二下学期3月月考化学试题云南省西双版纳傣族自治州第一中学2022-2023学年高二下学期期末考试化学试题
名校
10 . 主族元素原子失去最外层电子形成阳离子,主族元素原子得到电子填充在最外层形成阴离子。下列各原子或离子的电子排布式错误的是( )
| A.Ca2+ 1s22s22p63s23p6 | B.O2- 1s22s23p4 |
| C.Fe 1s22s22p63s23p63d64s2 | D.Fe2+ 1s22s22p63s23p63d6 |
您最近一年使用:0次
2018-02-11更新
|
303次组卷
|
10卷引用:云南省石屏县一中2017-2018学年高二下学期六月份月考化学试题
云南省石屏县一中2017-2018学年高二下学期六月份月考化学试题云南省河口县一中2018-2019学年高二上学期期中考试化学试题宁夏吴忠市2017-2018学年高二人教版选修3化学同步练习:第1章 原子结构与性质综合练习1宁夏银川市唐徕回民中学2017-2018学年高二4月月考化学试题云南省玉溪市华宁二中2018-2019学年9月份考试高二化学试题贵州省普定县一中2018-2019学年高二上学期期中考试化学试题云南省昭通市彝良县第一中学2018-2019学年高二上学期12月考试化学试题云南省盐津县三中2018-2019学年高二第一学期12月份考试化学试题云南省梁河县第一中学2019-2020学年高二上学期期末考试化学试题河南省新乡市辉县市第二高级中学2019-2020学年高二下学期期中考试化学试题



