名校
解题方法
1 . I.Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为_________ 。
(2)Li及其周期表中相邻元素的第一电离能(I1),I1(Li)> I1(Na),原因是_________ 。
Ⅱ.氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。
(3)NH3BH3分子中,N—B化学键称为________ 键,其电子对由_______ 提供。氨硼烷在催化剂作用下水解释放氢气: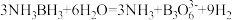 ,
,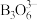 的结构如图所示:
的结构如图所示:
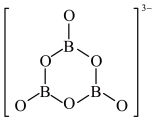
在该反应中,B原子的杂化轨道类型由________ 变为__________ 。
(4)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是__________ 。
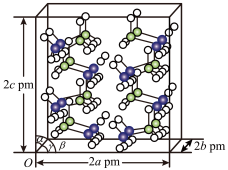
(5)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。氨硼烷晶体的密度ρ=______ g·cm−3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为
(2)Li及其周期表中相邻元素的第一电离能(I1),I1(Li)> I1(Na),原因是
Ⅱ.氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。
(3)NH3BH3分子中,N—B化学键称为
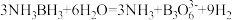 ,
,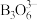 的结构如图所示:
的结构如图所示:
在该反应中,B原子的杂化轨道类型由
(4)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是
(5)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。氨硼烷晶体的密度ρ=

您最近一年使用:0次
2020-11-02更新
|
393次组卷
|
2卷引用:云南省红河州2021届高中毕业生第一次复习统一检测理综化学试题
名校
2 . 下列有关物质结构和性质变化规律正确的是( )
| A.酸性:HF>HCl>HBr |
| B.碱性:KOH>Ca(OH)2>Mg(OH)2 |
| C.沸点:H2O>H2S>H2Se |
| D.第一电离能:Al>Mg>Na |
您最近一年使用:0次
2020-09-06更新
|
205次组卷
|
2卷引用:云南省泸西县第一中学2021-2022学年高二下学期期中考试化学试题
3 . 电能是一种无污染、可再生的二级能源。储电材料种类繁多。如图是两种储电材料,请阅读试题、观察图片,回答问题。
Ⅰ.新型碳氮材料的储电能力应用前景广阔。其基本构成单元如图所示。

(1)图1中化学键σ键与π键之比为_____ ;图2中碳原子的杂化方式为_____ 。
(2)图3中,储电材料的分子式可以表示为_____ 。
(3)碳元素与氮元素的电负性大小关系为____ 。氮元素与氧元素的第一电离能大小关系为_______ 。
(4)碳的最高价含氧酸根的空间构型是_____ ;硝酸的酸性强于亚硝酸的原因是_____ 。
Ⅱ.传统锂电池的主要成分是 LiCoO2其晶胞结构如图所示;因结构中存在笼状空隙, 可以与Ni 和Mn 发生位置替换, 形成储电性能更加优良的化合物LiNi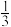 Mn
Mn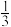 Co
Co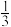 O2。
O2。

(5)基态 Co 原子的价电子排布式为_______ ; 化合物 LiCoO2中 O元素在晶胞中的位置,除了位于六棱柱的顶点外,其他具体位置是_____ 。
(6)已知化合物中各原子半径依次为:Li=a,Ni=b,Mn=c,Co=d,O= e,晶胞的棱长为 m,底边边长为n ,该晶体的空间利用率的计算表达式为________ (用含有 a、b、c、d、e、m、n 的式子表示 )。
Ⅰ.新型碳氮材料的储电能力应用前景广阔。其基本构成单元如图所示。

(1)图1中化学键σ键与π键之比为
(2)图3中,储电材料的分子式可以表示为
(3)碳元素与氮元素的电负性大小关系为
(4)碳的最高价含氧酸根的空间构型是
Ⅱ.传统锂电池的主要成分是 LiCoO2其晶胞结构如图所示;因结构中存在笼状空隙, 可以与Ni 和Mn 发生位置替换, 形成储电性能更加优良的化合物LiNi
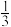 Mn
Mn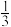 Co
Co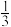 O2。
O2。
(5)基态 Co 原子的价电子排布式为
(6)已知化合物中各原子半径依次为:Li=a,Ni=b,Mn=c,Co=d,O= e,晶胞的棱长为 m,底边边长为n ,该晶体的空间利用率的计算表达式为
您最近一年使用:0次
解题方法
4 .  、
、 、
、 、
、 、S、P等元素常用于化工材料的合成。回答下列问题:
、S、P等元素常用于化工材料的合成。回答下列问题:
(1)钴原子的基态电子排布式为_______________________ 。
(2) 有
有________ 几种不同的运动状态的电子, 比
比 更稳定的原因是
更稳定的原因是_________ 。
(3)硒为第四周期元素,相邻元素有砷和溴,则三种元素的电负性从大到小的顺序为_________ (用元素符号表示)。
(4) 的熔点为340℃,加热易升华,固体
的熔点为340℃,加热易升华,固体 属于
属于______ 晶体。 的空间构型为
的空间构型为_____ 。
(5) 可用于制造火柴,其分子结构如图甲所示。
可用于制造火柴,其分子结构如图甲所示。 分子中S的杂化方式为
分子中S的杂化方式为______ 。每个 分子中含有的孤电子对的数目为
分子中含有的孤电子对的数目为_________ 。

(6)铜的某种氧化物晶胞结构如图乙所示,该氧化物的化学式为____________ 。若该晶胞的边长为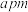 ,阿伏加 德罗常数值为
,阿伏加 德罗常数值为 ,则该氧化物的密度为
,则该氧化物的密度为_________ 
 、
、 、
、 、
、 、S、P等元素常用于化工材料的合成。回答下列问题:
、S、P等元素常用于化工材料的合成。回答下列问题:(1)钴原子的基态电子排布式为
(2)
 有
有 比
比 更稳定的原因是
更稳定的原因是(3)硒为第四周期元素,相邻元素有砷和溴,则三种元素的电负性从大到小的顺序为
(4)
 的熔点为340℃,加热易升华,固体
的熔点为340℃,加热易升华,固体 属于
属于 的空间构型为
的空间构型为(5)
 可用于制造火柴,其分子结构如图甲所示。
可用于制造火柴,其分子结构如图甲所示。 分子中S的杂化方式为
分子中S的杂化方式为 分子中含有的孤电子对的数目为
分子中含有的孤电子对的数目为
(6)铜的某种氧化物晶胞结构如图乙所示,该氧化物的化学式为
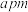 ,阿伏加 德罗常数值为
,阿伏加 德罗常数值为 ,则该氧化物的密度为
,则该氧化物的密度为
您最近一年使用:0次
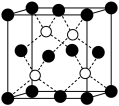
5 . 自然界中存在大量的元素,如钠、镁、铝、铁、铜、砷、锌、镍等在生活中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式________ ,砷属于________ 区元素。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
则A原子的价电子排布式为___________________________ 。
(3)锌化铜是一种金属互化物,其化学式有多种形式,如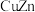 ,
,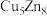 ,
, 等。其中所含元素铜的第二电离能
等。其中所含元素铜的第二电离能________ (填“大于”“小于”或“等于”)锌的第二电离能。
(4)用锌还原 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体 。该晶体所含元素中,电负性最大的元素是
。该晶体所含元素中,电负性最大的元素是________ ,与Ti形成配位键的配体是________ , 该配合物中含有
该配合物中含有 键的数目为
键的数目为________ 。
(5) 能形成多种配离子,如
能形成多种配离子,如 ,
, 等。
等。 的空间构型为:
的空间构型为:________ ;与 互为等电子体的分子有:
互为等电子体的分子有:___________________ (填分子式)。
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示 ,白色球表示
,白色球表示 ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=________  (用
(用 表示阿伏加 德罗常数)
表示阿伏加 德罗常数)
(1)请写出Fe的基态原子核外电子排布式
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能 |  |  |  |  |
| A | 932 | 1821 | 15390 | 21771 |
则A原子的价电子排布式为
(3)锌化铜是一种金属互化物,其化学式有多种形式,如
 ,
, ,
, 等。其中所含元素铜的第二电离能
等。其中所含元素铜的第二电离能(4)用锌还原
 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体 。该晶体所含元素中,电负性最大的元素是
。该晶体所含元素中,电负性最大的元素是 该配合物中含有
该配合物中含有 键的数目为
键的数目为(5)
 能形成多种配离子,如
能形成多种配离子,如 ,
, 等。
等。 的空间构型为:
的空间构型为: 互为等电子体的分子有:
互为等电子体的分子有:(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示
 ,白色球表示
,白色球表示 ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ= (用
(用 表示阿伏加 德罗常数)
表示阿伏加 德罗常数)
您最近一年使用:0次
名校
解题方法
6 . X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,Y、Z间形成的某种化合物是一种常用的漂白剂、供氧剂,R和Z位于同一周期且基态原子中有3个电子能量最高,M2+与过量氨水作用先得到蓝色沉淀,后转化为深蓝色溶液Q。请回答下列问题:
(1)基态M2+的核外电子排布式为__ ,Y、Z、R、M四种元素的第一电离能由大到小的顺序为__ (用元素符号表示)。
(2)化合物XCl3的中心原子的杂化类型为__ ,RCl3的立体构型为__ ,XCl3、RCl3分子中属于非极性分子的是__ ;导致Q溶液显色的粒子中存在的化学键类型有__ 与配位键。
(3)已知H2Y2的熔点为-0.43℃、沸点为158℃,RH3的熔点为-133℃、沸点为-87.7℃,但H2Y2、RH3的相对分子质量相同,其主要原因是__ 。
(4)X、R两元素可形成一种具体立体网状结构的化合物,其晶胞结构如图所示。

①该化合物的晶体类型是__ ,该晶体的化学式为___ 。
②设两个X原子最近距离为apm,列式计算该晶胞的密度ρ=__ g·cm-3。
(1)基态M2+的核外电子排布式为
(2)化合物XCl3的中心原子的杂化类型为
(3)已知H2Y2的熔点为-0.43℃、沸点为158℃,RH3的熔点为-133℃、沸点为-87.7℃,但H2Y2、RH3的相对分子质量相同,其主要原因是
(4)X、R两元素可形成一种具体立体网状结构的化合物,其晶胞结构如图所示。

①该化合物的晶体类型是
②设两个X原子最近距离为apm,列式计算该晶胞的密度ρ=
您最近一年使用:0次
名校
解题方法
7 . 下表是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
| 元素 | A | B | C | D | E |
| 最低化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| A.C、D、E的简单氢化物的稳定性:C>D>E |
| B.元素A的原子最外层中无自旋状态相同的电子 |
| C.元素B、C之间不可能形成化合物 |
D.与元素B同周期且在该周期中第一电离能最小的元素的单质能与 发生置换反应 发生置换反应 |
您最近一年使用:0次
2020-04-09更新
|
782次组卷
|
25卷引用:云南省开远市第二中学校2019-2020学年高二上学期期末考试化学试题
云南省开远市第二中学校2019-2020学年高二上学期期末考试化学试题2016-2017学年安徽省六安市第一中学高二下学期第一次阶段检测化学试卷宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题(已下线)专题11.1 原子结构与性质(练)-《2020年高考一轮复习讲练测》宁夏回族自治区吴忠市青铜峡市高级中学2019-2020学年高二上学期期末考试化学试题人教化学选修3第一章第二节课时4人教化学选修3第一章第二节课时5天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题第1章 原子结构——B拓展区综合拓展(鲁科版选修3)山东省济南市章丘区第四中学2019-2020学年高二下学期第六次教学质量检测化学试题(已下线)练习18 原子结构与元素的性质-2020-2021学年【补习教材·寒假作业】高二化学(人教版)鲁科版2019选择性必修2第1章 原子结构与元素性质 微项目 甲醛的危害与去除——利用电负性分析与预测物质性质(人教版2019)选择性必修2 第一章 原子结构与性质 B素养拓展区(已下线)第一单元 原子结构(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)宁夏吴忠市吴忠中学2020-2021学年高二3月月考化学试题河北省衡水市武强中学2020-2021学年高二下学期第一次月考化学试题四川省成都市蒲江县蒲江中学2019-2020学年高二下学期5月月考化学试题河北省石家庄市第一中学2019-2020学年高二下学期第一次月考化学试题辽宁省沈阳市重点高中联合体2021-2022学年高二12月考试化学试题(已下线)1.2.3 元素的电负性及其变化规律-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)1.2.2 原子结构与元素周期律(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第1章 章末综合测评A-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)重庆市育才中学2021-2022学年上学期高二上学期第六次定时练习化学试题安徽省池州市第一中学2022-2023学年高二下学期第一次月考化学试题云南省大理州实验中学2021-2022学年高二下学期化学期中考试题
名校
解题方法
8 . 已知某原子结构示意图为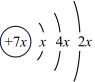 ,下列有关说法正确的是
,下列有关说法正确的是
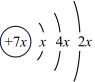 ,下列有关说法正确的是
,下列有关说法正确的是| A.结构示意图中x=4 |
| B.该原子的电子排布式为1s22s22p63s23p4 |
C.该原子基态的电子排布图为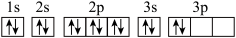 |
| D.该原子结构中共有5个能级上填充有电子 |
您最近一年使用:0次
2020-03-24更新
|
746次组卷
|
20卷引用:云南省绿春县高级中学2019-2020学年高二上学期期末考试化学试题
云南省绿春县高级中学2019-2020学年高二上学期期末考试化学试题贵州省安顺市普定县第一中学2018-2019学年高二上学期12月考试化学试题云南省丘北二中2018-2019学年高二下学期期末考试化学试题云南省玉溪市新平三中2019-2020学年高二上学期12月份月考化学试题山西省孝义市2019-2020学年高二下学期3月阶段性考试化学试题课时1 基态原子的核外电子排布——A学习区 夯实基础(鲁科版选修3)吉林省辽源市东辽县第一高级中学2019-2020高二5月月考化学试题安徽省六安市舒城中学2019-2020学年高二下学期第一次月考化学试题河南省新乡市辉县市第二高级中学2019-2020学年高二下学期期中考试化学试题(已下线)第34讲 原子结构与性质-2021年高考化学一轮复习名师精讲练甘肃省兰州市第一中学2020-2021学年高二下学期期中考试化学试题(已下线)第30讲 原子结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)1.1 原子结构(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)第一节 原子结构 第3课时 泡利原理、洪特规则、能量最低原理(已下线)第五章 物质结构与性质元素周期律 第26练 原子结构 核外电子排布原理江西省宜春市铜鼓中学2022-2023学年高二下学期第一次段考化学试题陕西省宝鸡市金台区2022-2023学年高二下学期期中质量检测化学试题陕西省西安市西北工业大学附属中学2023-2024学年高二上学期第二次月考化学试题湖南省张家界市民族中学2023-2024学年高二上学期第四次月考化学试题新疆阿克苏市实验中学2022-2023学年高二下学期第三次月考化学试题
9 . 下列说法错误的是
| A.焰色反应与电子跃迁有关 |
B.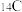 和 和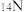 的质量数相等,它们互为同位素 的质量数相等,它们互为同位素 |
| C.元素电负性越大的原子,吸引电子的能力越强 |
D.根据对角线规则, 是弱酸 是弱酸 |
您最近一年使用:0次
2020-03-04更新
|
377次组卷
|
6卷引用:云南省开远市第一中学校2021-2022学年高二下学期开学考试化学试题
云南省开远市第一中学校2021-2022学年高二下学期开学考试化学试题人教化学选修3第一章第二节课时4(人教版2019)选择性必修2 第一章 原子结构与性质 B素养拓展区(已下线)第1章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)广东省惠州市丰湖高级中学2022-2023学年高二下学期第一次段考化学试题(已下线)BBWYhjhx1113.pdf
名校
10 . 以下能级符号不正确的是

| A.6s | B.5p | C.4d | D.3f |
您最近一年使用:0次
2020-01-07更新
|
74次组卷
|
5卷引用:云南省石屏县第一中学2021-2022学年高二下学期3月份考试化学试题



