解题方法
1 . 铝镍钴系永磁合金以铁,镍、铝元素为主要成分,还含有铜、钴、钛等元素.具有高剩磁和低温度系数,磁性稳定.现多用于仪表工业中制造磁电系仪表、流量计、微特电机,继电器等。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小,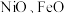 的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为
的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为________ ,熔沸点:
____  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
(2) 俗称摩尔盐,相对于
俗称摩尔盐,相对于 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制 (Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是
(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是___________ 。
(3)氢能源发展的关键环节是新型储氢材料,氨硼烷 常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。
常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。
①氨硼烷分子中B原子采取_________ 杂化。
②氨硼烷晶体中存在的作用力有范德华力,极性键、________ 和________ 。
(4)立方氮化硼 晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
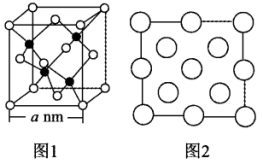
图2是立方氮化硼晶胞的俯视投影图.请在图中用“●”标明B原子的相对位置________ 。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小,
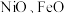 的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为
的晶体结构类型与氯化钠相同.基态钴原子价电子轨道表示式为
 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。(2)
 俗称摩尔盐,相对于
俗称摩尔盐,相对于 而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制
而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制 (Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是
(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是(3)氢能源发展的关键环节是新型储氢材料,氨硼烷
 常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。
常温下以固体稳定存在,极易溶于水,是一种理想的新型储氢材料。①氨硼烷分子中B原子采取
②氨硼烷晶体中存在的作用力有范德华力,极性键、
(4)立方氮化硼
 晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
晶体的晶胞结构如图1所示,N原子为面心立方最密堆积。
图2是立方氮化硼晶胞的俯视投影图.请在图中用“●”标明B原子的相对位置
您最近一年使用:0次
解题方法
2 . 价电子排布式为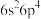 的元素不可能具有的性质是
的元素不可能具有的性质是
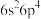 的元素不可能具有的性质是
的元素不可能具有的性质是A.该元素的最高化合价呈 价 价 | B.该元素单质具有强氧化性 |
| C.该元素能与氢气反应生成气态氢化物 | D.该元素基态原子的价电子排布图为 |
您最近一年使用:0次
名校
3 . 下列化学用语表示不正确的是
A. 的球棍模型: 的球棍模型: |
B.sp2杂化轨道模型: |
C.HIO的电子式: |
D.用原子轨道描述氯化氢分子中化学键的形成: |
您最近一年使用:0次
2021-07-12更新
|
241次组卷
|
2卷引用:山东省德州市2020-2021学年高二下学期期末考试化学试题
名校
解题方法
4 . KZnF3被认为是良好的光学基质材料,可由K2CO3、ZnF2、NH4HF2制备。回答下列问题;
(1)基态F原子的价电子轨道表达式为__ ;基态Zn原子核外占据最高能层电子的电子云轮廓图形状为___ 。
(2)O的第一电离能____ (填"大于"或"小于")N的第一电离能,原因为___ 。
(3)K2CO3中阴离子的立体构型为____ 。
(4)NH4HF2的组成元素的电负性由大到小的顺序为____ 。(用元素符号表示);其中N原子的杂化方式为___ ;HF能形成分子缔合体(HF)n的原因为____ 。
(5)ZnF2具有金红石型四方结构,KZnF3具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示∶
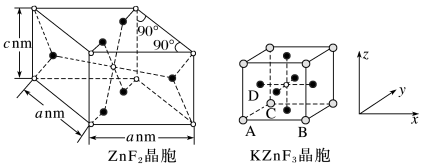
①ZnF2和KZnF3晶体(晶胞顶点为K+)中,Zn的配位数之比为____ 。
②若NA表示阿伏加德罗常数的值,则ZnF2晶体的密度为____ g·cm-3(用含a、c、NA的代数式表示)。
③KZnF3晶胞中原子坐标参数A为(0,0,0),B为(1,0,0),C为(0,1,0),则D的原子坐标参数为___ 。
(1)基态F原子的价电子轨道表达式为
(2)O的第一电离能
(3)K2CO3中阴离子的立体构型为
(4)NH4HF2的组成元素的电负性由大到小的顺序为
(5)ZnF2具有金红石型四方结构,KZnF3具有钙钛矿型立方结构,两种晶体的晶胞结构如图所示∶

①ZnF2和KZnF3晶体(晶胞顶点为K+)中,Zn的配位数之比为
②若NA表示阿伏加德罗常数的值,则ZnF2晶体的密度为
③KZnF3晶胞中原子坐标参数A为(0,0,0),B为(1,0,0),C为(0,1,0),则D的原子坐标参数为
您最近一年使用:0次
名校
解题方法
5 . 下列对一些实验事实的理论解释正确的是
| 选项 | 实验事实 | 理论解释 |
| A |  、NH3空间构型为三角锥 、NH3空间构型为三角锥 |  、NH3中心原子均为sp3杂化且均有一对孤对电子 、NH3中心原子均为sp3杂化且均有一对孤对电子 |
| B | 白磷为正四面体分子 | 白磷分子中P—Р键间的夹角是109.5° |
| C | HF的沸点高于HCl | H—F的键能比H—Cl的键能大 |
| D | 硼酸固体难溶于水,加热溶解度增大 | 加热后,硼酸分子之间的氢键部分断裂,与水分子产生氢键作用 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-05-19更新
|
346次组卷
|
2卷引用:山东省青岛胶州市2020-2021学年高二下学期期中考试化学试题
6 . 邻、间、对三种硝基苯酚的结构简式和熔点信息见表。下列说法错误的是
| 化合物 | 邻硝基苯酚 | 间硝基苯酚 | 对硝基苯酚 |
| 结构简式 |  |  |  |
| 熔点(℃) | 45 | 96 | 114 |
| A.电负性大小顺序为:O>N>C>H |
| B.邻硝基苯酚易形成分子内氢键,其熔点低于另两种硝基苯酚 |
| C.对硝基苯酚易形成分子间氢键,其熔沸点较高 |
| D.三种硝基苯酚的化学性质完全相同 |
您最近一年使用:0次
2021-05-19更新
|
420次组卷
|
2卷引用:山东省青岛胶州市2020-2021学年高二下学期期中考试化学试题
解题方法
7 . 磷酸亚铁锂( )电池是新能源汽车的动力电池之一,工作原理为LiFePO4+C=LixC+Li1-xFePO4。回答下列问题:
)电池是新能源汽车的动力电池之一,工作原理为LiFePO4+C=LixC+Li1-xFePO4。回答下列问题:
(1)下列关于Li原子电子排布图表示的状态中,能量最高的为___ (填标号)。
a.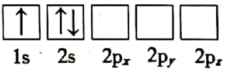
b.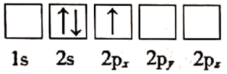
c.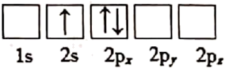
d.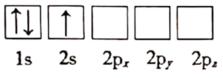
(2)LiFePO4中PO 的空间构型为
的空间构型为___ ,与其互为等电子体的分子有___ (填一种即可)。
(3)卤素与磷可形成多种磷化物PF3、PCl3、PBr3、PI3,则他们的熔点由高到低的顺序为___ ,键角由小到大的顺序为___ 。
(4)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P中,第一电离能最大的是___ (填元素符号),判断依据是___ 。
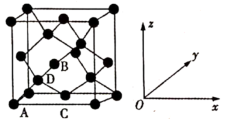
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,如图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为(0.5,0,0.5);C为(0.5,0.5,0)。则D原子的坐标参数为__ 。
②晶胞参数,描述晶胞的大小和形状,已知金刚石的晶胞参数a=xnm,其密度为__ g∙cm−3(用含x的式子表示)。
 )电池是新能源汽车的动力电池之一,工作原理为LiFePO4+C=LixC+Li1-xFePO4。回答下列问题:
)电池是新能源汽车的动力电池之一,工作原理为LiFePO4+C=LixC+Li1-xFePO4。回答下列问题:(1)下列关于Li原子电子排布图表示的状态中,能量最高的为
a.

b.

c.

d.

(2)LiFePO4中PO
 的空间构型为
的空间构型为(3)卤素与磷可形成多种磷化物PF3、PCl3、PBr3、PI3,则他们的熔点由高到低的顺序为
(4)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P中,第一电离能最大的是

(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,如图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为(0.5,0,0.5);C为(0.5,0.5,0)。则D原子的坐标参数为
②晶胞参数,描述晶胞的大小和形状,已知金刚石的晶胞参数a=xnm,其密度为
您最近一年使用:0次
8 . 秦兵马俑展现了我国古代科技文化的伟大成就。近年来人们研究发现秦俑彩绘所用的原料的主要成分为BaCuSi2O6,含有微量硫元素等。回答下列问题:
(1)原子轨道是指电子在原子核外的___________ 。Cu原子核外电子占据最高能级的符号是___________ ,Cu原子核外最外层电子的电子云轮廓图形状为___________ 。
(2)硫化硅为白色晶体,分子式为SiS2,遇水分解为SiO2及H2S气体,分解反应中所涉及的
所有元素的电负性由大到小的顺序为___________ (填元素符号);SiS2的结构与CS2类似,则SiS2分子的空间构型为___________ 。
(3)一种含Cu、S元素的有机物的结构简式如图1所示,该有机物中存在的作用力类型有_______ (填标号),N原子的杂化方式为___________ 。
a.极性键 b.离子键 c.非极性键 d.配位键 e.金属键

(4)TiO2与BaCO3一起熔融可制得钛酸钡(BaTiO3),晶胞结构如图2所示(O2−均与Ti4+、Ba2+相接触),已知O2−的半径为xpm,晶胞边长为ypm,则Ti4+、Ba2+的半径分别为___________ pm、_____ pm。
(1)原子轨道是指电子在原子核外的
(2)硫化硅为白色晶体,分子式为SiS2,遇水分解为SiO2及H2S气体,分解反应中所涉及的
所有元素的电负性由大到小的顺序为
(3)一种含Cu、S元素的有机物的结构简式如图1所示,该有机物中存在的作用力类型有
a.极性键 b.离子键 c.非极性键 d.配位键 e.金属键

(4)TiO2与BaCO3一起熔融可制得钛酸钡(BaTiO3),晶胞结构如图2所示(O2−均与Ti4+、Ba2+相接触),已知O2−的半径为xpm,晶胞边长为ypm,则Ti4+、Ba2+的半径分别为
您最近一年使用:0次
9 . 磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外子排布式为_______ 。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为_______ ,电负性由大到小的顺序为_______ 。
(3)AsCl3分子的立体构型为_______ ,其中As的杂化轨道类型为_______ 。
(4)H2O与H2S为同族元素的氢化物,H2O可以形成H9O 或H3O+,而H2S几乎不能形成类似的H9S
或H3O+,而H2S几乎不能形成类似的H9S 或H3S+,其原因是
或H3S+,其原因是_______ 。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2 000 ℃,其晶胞结构如图所示。
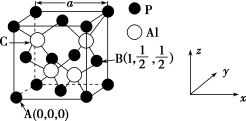
①磷化铝的晶体类型为_______ 。
②A、B点的原子坐标如图所示,则C点的原子坐标为_______ 。
③磷化铝的晶胞参数a=546.35 pm,其密度为_______ g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
(1)基态砷原子的核外子排布式为
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为
(3)AsCl3分子的立体构型为
(4)H2O与H2S为同族元素的氢化物,H2O可以形成H9O
 或H3O+,而H2S几乎不能形成类似的H9S
或H3O+,而H2S几乎不能形成类似的H9S 或H3S+,其原因是
或H3S+,其原因是(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2 000 ℃,其晶胞结构如图所示。

①磷化铝的晶体类型为
②A、B点的原子坐标如图所示,则C点的原子坐标为
③磷化铝的晶胞参数a=546.35 pm,其密度为
您最近一年使用:0次
2021-04-22更新
|
395次组卷
|
3卷引用:山东省泰安第四中学2020-2021学年高二下学期期中考试化学试题
解题方法
10 . 尿素的结构简式可表示为 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是A. 尿素分子中含有 尿素分子中含有 键 键 |
B.尿素分子中四种元素的电负性: |
C.尿素分子中四种元素的第一电离能: |
D.根据结构推测:尿素易溶于水,其熔、沸点低于丙酮( ) ) |
您最近一年使用:0次
2021-04-09更新
|
682次组卷
|
4卷引用:押山东卷第04题 物质结构与性质选择题-备战2021年高考化学临考题号押题(山东卷)
(已下线)押山东卷第04题 物质结构与性质选择题-备战2021年高考化学临考题号押题(山东卷)辽宁省锦州市2021届高考第一次模拟(普通高中高三质量检测)化学试题(已下线)基础卷02-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)湖南省邵阳市新邵县2021-2022学年高二下学期期末质量检测化学试题



