名校
解题方法
1 . 近年来我国航天事业成果显著,其制造材料中包含了铝、镁、锌、钛、锰、铜、镍、铬、硅、氮、氧等多种元素。回答下列问题:
(1)铬元素属于周期表中_______ 区的元素,其基态原子核外电子空间运动状态有_______ 种,
(2)钛能形成多种配合物,如Ti(CO)6、[Ti(H2O)6]Cl3、[Ti(NH3)6]Cl3等。其配合物的配位数均为_______ ,其中配位原子的电负性由小到大的顺序是_______ (写元素符号),[Ti(NH3)6]Cl3中∠H-N-H_______ (填“大于”、“小于”或“等于”)单个氨气分子中∠H-N-H,原因是_______ 。
(3)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为_______ 。
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为_______ ,其配位数为_______ 。已知晶胞参数为a pm,设阿伏加德罗常数的值为NA,晶胞密度
_______  。(列出计算式即可)
。(列出计算式即可)

(1)铬元素属于周期表中
(2)钛能形成多种配合物,如Ti(CO)6、[Ti(H2O)6]Cl3、[Ti(NH3)6]Cl3等。其配合物的配位数均为
(3)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为

 。(列出计算式即可)
。(列出计算式即可) 
您最近一年使用:0次
解题方法
2 . 为纪念DmitriMendeleev(德米特里·门德列夫)发明的元素周期表诞生150周年。联合国大会宣布2019年是“国际化学元素周期表年”。以下是元素周期表的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是___________ 。
(2)最高价氧化物的水化物中酸性最强的是___________ 。
(3)元素B原子核外有___________ 种能量不同的电子,基态C原子最高能级电子云形状是___________ 。
(4)比较元素的金属性:B___________ C(填“>”或“<”),从原子结构的角度说明理由___________ 。
(5)A分别与E、G、H形成的化合物中,最稳定的是___________
(6)检验B元素的方法是___________ ,请用原子结构的知识解释产生此现象的原因:___________ 。
(7)元素B的单质在空气中点燃生成X,X中的化学键除离子键,还有___________ (填“极性”或“非极性”)共价键,若将其投入硫酸亚铁溶液中,预测主要的反应现象是___________ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 1 | A | ||||||||
| 2 | D | E | G | ||||||
| 3 | B | C | J | H | I |
(2)最高价氧化物的水化物中酸性最强的是
(3)元素B原子核外有
(4)比较元素的金属性:B
(5)A分别与E、G、H形成的化合物中,最稳定的是
(6)检验B元素的方法是
(7)元素B的单质在空气中点燃生成X,X中的化学键除离子键,还有
您最近一年使用:0次
名校
解题方法
3 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序是________ 。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是________ 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________ 。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________ 。
A.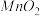 B.
B.
C. D.
D.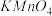
| 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
A.
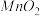 B.
B.
C.
 D.
D.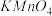
您最近一年使用:0次
2019-08-20更新
|
163次组卷
|
7卷引用:2015-2016学年河北省秦皇岛市卢龙县高一下学期期中考试化学试卷
2015-2016学年河北省秦皇岛市卢龙县高一下学期期中考试化学试卷(已下线)2014年高一化学人教版必修2 模块水平检测1练习卷(已下线)2013-2014山东省淄博市高一下学期期末考试化学试卷2015-2016学年山西省长治一中高一平行班下期中化学试卷云南省峨山彝族自治县第一中学2017-2018学年高二上学期期末市统测模拟考化学试题百所名校联考-必修二模块综合检测山东省泰安市新泰市第二中学2019-2020学年高一下学期期中考试化学试题
名校
4 . W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
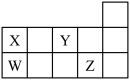

| A.四种元素中原子半径最大的为Z |
| B.四种元素最高价氧化物的水化物都是酸 |
| C.XZ4、WY2中所含化学键类型相同 |
| D.W、X形成的单质都是重要的半导体材料 |
您最近一年使用:0次
2019-06-29更新
|
735次组卷
|
5卷引用:河北省衡水市阜城中学2020-2021学年高二上学期开学考试化学试题
名校
解题方法
5 . 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应, 1mol E单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
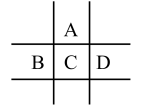
(1)A元素的名称为____________ ,D离子的结构示意图为_____________ 。
(2)C在周期表中的位置为______________________ 。
(3)元素C与元素D相比,非金属性较强的是__________ (用元素符号表示),下列表述中能证明这一事实的是________ 。(填字母序号)
a.常温下C的单质和D的单质状态不同
b.D的气态氢化物比C的气态氢化物稳定
c.一定条件下C和D的单质都能与氢氧化钠溶液反应
d.D的最高价氧化物的水化物的酸性比C的最高价氧化物的水化物的酸性强
e.D的单质能和C的钠盐溶液反应生成C的单质
(4)元素A的一种氢化物含有非极性键,A的这种氢化物的电子式是____________ 。
(5)A、C、D、E元素形成的简单离子半径的大小顺序是________ 。(用离子符号表示)
(6)E的最高价氧化物对应的水化物跟氢氧化钠溶液反应的化学方程式是________________ 。

(1)A元素的名称为
(2)C在周期表中的位置为
(3)元素C与元素D相比,非金属性较强的是
a.常温下C的单质和D的单质状态不同
b.D的气态氢化物比C的气态氢化物稳定
c.一定条件下C和D的单质都能与氢氧化钠溶液反应
d.D的最高价氧化物的水化物的酸性比C的最高价氧化物的水化物的酸性强
e.D的单质能和C的钠盐溶液反应生成C的单质
(4)元素A的一种氢化物含有非极性键,A的这种氢化物的电子式是
(5)A、C、D、E元素形成的简单离子半径的大小顺序是
(6)E的最高价氧化物对应的水化物跟氢氧化钠溶液反应的化学方程式是
您最近一年使用:0次
名校
6 . 已知短周期元素的离子 aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是
| A.原子序数 d>c>b>a | B.原子半径 A>B>D>C |
| C.离子半径 C>D>B>A | D.单质的还原性 A>B>D>C |
您最近一年使用:0次
2019-06-13更新
|
669次组卷
|
2卷引用:河北省鹿泉县第一中学2018-2019学年高一5月月考化学试题
7 . 科学家根据元素周期律和原子结构理论预测,原子序数为114的元素位于第七周期ⅣA族,称为类铅元素。下面关于它的原子结构和性质预测正确的是
| A.类铅元素原子的最外层电子数为6 |
| B.它的最高价氧化物水化物的碱性比铅的最高价氧化物水化物的碱性弱 |
| C.它的金属性比铅强 |
| D.它的原子半径比铅小 |
您最近一年使用:0次
2019-06-06更新
|
999次组卷
|
4卷引用:河北省衡水市桃城区第十四中学2019-2020学年高一下学期第四次综合测试化学试题
名校
解题方法
8 . 下表为元素周期表的一部分。
(1) 表中元素______ 的非金属性最强;元素______ 的金属性最强;元素______ 的单质室温下呈液态(填写元素符号);
(2) 表中元素⑿的原子结构示意图是___________ ;
(3) 表中元素⑤在周期表中的位置为____________________ ;
(4) 表中元素⑨和⑩最高价氧化物对应水化物的酸性:__________ >__________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | ⑾ | ⑿ | ⒀ | ||||
(1) 表中元素
(2) 表中元素⑿的原子结构示意图是
(3) 表中元素⑤在周期表中的位置为
(4) 表中元素⑨和⑩最高价氧化物对应水化物的酸性:
您最近一年使用:0次
真题
名校
9 . 2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表,下列推断不合理 的是
| A.第35号元素的单质在常温常压下是液体 |
| B.位于第四周期第ⅤA族的元素为非金属元素 |
| C.第84号元素的最高化合价是+7 |
| D.第七周期0族元素的原子序数为118 |
您最近一年使用:0次
2019-04-12更新
|
8188次组卷
|
38卷引用:河北省正定中学2019-2020学年高一3月月考化学试题
河北省正定中学2019-2020学年高一3月月考化学试题河北省承德市第一中学2019-2020学年高一下学期3月疫情期间直播课堂检测化学试题河北省石家庄市第二十三中学2020-2021学年高一上学期12月阶段考试化学试题河北省石家庄市第二十三中学2020-2021学年高一上学期第三次月考化学试题2019年4月浙江省普通高校招生选考科目考试化学试题安徽省阜阳市第三中学2018-2019学年高一下学期第二次调研考试化学试题(已下线)专题06 物质结构 元素周期律——2019年高考真题和模拟题化学分项汇编浙江省瑞安市上海新纪元高级中学2019-2020学年高一(7-10)班下学期期初考试化学试题甘肃省天水市第一中学2020届高三上学期第五次(期末)考试化学试题(已下线)【南昌新东方】2019 新建一中 高三期中 015(已下线)专题5.2 元素周期律和元素周期表(讲)——2020年高考化学一轮复习讲练测(已下线)专题5.2 元素周期律和元素周期表(练)——2020年高考化学一轮复习讲练测苏教版(2020)高一必修第一册专题5 总结检测人教版(2019)高一必修第一册第四章 物质结构 元素周期律 高考挑战区人教版(2019)高一必修第一册 第四章素养检测鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律第2节 元素周期律和元素周期表 方法帮 高考帮(已下线)第18讲 元素周期律和元素周期表(精讲)——2021年高考化学一轮复习讲练测高一必修第一册(苏教2019)专题5 第一单元 元素周期律和元素周期表3(已下线)练习9 元素周期表-2020-2021学年【补习教材·寒假作业】高一化学(人教版)(已下线)第一章 原子结构与性质【过关测试提高卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第14讲 元素周期律和元素周期表(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)吉林省延边第二中学2020-2021学年高二下学期第一次考试月考化学试题(已下线)专题07.物质结构 元素周期律-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)第五单元 物质结构与元素周期律(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题04 物质结构与元素周期律—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)第14讲 元素周期律和元素周期表(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)湖北省华中师范大学第一附属中学2022-2023学年高二上学期期中考试化学试题第一章 原子结构与性质(B卷·能力提升练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)(已下线)专题07 元素周期表与元素周期律云南省楚雄彝族自治州民族中学2022-2023学年高二下学期5月月考化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题11-15)宁夏石嘴山市第三中学2023-2024学年高二下学期3月月考化学试题
名校
10 . W、X、Y、Z、R为原子序数依次增大的短周期主族元素,W元素的一种核素可用于鉴定文物年代,X元素的一种单质可作为饮用水消毒剂,Y元素的简单离子是同周期元素的简单离子中半径最小的,Z元素和W元素同主族,R元素被称为“成盐元素”。下列说法错误的是
| A.W元素和X元素形成的化合物WX2属于非极性分子 |
| B.工业上常用电解熔融Y元素和R元素形成的化合物的方法来制取单质Y |
| C.制造日常生活中所使用的计算机芯片需要消耗大量单质Z |
| D.X元素和R元素形成的某种化合物可用于自来水的消毒 |
您最近一年使用:0次
2019-03-24更新
|
1520次组卷
|
5卷引用:河北省石家庄实验中学2019-2020学年高一3月月考化学试题
河北省石家庄实验中学2019-2020学年高一3月月考化学试题【全国百强校】湖南省长沙市雅礼中学2019届高三上学期月考(五)化学试题湖北省襄阳市第一中学2019-2020学年高二下学期四月月考化学试题江西省宜春市第九中学2019-2020学年高二下学期第二次月考化学(网班)试题(已下线)小题必刷22 元素周期表(律)及其应用——2021年高考化学一轮复习小题必刷(通用版)



