名校
解题方法
1 . 为维护国家安全和利益,经国务院批准,决定对镓、锗相关物项实施出口管制。镓的某种化合物的晶胞结构如下图所示(晶胞参数为a pm,1 pm=10-10cm,NA表示阿伏加德罗常数)。下列说法正确的是
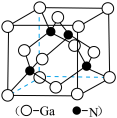

| A.Ga元素位于元素周期表的ds区 |
| B.晶体结构中N的配位数为6 |
| C.该物质的化学式为Ga4N4 |
D.该晶体的密度为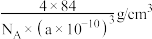 |
您最近一年使用:0次
2023-10-10更新
|
549次组卷
|
2卷引用:重庆市拔尖强基联盟(西南大学附中、育才中学)2023-2024学年高三10月联合考试化学试题
名校
解题方法
2 . 下列关于元素周期表及周期律的叙述,其中错误的是
①硫酸锶(SrSO4)是难溶于水的白色固体
②硒化氢(H2Se)是无色,有毒,比H2S稳定的气体
③锂(Li)在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
④卤素单质的熔点从F2到I2逐渐升高,碱金属单质的熔点从Li到Cs也逐渐升高
⑤元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
⑥砹(At)为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀酸
①硫酸锶(SrSO4)是难溶于水的白色固体
②硒化氢(H2Se)是无色,有毒,比H2S稳定的气体
③锂(Li)在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
④卤素单质的熔点从F2到I2逐渐升高,碱金属单质的熔点从Li到Cs也逐渐升高
⑤元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
⑥砹(At)为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀酸
| A.3个 | B.4个 | C.5个 | D.6个 |
您最近一年使用:0次
解题方法
3 . 氯化亚锡和锡酸钠都可在印染行业用作媒染剂。校化学小组从电镀锡渣(主要成分为Sn、SnO,含有砷和难溶于酸碱的杂质)中制取二水合氯化亚锡和锡酸钠,工艺流程如图所示:
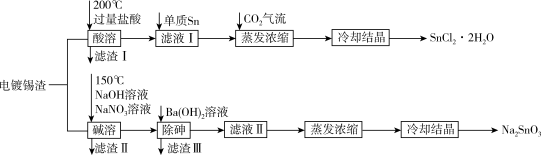
已知:
①Sn(II)具有还原性,可与Cl-形成[SnCl3]-
②As在碱溶时转化为Na3AsO4溶液
③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)Sn元素在周期表中的位置为_______ 。
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为_______ 。
(3)“酸溶”时SnO发生反应的离子方程式为_______ 。
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn发生反应的化学方程式_______ 。
(5)“滤液I”中,需加入少量单质Sn,原因是_______ 。
(6)“除砷”时,若溶液中c(AsO )=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的
)=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的_______ 。
(7)蒸发浓缩“滤液II”前,可往体系中加入适量的NaOH溶液,目的是________ 。

已知:
①Sn(II)具有还原性,可与Cl-形成[SnCl3]-
②As在碱溶时转化为Na3AsO4溶液
③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)Sn元素在周期表中的位置为
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为
(3)“酸溶”时SnO发生反应的离子方程式为
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn发生反应的化学方程式
(5)“滤液I”中,需加入少量单质Sn,原因是
(6)“除砷”时,若溶液中c(AsO
 )=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的
)=2mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×10-3mol/L,则沉淀中的As元素占原As元素总量的(7)蒸发浓缩“滤液II”前,可往体系中加入适量的NaOH溶液,目的是
您最近一年使用:0次
名校
4 . X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-离子具有相同的电子层结构。下列说法一定正确 的是
| A.原子最外层电子数:X>Y>Z | B.单质沸点:X>Y>Z |
| C.非金属性:X>Z>Y | D.原子序数:X>Y>Z |
您最近一年使用:0次
名校
解题方法
5 . 现有a~i 9种短周期元素,它们在同期表中的位置如下,请据此回答下列问题:(请用具体的元素符号及化学用语作答)
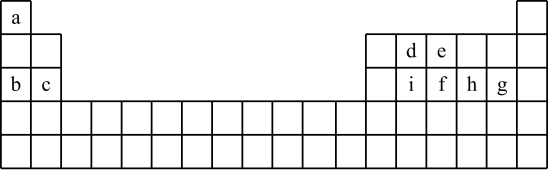
(1)a~i元素中,金属性最强的是________ ,最高价氧化物对应水化物中,酸性最强的物质是___________ 。g所在族的元素形成的氢化物中沸点最低的是____________________ 。
(2)比较b、e、g简单离子半径的大小___________________ (用离子符号作答)。
(3)写出由a~i 9种元素中的某些元素形成,且所有原子都满足最外层为8电子结构的任意两种化合物的化学式__________________ 、___________________ 。
(4)用一个化学反应方程式表示d的非金属性强于i_______________________________ 。
(5)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质。人们在周期表里金属和非金属的交界处找到了半导体材料。
①下列单质中,不能做半导体材料的物质是______ (填序号)。
A.Si B.Ge C.S
②砷(As)是e的同族元素,上比e多2个电子层,砷的一种核素含有42个中子,该核素的符号_________ ;镓(Ga)与As同周期,最外层有3个电子,Ga与As可以形成一种新型化合物半导体材料,其性能更优越。这种新型化合物化学式为____________________ 。
(6)c与a形成的化合物的电子式为___________ ,用电子式表示a与h形成a2h的过程__________________________________________ 。
(7)根据周期表对角线法则,金属Be和Al单质及化合物性质相似。试写出Be和氢氧化钠溶液反应的离子方程式_________________________________ 。

(1)a~i元素中,金属性最强的是
(2)比较b、e、g简单离子半径的大小
(3)写出由a~i 9种元素中的某些元素形成,且所有原子都满足最外层为8电子结构的任意两种化合物的化学式
(4)用一个化学反应方程式表示d的非金属性强于i
(5)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质。人们在周期表里金属和非金属的交界处找到了半导体材料。
①下列单质中,不能做半导体材料的物质是
A.Si B.Ge C.S
②砷(As)是e的同族元素,上比e多2个电子层,砷的一种核素含有42个中子,该核素的符号
(6)c与a形成的化合物的电子式为
(7)根据周期表对角线法则,金属Be和Al单质及化合物性质相似。试写出Be和氢氧化钠溶液反应的离子方程式
您最近一年使用:0次
名校
解题方法
6 . 根据信息回答以下与金属元素相关的问题。
I .镁、钙和锶(Sr)都属于碱土金属,具有相似的化学性质。
(1)钙在周期表中的位置为__________ 。锶比钙的金属性更强,它们的单质都能和水反应放出氢气,则锶与水反应的化学方程式为_____________ 。颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应那么剧烈,原因是__________ 。
(2)锶在一定条件下分别与N2、H2发生反应,生成Y、Z两种锶的化合物,Y、Z与水反应均可放出气体。0.0lmolY溶于l00mL盐酸恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为___________ , Z的电子式为_____________________ 。
II. KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(3)工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为_________________ 。此过程不用瓷坩埚的原因是_________________________ 。
(4)高锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体。实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为 ),写出检验Mn2+的离子方程式
),写出检验Mn2+的离子方程式_________________ 。
I .镁、钙和锶(Sr)都属于碱土金属,具有相似的化学性质。
(1)钙在周期表中的位置为
(2)锶在一定条件下分别与N2、H2发生反应,生成Y、Z两种锶的化合物,Y、Z与水反应均可放出气体。0.0lmolY溶于l00mL盐酸恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为
II. KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(3)工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为
(4)高锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体。实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为
 ),写出检验Mn2+的离子方程式
),写出检验Mn2+的离子方程式
您最近一年使用:0次
7 . W、X、Y、Z为原子序数依次增大的短周期主族元素,W的原子核外只有6个电子,X+和Y3+的电子层结构相同,Z-的电子数比Y3+多8个,下列叙述正确的是
| A.W在自然界只有一种核素 | B.半径大小:X+>Y3+>Z- |
| C.Y与Z形成的化合物的水溶液呈弱酸性 | D.X的最高价氧化物对应的水化物为弱碱 |
您最近一年使用:0次
2017-05-25更新
|
1001次组卷
|
4卷引用:重庆市2019-2020学年高三下学期网络考试化学试题
8 . 下图是元素周期表的一部分。
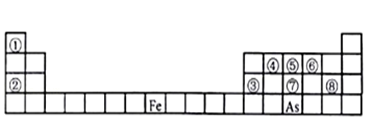
Ⅰ、用化学用语回答下列问题:
(1)由②、⑥两元素形成的强氧化性物质的电子式为_______ ,由①、⑤两元素构成的10电子化合物的形成过程为_______ 。
(2)⑦、⑧的最高价含氧酸的酸性较弱的是_______ 。(化学式表示)
(3)As在元素周期表中位置为__ ;氢化物的沸点:NH3 _______ AsH3(填“>”或“<”)
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_______ ,当消耗75g还原剂时,电子转移了__ mol。
Ⅱ、A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物。已知A、B、C、D、E、X存在如下图所示转化关系(部分生成物和反应条件略去),若常温下A为红棕色气体,B为强酸,X为常见金属单质。
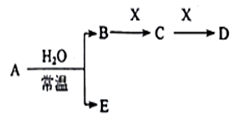
(1)A与水反应的化学方程式为_______ 。
(2)工业上常用CO热还原法冶炼X,写出其化学方程式_______ 。
(3)某温度下(>100℃)若m克X与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式_______ 。
Ⅲ、由①、⑤、⑥、S和Fe五种元素组成的相对分子质量为392的化合物B,B中含有结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
(1)由实验a、b推知B溶液中含有的离子为_______ ;
(2)B的化学式为_______ 。

Ⅰ、用化学用语回答下列问题:
(1)由②、⑥两元素形成的强氧化性物质的电子式为
(2)⑦、⑧的最高价含氧酸的酸性较弱的是
(3)As在元素周期表中位置为
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为
Ⅱ、A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物。已知A、B、C、D、E、X存在如下图所示转化关系(部分生成物和反应条件略去),若常温下A为红棕色气体,B为强酸,X为常见金属单质。

(1)A与水反应的化学方程式为
(2)工业上常用CO热还原法冶炼X,写出其化学方程式
(3)某温度下(>100℃)若m克X与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式
Ⅲ、由①、⑤、⑥、S和Fe五种元素组成的相对分子质量为392的化合物B,B中含有结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
(1)由实验a、b推知B溶液中含有的离子为
(2)B的化学式为
您最近一年使用:0次
9 . 短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素。X与W同一主族,Z元素原子半径在短周期中最大(稀有气体除外),W、Z之间与W、Q之间原子序数之差相等,五种元素原子最外层电子数之和为21。下列说法不正确的是
| A.W的氧化物既可以和酸反应又可以和碱反应 |
| B.Y的氢化物与其最高价氧化物对应水化物相遇生成白烟 |
| C.气态氢化物的稳定性:Y>X>W |
| D.Q可分别与X、Y、Z、W形成化学键类型相同的化合物 |
您最近一年使用:0次
名校
10 . 下表列出了前20号元素中的某些元素性质的有关数据
元素R的原子半径为1.02×10-10 m,下列有关叙述正确的是
元素标号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | — |
| 最低价态 | — | — | -2 | — | -4 | -3 | -1 | — | -3 | -1 |
| A.以上10种元素的原子中,失去核外第一个电子所需能量最少的是⑧ |
| B.由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4 |
| C.元素R在周期表中位于第三周期第ⅤI族 |
D.若物质Na2R3是一种含有非极性共价键的离子化合物,则其化合物的电子式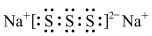 |
您最近一年使用:0次
2017-05-15更新
|
1011次组卷
|
4卷引用:重庆市乌江新高考协作体2023-2024学年高一下学期开学化学试题



