名校
解题方法
1 . 甲~戊均为短周期元素,在元素周期表中的相对位置如图所示。戊的最高价氧化物对应的水化物为强酸。下列说法不正确 的是
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A.原子半径:丁>戊>乙 |
| B.乙的简单氢化物的沸点一定高于戊的简单氢化物的沸点 |
| C.甲的简单氢化物遇氯化氢一定有白烟产生 |
| D.丙的最高价氧化物对应的水化物一定能与强碱反应 |
您最近一年使用:0次
解题方法
2 . 锰(25Mn)及其化合物是目前前沿科学研究的热点。按要求回答下列问题。
(1)锰元素在元素周期表中的位置是___________ 。
(2)某晶体锰的面心立方晶胞如图所示。
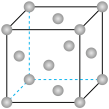
①该晶胞中含Mn原子的个数为___________ ;
②晶体锰中每个Mn原子距离最近的Mn原子数目为___________ 。
③设该晶胞参数棱长为 。则晶体锰的密度为
。则晶体锰的密度为___________  (列算式)
(列算式)
(3)锰的冶炼有多种方法,其中以某锰矿(主要成分为 ,主要杂质有
,主要杂质有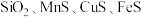 )为原料,设计如下流程可制得金属Mn。
)为原料,设计如下流程可制得金属Mn。
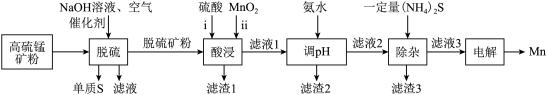
已知:金属硫化物的溶度积常数如下表。
①脱硫步骤:硫化物均转化为单质S,其反应中的氧化剂为___________ ; 能被部分反应而得到的产物为
能被部分反应而得到的产物为___________ 。
②酸浸步骤:ⅰ反应后的溶液中含 ,写出ⅱ反应的离子方程式:
,写出ⅱ反应的离子方程式:___________ ;滤渣1含有的物质有___________ 。若未经脱硫直接酸浸,不利的方面是___________ 。
③调 的目的为去除铁元素,则产生滤渣2的离子方程式:
的目的为去除铁元素,则产生滤渣2的离子方程式:___________ ;
④除杂步骤:滤渣3中主要有___________ 。
⑤电解步骤:惰性阳极产生 的反应式为
的反应式为___________ 。
(1)锰元素在元素周期表中的位置是
(2)某晶体锰的面心立方晶胞如图所示。

①该晶胞中含Mn原子的个数为
②晶体锰中每个Mn原子距离最近的Mn原子数目为
③设该晶胞参数棱长为
 。则晶体锰的密度为
。则晶体锰的密度为 (列算式)
(列算式)(3)锰的冶炼有多种方法,其中以某锰矿(主要成分为
 ,主要杂质有
,主要杂质有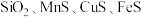 )为原料,设计如下流程可制得金属Mn。
)为原料,设计如下流程可制得金属Mn。
已知:金属硫化物的溶度积常数如下表。
| 物质 | CuS | MnS | FeS |
 | 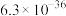 | 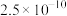 |  |
 能被部分反应而得到的产物为
能被部分反应而得到的产物为②酸浸步骤:ⅰ反应后的溶液中含
 ,写出ⅱ反应的离子方程式:
,写出ⅱ反应的离子方程式:③调
 的目的为去除铁元素,则产生滤渣2的离子方程式:
的目的为去除铁元素,则产生滤渣2的离子方程式:④除杂步骤:滤渣3中主要有
⑤电解步骤:惰性阳极产生
 的反应式为
的反应式为
您最近一年使用:0次
3 . 元素周期表中,铍(Be)与铝处于对角线的位置,它们的性质相似。试回答:
(1)Be元素在元素周期表中的位置:___________ ,有关Be性质的推断不正确的是___________ (填序号)。
a.Be是一种轻金属,能与冷水反应
b.氧化铍具有高熔点,能耐酸碱
c.常温时, 溶液的
溶液的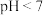
(2)已知: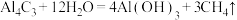 ,写出
,写出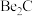 与NaOH溶液反应的离子方程式(铍酸根离子为
与NaOH溶液反应的离子方程式(铍酸根离子为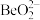 ):
):___________
(3)基态铝原子的价电子排布式为___________ ,镁铝合金经过高温淬火获得一种储钠材料,用___________ 法测定其晶胞结构如图1所示,图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为___________ ,该立方晶胞的晶胞的密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶胞中镁铝之间的最近距离为
,则该晶胞中镁铝之间的最近距离为___________ pm。(列出计算式,可不化简)。
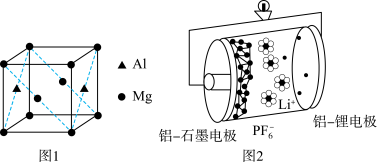
(4)铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为: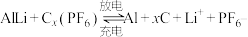 ,电池结构如图2所示。放电时,正极反应式为
,电池结构如图2所示。放电时,正极反应式为___________ ,充电时,应将铝-石墨电极与外接电源的___________ 极相连。
(1)Be元素在元素周期表中的位置:
a.Be是一种轻金属,能与冷水反应
b.氧化铍具有高熔点,能耐酸碱
c.常温时,
 溶液的
溶液的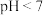
(2)已知:
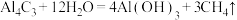 ,写出
,写出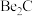 与NaOH溶液反应的离子方程式(铍酸根离子为
与NaOH溶液反应的离子方程式(铍酸根离子为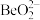 ):
):(3)基态铝原子的价电子排布式为
 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶胞中镁铝之间的最近距离为
,则该晶胞中镁铝之间的最近距离为
(4)铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为:
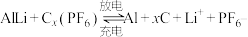 ,电池结构如图2所示。放电时,正极反应式为
,电池结构如图2所示。放电时,正极反应式为
您最近一年使用:0次
名校
4 . 下列表格是元素周期表的一部分。请按要求填空(用化学用语填写)
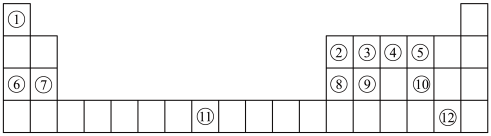
(1)元素①和⑥形成的化合物中存在的化学键类型为_______ 。
(2)用化学方程式表示④的简单氢化物的工业制法_______ 。
(3)写出由③④⑥形成的化合物的电子式_______ 。
(4)列举元素⑨形成的氧化物的一种用途_______ ,元素⑪在周期表中的位置_______ 。
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为_______ 。
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为_______ 。
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为_______ 。

(1)元素①和⑥形成的化合物中存在的化学键类型为
(2)用化学方程式表示④的简单氢化物的工业制法
(3)写出由③④⑥形成的化合物的电子式
(4)列举元素⑨形成的氧化物的一种用途
(5)①⑤⑦⑧的简单离子半径由大到小的顺序为
(6)写出⑧⑫的最高价氧化物的水化物发生反应的化学方程式为
(7)X是由①④⑤⑧⑩形成的复盐,向含0.01 mol X的溶液中加入0.024 mol
 ,生成沉淀的物质的量的总和为
,生成沉淀的物质的量的总和为
您最近一年使用:0次
2022-11-28更新
|
336次组卷
|
2卷引用:天津市南开中学2022-2023学年高三上学期第二次月考化学试题
名校
5 . X、Y、Z是周期表中位置相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为16,核内质子数之和为30,则X、Y、Z分别是( )
| A.O、N、P | B.S、P、N | C.N、O、S | D.Cl、S、O |
您最近一年使用:0次
2020-09-23更新
|
1990次组卷
|
5卷引用:天津市第五十四中学2023-2024学年高一上学期第二次月考(12月考)化学试题
天津市第五十四中学2023-2024学年高一上学期第二次月考(12月考)化学试题鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律第2节 元素周期律和元素周期表(已下线)4.1.2 元素周期表(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)河南省平顶山一中新区学校2020-2021学年高一上学期教学质量评估(二)化学试题云南省曲靖市会泽县实验高级中学校2022-2023学年高一下学期月考(四)化学试题
解题方法
6 . 饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
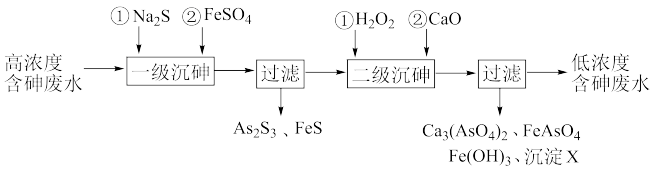
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2
2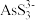 (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷是第四周期VA族元素,则砷的原子序数为________ ;AsH3的电子式为____________ ;
(2)根据元素周期律,下列说法正确的是_________ 。
a.酸性: H2SO4>H3PO4>H3AsO4 b.原子半径:S>P>As c.非金属性:S>P>As
(3)砷酸的第一步电离方程式为________________ 。
(4)沉淀X为_________________ (填化学式)。
(5)“一级沉砷”中FeSO4的作用是____________________________________________ ;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________________________ 。
(6)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成 ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________________

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
 2
2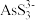 (aq);
(aq);②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷是第四周期VA族元素,则砷的原子序数为
(2)根据元素周期律,下列说法正确的是
a.酸性: H2SO4>H3PO4>H3AsO4 b.原子半径:S>P>As c.非金属性:S>P>As
(3)砷酸的第一步电离方程式为
(4)沉淀X为
(5)“一级沉砷”中FeSO4的作用是
(6)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成
 ,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
您最近一年使用:0次
名校
7 . 下列叙述不正确的是
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3
⑥已知2H2(g)+O2(g)=2H2O(l) △H=﹣571kJ·mol﹣1,则氢气的燃烧热为285.5kJ·mol﹣1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3
⑥已知2H2(g)+O2(g)=2H2O(l) △H=﹣571kJ·mol﹣1,则氢气的燃烧热为285.5kJ·mol﹣1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
| A.②④⑥ | B.①③⑤⑦ | C.②④⑥⑦ | D.⑤⑥⑦ |
您最近一年使用:0次
2016-12-09更新
|
2025次组卷
|
6卷引用:2016届天津市五校高三上学期联考化学试卷



