名校
解题方法
1 . 为维护国家安全和利益,经国务院批准,决定对镓、锗相关物项实施出口管制。镓的某种化合物的晶胞结构如下图所示(晶胞参数为a pm,1 pm=10-10cm,NA表示阿伏加德罗常数)。下列说法正确的是
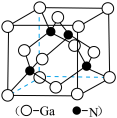

| A.Ga元素位于元素周期表的ds区 |
| B.晶体结构中N的配位数为6 |
| C.该物质的化学式为Ga4N4 |
D.该晶体的密度为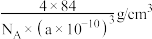 |
您最近一年使用:0次
2023-10-10更新
|
549次组卷
|
2卷引用:广东省汕头市潮阳实验学校2024届高三上学期期中考试化学试题
2 . 如下是科学家们预期的一种含硒催化剂对亲电卤化的催化机理,NBS反应后转变为X。下列说法错误的是
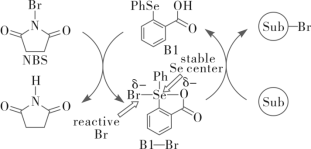

A.反应方程式为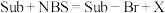 | B.B1到B1—Br发生了氧化 |
C.Br—Br中的Se为 杂化 杂化 | D.Se为p区元素 |
您最近一年使用:0次
3 . 已知第四周期过渡金属元素M,其六氨合M盐与氨化钾溶液在液氨中反应生成棕色非晶态的A[含三种元素,其中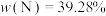 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
(1)请计算推断出M______ 、A______ 、B______ ;
(2)写出反应方程式(Ⅰ)______ 、(Ⅱ)______ 。(提示:可以从最简单的情况开始考虑)
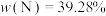 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。(1)请计算推断出M
(2)写出反应方程式(Ⅰ)
您最近一年使用:0次
解题方法
4 . 下表列出了A~M 13种元素在周期表中的位置:
(1)这些元素中,金属性最强的元素是_______ (填元素符号,下同),非金属性最强的是_______ 。
(2)写出H元素的最高价氧化物与F元素最高价氧化物对应水化物反应的离子方程式_______ 。
(3) 、
、 、
、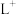 、
、 等微粒中,半径最大的是
等微粒中,半径最大的是_______ ,最小的是_______ 。
(4)A与D形成的化合物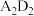 是
是_______ 化合物,其电子式为_______ 。
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
(2)写出H元素的最高价氧化物与F元素最高价氧化物对应水化物反应的离子方程式
(3)
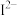 、
、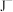 、
、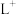 、
、 等微粒中,半径最大的是
等微粒中,半径最大的是(4)A与D形成的化合物
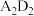 是
是
您最近一年使用:0次
名校
5 . 元素周期表反映元素之间的内在联系,是研究物质性质的重要工具。如表是元素周期表的一部分。请回答下列问题:
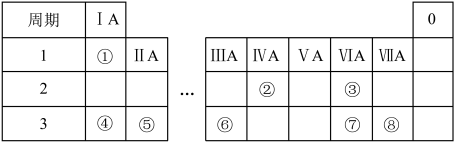
(1)画出④的原子结构示意图_____ 。
(2)①的单质在盛满⑧的单质的集气瓶中燃烧,反应现象为_____ 。
(3)③和④组成的一种物质中含有两种类型的化学键,该物质的化学式为_____ 。
(4)⑥的单质和④的最高价氧化物的水化物反应的化学方程式为_____ 。
(5)已知⑤的单质与②的最高价氧化物A在点燃条件下能反应生成黑色单质,推测④的单质_____ (填“能不能”)与A反应。
(6)为比较⑦和⑧ 非金属性,某小组同学设计实验进行探究。
非金属性,某小组同学设计实验进行探究。
【理论依据】氧化性较强的单质能置换出氧化性较弱的单质
【实验方案】
【实验过程】
按照实验方案操作,观察到的现象与预测的一致,写出该反应的化学方程式_____ 。
【实验结论】非金属性:⑦<⑧

(1)画出④的原子结构示意图
(2)①的单质在盛满⑧的单质的集气瓶中燃烧,反应现象为
(3)③和④组成的一种物质中含有两种类型的化学键,该物质的化学式为
(4)⑥的单质和④的最高价氧化物的水化物反应的化学方程式为
(5)已知⑤的单质与②的最高价氧化物A在点燃条件下能反应生成黑色单质,推测④的单质
(6)为比较⑦和⑧
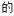 非金属性,某小组同学设计实验进行探究。
非金属性,某小组同学设计实验进行探究。【理论依据】氧化性较强的单质能置换出氧化性较弱的单质
【实验方案】
| 实验操作 | 预测现象 |
| 取Na2S溶液于试管中,滴入少量新制氯水 |
按照实验方案操作,观察到的现象与预测的一致,写出该反应的化学方程式
【实验结论】非金属性:⑦<⑧
您最近一年使用:0次
名校
6 . 如表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)写出基态J原子的电子排布式:______ ,L的原子序数:_____ ,M的简化电子排布式:______ 。
(2)下列关于元素在元素周期表中的位置的叙述正确的是______ (填选项字母)。
(3)下列有关说法正确的是______ (填选项字母)。
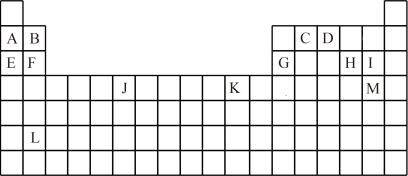
(4)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
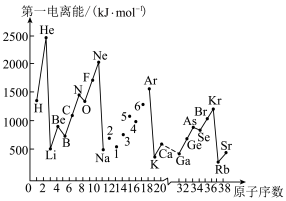
①认真分析图中同周期元素第一电离能的变化规律,将Na~Ar之间的元素用短线连接起来,构成完整的图像______ 。
②从图像分析可知,同一主族元素原子的第一电离能I1变化规律是______ 。Zn的第一电离能大于Ga的原因是______ 。

试回答下列问题:
(1)写出基态J原子的电子排布式:
(2)下列关于元素在元素周期表中的位置的叙述正确的是
| A.K位于元素周期表中第四周期第IIB族,属于ds区元素 |
| B.J位于元素周期表中第四周期第IVB族,属于d区元素 |
| C.F位于元素周期表中第三周期第IIA族,属于s区元素 |
| D.I位于元素周期表中第三周期第VIIA族,属于ds区元素 |
| A.第一电离能:G>F>E | B.电负性:D>C |
| C.原子半径:E>B | D.最高价含氧酸的酸性:I>H |

①认真分析图中同周期元素第一电离能的变化规律,将Na~Ar之间的元素用短线连接起来,构成完整的图像
②从图像分析可知,同一主族元素原子的第一电离能I1变化规律是
您最近一年使用:0次
名校
解题方法
7 . 短周期主族元素X、Y、Z、W在周期表中位置如图,下列表述正确的是
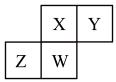

| A.Y最高正价可能为+6价 |
| B.W有可能周期数等于其族序数 |
| C.Z的最高价氧化物有可能与Y的最高价氧化物对应的水化物反应 |
| D.若X为氧元素,则离子半径顺序:r(W2-)>r(Y-)>r(X2-)>r(Z3-) |
您最近一年使用:0次
2023-02-16更新
|
777次组卷
|
2卷引用:广东省深圳市高级中学2022-2023学年高一上学期期末考试化学试题
8 . 随着新能源汽车销量的猛增,动力电池退役高峰将至,磷酸铁锂 是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片(
是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片( 、导电石墨、铝箔)中回收锂的工艺流程如下:
、导电石墨、铝箔)中回收锂的工艺流程如下:
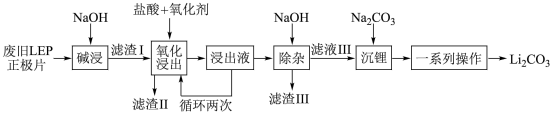
已知:i.废旧磷酸铁锂正极片中的化学物质均不溶于水也不与水反应。
ii. 在水中的溶解度随温度升高而降低,但煮沸时与水发生反应。
在水中的溶解度随温度升高而降低,但煮沸时与水发生反应。
回答下列问题:
(1) 中密度最小的金属元素在周期表中的位置是
中密度最小的金属元素在周期表中的位置是_______ 。
(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如下表,实际生产中氧化剂选用 ,不选用
,不选用 的原因是
的原因是_______ 。在“氧化浸出”时,适当的升温可加快反应速率,但一般不采取高温法,其原因是_______ 。 “氧化浸出”时生成了难溶的 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3)“浸出液”循环两次的目的是_______ 。
(4)“滤渣II”经纯化可得 ,流程中生成的
,流程中生成的 、
、 在高温条件下与
在高温条件下与 煅烧可得
煅烧可得 ,实现再生利用,其化学方程式为
,实现再生利用,其化学方程式为_______ 。
(5)“一系列操作”具体包括_______ 、洗涤、干燥。
 是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片(
是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片( 、导电石墨、铝箔)中回收锂的工艺流程如下:
、导电石墨、铝箔)中回收锂的工艺流程如下:
已知:i.废旧磷酸铁锂正极片中的化学物质均不溶于水也不与水反应。
ii.
 在水中的溶解度随温度升高而降低,但煮沸时与水发生反应。
在水中的溶解度随温度升高而降低,但煮沸时与水发生反应。回答下列问题:
(1)
 中密度最小的金属元素在周期表中的位置是
中密度最小的金属元素在周期表中的位置是(2)“氧化浸出”时,保持其他条件不变,不同氧化剂对锂的浸出实验结果如下表,实际生产中氧化剂选用
 ,不选用
,不选用 的原因是
的原因是 ,该反应的化学方程式为
,该反应的化学方程式为| 序号 | 锂含量/% | 氧化剂 |  | 浸出液 浓度 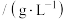 | 浸出渣中 含量/% |
| 1 | 3.7 |  | 3.5 | 9.02 | 0.10 |
| 2 | 3.7 |  | 3.5 | 9.05 | 0.08 |
| 3 | 3.7 |  | 3.5 | 7.05 | 0.93 |
| 4 | 3.7 |  | 3.5 | 8.24 | 0.43 |
(4)“滤渣II”经纯化可得
 ,流程中生成的
,流程中生成的 、
、 在高温条件下与
在高温条件下与 煅烧可得
煅烧可得 ,实现再生利用,其化学方程式为
,实现再生利用,其化学方程式为(5)“一系列操作”具体包括
您最近一年使用:0次
名校
9 . 一种从废弃SCR催化剂(主要含78%TiO2、V2O5及SiO2、Al2O3等)中回收钛、钒的工艺流程如图所示:

(1)Ti在周期表中的位置是_____________ ,价层电子排布式是________________ 。
(2)已知V2O5的化学性质与氧化铝相似,则“碱浸”过程中发生反应的离子方程式Al2O3+ 2OH-= 2AlO +H2O、
+H2O、__________ 、___________ 。
(3)沉淀X的主要成分是H2SiO3、_________ (填化学式)。
(4)在焙烧NH4VO3时,气体产物经过与_______ (填化学式)反应后,可以在生产流程中循环利用。
(5)反型钙钛矿电池使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
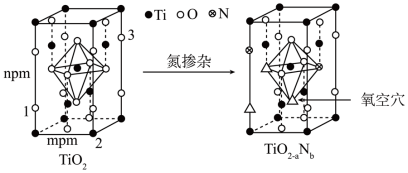
已知原子1、2的分数坐标为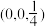 和
和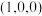 ,则原子3的坐标分别为
,则原子3的坐标分别为______ ,设阿伏加德罗常数的值为NA,TiO2的密度为_______ g·cm-3(列出计算式)。TiO2-aNb晶体中a=_______ 。

(1)Ti在周期表中的位置是
(2)已知V2O5的化学性质与氧化铝相似,则“碱浸”过程中发生反应的离子方程式Al2O3+ 2OH-= 2AlO
 +H2O、
+H2O、(3)沉淀X的主要成分是H2SiO3、
(4)在焙烧NH4VO3时,气体产物经过与
(5)反型钙钛矿电池使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。

已知原子1、2的分数坐标为
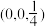 和
和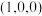 ,则原子3的坐标分别为
,则原子3的坐标分别为
您最近一年使用:0次
10 . 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是


| A.X、Y、Z三种元素中,X的非金属性最强 |
| B.Y的氢化物的稳定性比Z的氢化物的稳定性弱 |
| C.Y的最高正化合价为+6 |
| D.X的单质的熔点比Z的单质的熔点低 |
您最近一年使用:0次
2021-08-13更新
|
547次组卷
|
2卷引用:广东省揭阳市普宁市勤建学校2022-2023学年高一下学期学科竞赛化学试题



