解题方法
1 . 新型储氢合金材料的研究和开发将为氢气作为能源的实际应用起到重要的推动作用。两种常见储氢合金的晶胞结构如图所示。设阿伏加德罗常数为 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是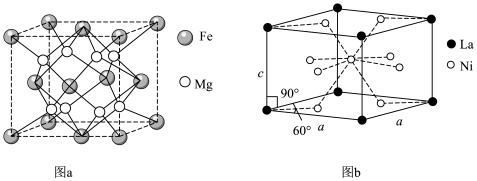
| A.图中涉及的四种元素均为d区元素 |
B.图b晶体的化学式为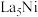 |
C.图a晶体晶胞边长为dpm,该合金的密度为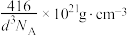 |
D.图a晶体储氢时,储存的氢相当于 分子在晶胞的体心和棱心位置,则含24g Mg的该储氢合金储存的 分子在晶胞的体心和棱心位置,则含24g Mg的该储氢合金储存的 在标准状况下的体积约为11.2L 在标准状况下的体积约为11.2L |
您最近一年使用:0次
2024-05-16更新
|
147次组卷
|
2卷引用:湖北省十堰市2023-2024学年高三下学期4月调研考试化学试题
解题方法
2 . 尿素还原法合成溴化锂,设备简单、产品质量好、无有毒气体排放、生产成本低。下图是制备无水溴化锂的工艺路线:
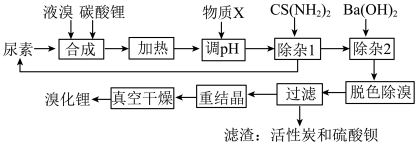
回答下列问题:
(1)Br位于周期表第________ 周期________ 族。
(2)常用焰色试验鉴别碳酸锂,火焰呈现________ 色。
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因________ 。
(4)合成溴化锂的主要化学方程式________ 。
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为________ 。
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是________ 。
(7)重结晶的操作为________ 。

温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
碳酸锂溶解度(g) | 1.51 | 1.43 | 1.33 | 1.26 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)Br位于周期表第
(2)常用焰色试验鉴别碳酸锂,火焰呈现
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因
(4)合成溴化锂的主要化学方程式
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是
(7)重结晶的操作为
您最近一年使用:0次
2024-04-02更新
|
331次组卷
|
2卷引用:2024届湖北省十一校高三下学期第二次联考化学试卷
名校
解题方法
3 . 已知X、Y、Z三种主族元素在元素周期表中的位置如图所示。设X的原子序数为a,则下列说法不正确的是
| Y | ||
| X | ||
| Z |
| A.Y的原子序数可能为a-17 | B.Y与Z的原子序数之和可能为2a |
| C.Z的原子序数可能为a+31 | D.X、Y、Z可能均为短周期元素 |
您最近一年使用:0次
2023-06-18更新
|
963次组卷
|
8卷引用:【全国校级联考】湖北省部分重点中学2017-2018学年高一下学期期中考试化学试题
真题
解题方法
4 .  是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第_______ 周期,第_______ 族。
(2)烧渣是LiCl、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因_______ 。
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是
常用方法的名称是_______ 。
(4)已知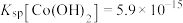 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为_______  。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为_______ 。
(5)导致 比
比 易水解的因素有
易水解的因素有_______ (填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: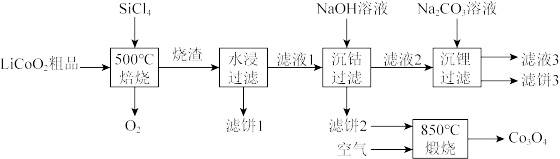
(1)Co位于元素周期表第
(2)烧渣是LiCl、
 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因(3)鉴别洗净的“滤饼3”和固体
 常用方法的名称是
常用方法的名称是(4)已知
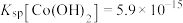 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为 。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为(5)导致
 比
比 易水解的因素有
易水解的因素有a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
您最近一年使用:0次
2023-06-14更新
|
10515次组卷
|
13卷引用:2023年高考湖北卷化学真题
2023年高考湖北卷化学真题(已下线)T16-工业流程题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第32讲难溶电解质的溶解平衡(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建
名校
解题方法
5 . 下列关于元素周期表及周期律的叙述,其中错误的是
①一般在过渡元素中寻找一些化学反应新型催化剂
②硒化氢(H2Se)是无色,有毒,比H2S稳定的气体
③研制农药通常考虑含有元素周期表右上角元素(氟、氯、硫、磷等)的有机物
④按F2→I2的顺序单质氧化性逐渐减弱,故前面的卤素单质可将后面的卤素从它们的盐溶液里置换出来
⑤元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
⑥砹(At)为ⅦA元素,推测单质砹为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀硝酸
⑦ⅠA族元素全部是金属元素,第ⅢA族位于元素周期表第3纵列
①一般在过渡元素中寻找一些化学反应新型催化剂
②硒化氢(H2Se)是无色,有毒,比H2S稳定的气体
③研制农药通常考虑含有元素周期表右上角元素(氟、氯、硫、磷等)的有机物
④按F2→I2的顺序单质氧化性逐渐减弱,故前面的卤素单质可将后面的卤素从它们的盐溶液里置换出来
⑤元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
⑥砹(At)为ⅦA元素,推测单质砹为有色固体,HAt不稳定,AgAt不溶于水也不溶于稀硝酸
⑦ⅠA族元素全部是金属元素,第ⅢA族位于元素周期表第3纵列
| A.3个 | B.4个 | C.5个 | D.6个 |
您最近一年使用:0次
2023-03-17更新
|
918次组卷
|
4卷引用:湖北省沙市中学2022-2023学年高一下学期4月期中考试化学试题
湖北省沙市中学2022-2023学年高一下学期4月期中考试化学试题山东省德州市第一中学2022-2023学年高一3月月考化学试题山东省德州市2022-2023学年高一下学期3月月考化学试题(已下线)第17讲 元素周期律-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)
6 . 某物质结构如图所示,其中X、Y、Z、M、W均为短周期主族元素,且原子序数依次增大。下列说法正确的是
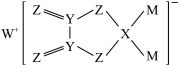

A.原子半径: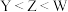 | B.第一电离能: |
C.X和Y原子均为 杂化 杂化 | D.该物质中除W外均是p区元素 |
您最近一年使用:0次
2023-01-10更新
|
690次组卷
|
2卷引用:湖北省部分市州2022-2023学年高三元月联合调研考试化学试题
名校
7 . 含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种原子序数为48的Cd2+配合物的结构如图所示,则下列说法正确的是
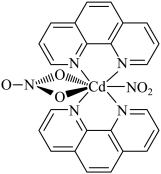

| A.该螯合物中N的杂化方式有2种 |
| B.1mol该配合物中通过螯合作用形成的配位键有6mol |
| C.Cd属于d区元素 |
| D.Cd的价电子排布式为4d85s2 |
您最近一年使用:0次
2022-11-07更新
|
897次组卷
|
3卷引用:湖北省襄阳市第一中学2022-2023学年高二下学期3月月考化学试题
8 . 废锂离子电池回收是对“城市矿产”的资源化利用,可促进新能源产业链闭环。废磷酸铁锂粉主要成分为LiFePO4,还含有的杂质为Al、Cu、Mg.回收LiCl的工艺流程如下:
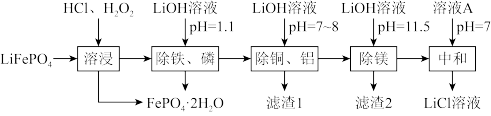
已知:①LiFePO4难溶于水;
②Ksp(FePO4)=1.0×10-22,Ksp(Li3PO4)=2.5×10-3,Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)LiFePO4中Fe的化合价为_______ ,Fe在周期表中的位置为_______ 。
(2)“溶浸”可得到含氯化锂的浸出液,材料中的铝、铜、镁等金属杂质也会溶入浸出液,生成CuCl2的离子反应方程式:_______ ;生成FePO4·2H2O的离子反应方程式:_______ 。
(3)该法实现了定向除杂,溶浸后不可直接将浸出液的pH调至11.5,其原因之一是:FePO4(s)+3Li+(aq)+3OH—(aq)=Fe(OH)3(s)+Li3PO4(s),该反应的平衡常数表达式为K=_______ ,若溶液中的c(Li+)=1mol/L,不考虑其他离子参与反应,为使Li+不转化为Li3PO4沉淀,则pH需小于_______ 。
(4)溶液A为_______ ,若最终获得LiCl溶液的体积为aL,其中Li+的密度为pg·L-1,废磷酸铁锂粉中Li元素的质量为mg,三次加入的LiOH溶液中溶质LiOH的总质量为m1g,其利用率为α,求废磷酸铁锂粉中Li元素的回收率x(Li)=_______ ×100%。(列出计算式即可,不用化简)

已知:①LiFePO4难溶于水;
②Ksp(FePO4)=1.0×10-22,Ksp(Li3PO4)=2.5×10-3,Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)LiFePO4中Fe的化合价为
(2)“溶浸”可得到含氯化锂的浸出液,材料中的铝、铜、镁等金属杂质也会溶入浸出液,生成CuCl2的离子反应方程式:
(3)该法实现了定向除杂,溶浸后不可直接将浸出液的pH调至11.5,其原因之一是:FePO4(s)+3Li+(aq)+3OH—(aq)=Fe(OH)3(s)+Li3PO4(s),该反应的平衡常数表达式为K=
(4)溶液A为
您最近一年使用:0次
9 . 如图是部分短周期元素化合价与原子序数的关系图
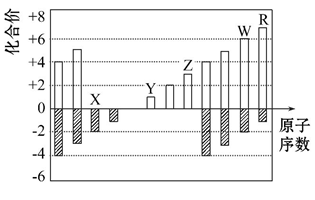
请回答下列问题(用元素符号表达):
(1) X、Y、Z 三种元素的原子半径大小顺序是____________
(2)X 与 Y 形成化合物Y2X2,写出该化合物的电子式____________
(3)RX2是一种强氧化性气体,可用于污水处理,能将 CN-氧化,生成两种无毒气体,该反应离子方程式为____________
(4)某阴离子 Wa2-(a 为2 − 6之间的数字)在碱性溶液中被 BrO3‾离子氧化为 WO42-,而BrO3-离子被还原为Br-,反应中消耗的 BrO3-离子和 OH ‾离子的物质的量之比为 2:3,则 a =____________ 。

请回答下列问题(用元素符号表达):
(1) X、Y、Z 三种元素的原子半径大小顺序是
(2)X 与 Y 形成化合物Y2X2,写出该化合物的电子式
(3)RX2是一种强氧化性气体,可用于污水处理,能将 CN-氧化,生成两种无毒气体,该反应离子方程式为
(4)某阴离子 Wa2-(a 为2 − 6之间的数字)在碱性溶液中被 BrO3‾离子氧化为 WO42-,而BrO3-离子被还原为Br-,反应中消耗的 BrO3-离子和 OH ‾离子的物质的量之比为 2:3,则 a =
您最近一年使用:0次
名校
10 . X、Y、Z、W均为短周期主族元素,它们在周期表中的相对位置如图所示,下列说法中正确的是( )
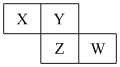

A.Y的价层电子排布式是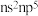 |
| B.四种元素所形成的最简单氢化物中,沸点最高的是可能Y的氢化物 |
| C.Y、Z之间可形成离子型化合物 |
| D.X、Z、W的最高价氧化物所对应的水化物不可能均是强酸 |
您最近一年使用:0次
2019-08-13更新
|
1534次组卷
|
5卷引用:湖北省沙市第五中学2020-2021学年高二下学期3月月考化学试题



