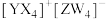 。下列叙述正确的是
。下列叙述正确的是A.氧化性: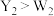 | B.电负性:Y>X>Z |
| C.Y的含氧酸一定是强酸 | D.第一电离能:Y<W |
| A.元素Z在周期表中位于第3周期VA族 |
| B.原子半径:r(X)<r(Y) |
| C.Z的第一电离能比W的小. |
| D.X的简单气态氢化物的热稳定性比Z的弱 |
 可转化为
可转化为 ,其中
,其中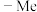 表示甲基、
表示甲基、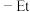 表示乙基,下列说法正确的是
表示乙基,下列说法正确的是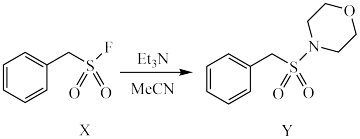
A. 为非极性分子 为非极性分子 |
B.电负性: |
C. 的核磁共振氢谱有5组吸收峰 的核磁共振氢谱有5组吸收峰 |
D.上述物质中的碳原子有 和 和 三种杂化类型 三种杂化类型 |
(1)元素铜在元素周期表中位于
(2)P、S、Cl元素的电负性从大到小的顺序为
(3)As元素的第一电离能
(4)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲合能(
 )。第二周期部分元素的
)。第二周期部分元素的 变化趋势如图所示,其中,除了氮元素外,其他元素的
变化趋势如图所示,其中,除了氮元素外,其他元素的 自左而右依次增大的原因是
自左而右依次增大的原因是 呈现异常的原因是
呈现异常的原因是
| A.反应混合物中所有化学键均为共价键 |
| B.元素电负性大小为N>B |
| C.BCl3和BN均为共价晶体 |
D.形成BCl3时B原子先激发后杂化,其激发态价电子轨道表示式为: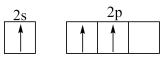 |
6 . 根据信息回答下列问题:
(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
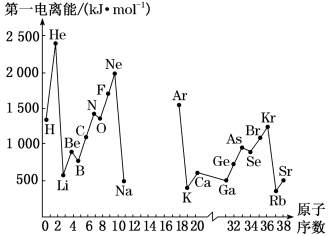
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为
②图中Ge元素中未成对电子有
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出部分元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①根据表中给出的数据,可推知元素的电负性具有的变化规律
②通过分析电负性值变化规律,确定Al元素电负性值的最小范围
③判断下列物质是离子化合物还是共价化合物:
A Li3N B PCl3 C MgCl2 D SiC
Ⅰ.属于离子化合物的是
Ⅱ.属于共价化合物的是
请设计一个实验方案证明上述所得到的结论
 转化为HCOOH。下列说法
转化为HCOOH。下列说法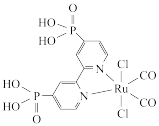
| A.Ru配合物中第二周期元素的电负性:O>N>C |
B.吡啶(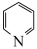 ,原子在同一平面)中C、N原子的杂化方式分别为 ,原子在同一平面)中C、N原子的杂化方式分别为 、 、 |
| C.该配合物中Ru的配位数是6 |
D. 中P的价层电子对数为4,空间结构为正四面体形 中P的价层电子对数为4,空间结构为正四面体形 |
 ,M基态原子的所有s轨道上共有6个电子。下列说法错误的是
,M基态原子的所有s轨道上共有6个电子。下列说法错误的是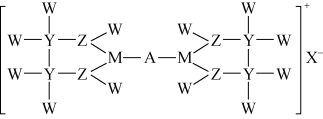
| A.化合物中除A外,其他原子均达到稀有气体的稳定结构 |
| B.W与M、Z均可形成18电子微粒,沸点前者高 |
C.化合物 的空间结构为正四面体形,可做灭火剂 的空间结构为正四面体形,可做灭火剂 |
D.电负性: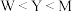 |
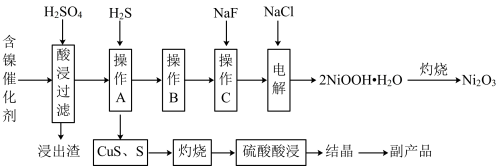
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
| 氢氧化物 |  |  |  |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
请回答下列问题:
(1)加快酸浸速率的常用措施有
(2)“浸出渣”主要成分为
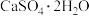 和
和(3)“操作B”的过程是:先在40~50℃温度下加入
 ,其作用是
,其作用是(4)在碱性条件下,电解产生
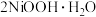 的原理是:
的原理是: 在阳极被氧化为
在阳极被氧化为 ,
, 再被
再被 氧化产生
氧化产生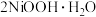 沉淀。请写出
沉淀。请写出 被
被 氧化得到
氧化得到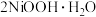 沉淀的离子方程式
沉淀的离子方程式(5)配合物A常用于医药、电镀等方面,其结构如图所示。向硫酸铜溶液中滴入氨基乙酸钠(
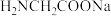 )即可得到它,配合物A中的配位原子的电负性由大到小的顺序是
)即可得到它,配合物A中的配位原子的电负性由大到小的顺序是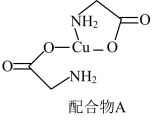
| 物质 | 六氯苯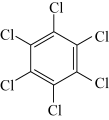 | 六溴苯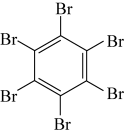 | 苯六酸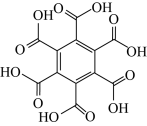 |
| 熔点/℃ | 231 | 325 | 287 |
| 水溶性 | 不溶 | 不溶 | 易溶 |
| A.苯六酸所含元素的电负性:C>O>H |
| B.从结构上看,六氯苯、六溴苯和苯六酸均为极性分子 |
| C.六氯苯、六溴苯和苯六酸分子中C的杂化方式均为sp2杂化 |
| D.苯六酸与六氯苯、六溴苯的水溶性存在明显的差异是因为其分子结构庞大 |



