解题方法
1 . 镁在二氧化碳中燃烧的化学方程式为 。下列说法正确的是
。下列说法正确的是
 。下列说法正确的是
。下列说法正确的是A.二氧化碳的电子式为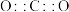 |
B.基态氧原子的价层电子排布式为 |
C.二氧化碳分子中的碳原子采取 杂化方式 杂化方式 |
D.元素的电负性: |
您最近一年使用:0次
2023-05-04更新
|
142次组卷
|
2卷引用:河北省石家庄部分重点高中2022-2023学年高三下学期3月月考化学试题
解题方法
2 . 根据所学知识,回答下列问题。
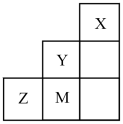
(1)镍铬钢抗腐蚀性能强,基态铬原子(24Cr)的简化电子排布式为_______ ,其原子结构示意图为_______ ,其电子占据的最高能层符号为_______ 。
(2)“玉兔二号”月球车是通过砷化镓(GaAs)太阳能电池提供能量进行工作的。砷原子的电子占据最高能级的电子云轮廓图为_______ 形,其价电子的轨道表示式为_______ 。基态镓原子(31Ga)的价电子中成对电子数目与未成对电子数目之比为_____ ,核外有_____ 种空间运动状态不同的电子。
(3)X元素基态原子的M层为全充满状态,N层没有成对电子,只有一个未成对电子,则X元素的名称为_______ ,其在周期表中的位置是_______ 。X可以形成X+和X2+两种离子,其中较稳定的是_______ (用元素符号表示),原因是_______ 。
(4)在第三周期中,第一电离能位于铝元素与磷元素之间的元素有_______ 种 。
(5)已知下列元素的电负性数据,
Mg的电负性范围:_______ <x(Mg)<_______ 。
(1)镍铬钢抗腐蚀性能强,基态铬原子(24Cr)的简化电子排布式为
(2)“玉兔二号”月球车是通过砷化镓(GaAs)太阳能电池提供能量进行工作的。砷原子的电子占据最高能级的电子云轮廓图为
(3)X元素基态原子的M层为全充满状态,N层没有成对电子,只有一个未成对电子,则X元素的名称为
(4)在第三周期中,第一电离能位于铝元素与磷元素之间的元素有
(5)已知下列元素的电负性数据,
| 元素符号 | Li | Be | C | O | F | Na | Al | S | Cl |
| X | 0.98 | 1.57 | 2.55 | 3.44 | 3.98 | 0.93 | 1.60 | 2.55 | 3.1 |
您最近一年使用:0次
3 . 如图为元素周期表中短周期的部分,关于Y、Z、M的说法正确的是

| A.电负性:Y>Z>M |
| B.离子半径:Z2->M->Y- |
| C.ZM2分子中各原子的最外层均满足8电子稳定结构 |
D.Z元素基态原子最外层电子排布图为 |
您最近一年使用:0次
11-12高二下·内蒙古包头·期中
名校
4 . 不能说明X的电负性比Y的大的是()
| A.与H2化合时X单质比Y单质容易 |
| B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C.X原子的最外层电子数比Y原子的最外层电子数多 |
| D.X单质可以把Y从其氢化物中置换出来 |
您最近一年使用:0次
2016-12-09更新
|
1717次组卷
|
31卷引用:河北省石家庄市第23中学2022-2023学年高二上学期第一次月考化学试题
河北省石家庄市第23中学2022-2023学年高二上学期第一次月考化学试题(已下线)2011-2012学年内蒙古包头三十三中高二下学期期中考试化学试卷(已下线)2014年高二鲁科版选修3化学规范训练 1.3原子结构与元素性质练习卷2016-2017学年黑龙江哈三中高二下学期4月月考(验收)考试化学试卷福建省福州市八县(市)协作校2016-2017学年高二下学期期中考试化学试题人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质2河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:1.2 原子结构与元素的性质 第2课时【全国百强校】辽宁省葫芦岛市第一高级中学2017-2018学年高二下学期期中考试化学试题新疆阿勒泰地区第二高级中学2018-2019学年高二下学期期末(A卷)化学试题黑龙江省哈尔滨市第三中学校2019-2020学年高二上学期期末考试化学试题云南省元阳县第三中学2019-2020学年高二上学期期末考试化学试题山东省烟台第二中学2019-2020学年高二上学期12月月考化学试题人教化学选修3第一章第二节课时3黑龙江省哈尔滨市第三中学2019-2020学年高二上学期第一模块(期末)考试化学试题第3节 原子结构与元素性质——A学习区 夯实基础(鲁科版选修3)江西省都昌县第三中学2019-2020学年高二下学期4月考试化学试题江西省都昌县第一中学2019-2020学年高二下学期期中线上考试化学试题宁夏自治区银川市北方民族大学附属中学2019-2020学年度(下)高二月考试卷四川省越西中学2019-2020学年高二5月月考化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质 课时2 元素周期律——原子半径、电离能、电负性的递变规律(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质江苏省南京市2019-2020学年高二下学期期末考试化学试卷A卷江苏省扬州中学2020-2021学年高二下学期期中考试化学试题湖北省十堰市2016-2017学年高二下学期期末调研考试化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)专题1~2 综合检测(提升卷)新疆博尔塔拉蒙古自治州蒙古中学2020-2021学年高二下学期期中考试化学试题 河北省邯郸市永年区第二中学2022-2023学年高二上学期12月月考化学试题江苏省盐城市东台创新高级中学2021-2022学年高二2月份月检测化学试题(已下线)题型82 电负性的比较
5 . 下列说法错误的是
| A.已知电负性:Si<H<Cl,则SiHCl3水解时发生氧化还原反应 |
| B.已知Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,则氧化剂与还原剂物质的量之比为1:2 |
C.已知Na+KCl(熔融) K+NaCl,则可推知钠的还原性和金属性都强于钾 K+NaCl,则可推知钠的还原性和金属性都强于钾 |
| D.已知4KO2+2H2O=4KOH+3O2,则O2为氧化产物 |
您最近一年使用:0次
2024-05-11更新
|
146次组卷
|
2卷引用:河北省石家庄市第十七中学2023-2024学年高三下学期第一次月考化学试题
名校
解题方法
6 . 有四种短周期元素,它们的结构、性质等信息如表所述:
(1)基态A原子的核外电子排布式为_______
(2)A、B、C离子半径由大到小的顺序为:_______ ( 填元素符号)
(3)基态C原子的核外电子排布图是_______ ,其原子核外有_______ 个未成对电子,能量最高的电子为_______ 轨道 上的电子,其轨道呈_______ 形。
(4)D所在周期第一电离能最大的元素名为_______ ,该周期电负性最大的元素符号为_______ 。
(5)用电子式表示AD化合物的形成过程_______ 。
(6)CD3分子中含有的σ 键类型为_______ σ键。 (填s-s;s-p: p-p)
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A周同期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)基态A原子的核外电子排布式为
(2)A、B、C离子半径由大到小的顺序为:
(3)基态C原子的核外电子排布图是
(4)D所在周期第一电离能最大的元素名为
(5)用电子式表示AD化合物的形成过程
(6)CD3分子中含有的σ 键类型为
您最近一年使用:0次
名校
解题方法
7 . 自然界中不存在氟的单质,得到单质氟的过程中,不少科学家为此献出了宝费的生命。1886年,法国化学家莫瓦桑发明了莫氏电炉,用电解法成功地制取了单质氟,因此荣获1906年诺贝尔化学奖,氟及其化合物在生产及生活中有着广泛的用途。请回答下列问题:
(1)氟磷灰石可用于制取磷肥,基态P原子有_______ 个未成对电子, 的中心P原子的杂化方式为
的中心P原子的杂化方式为_______ 。
(2)氟气可以用于制取情性强于N2的保护气SF6,也可以用于制取聚合反应的催化剂PF3,PF3可以作为工业制取硅单质的中间物质(SiF4)的原料。
①SiF4分子的空间结构为_______ 。
②S、P、Si的第一电离能由大到小的顺序为_______ 。
(3)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯(C2F4),50g四氟乙烯含σ键的数目为_______ 。
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3AlF6降低Al2O3的熔点。Na、Al、F的电负性由小到大的顺序为_______ ,工业上不用电解AlCl3制取铝的原因为_______ 。
(1)氟磷灰石可用于制取磷肥,基态P原子有
 的中心P原子的杂化方式为
的中心P原子的杂化方式为(2)氟气可以用于制取情性强于N2的保护气SF6,也可以用于制取聚合反应的催化剂PF3,PF3可以作为工业制取硅单质的中间物质(SiF4)的原料。
①SiF4分子的空间结构为
②S、P、Si的第一电离能由大到小的顺序为
(3)氟气可以用于制取高化学稳定性材料聚四氟乙烯的原料四氟乙烯(C2F4),50g四氟乙烯含σ键的数目为
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3AlF6降低Al2O3的熔点。Na、Al、F的电负性由小到大的顺序为
您最近一年使用:0次
2024-01-11更新
|
97次组卷
|
3卷引用:河北省石家庄市第二十四中学2023-2024学年高二上学期12月月考化学试题
8 . 研究表明:质子溶剂参与苯乙烯环氧化反应机理如图所示(R表示烃基)。下列说法错误的是


| A.电负性:O>C>H | B.ROH与H2O2能形成分子间氢键 |
| C.ROH为反应过程的中间产物 | D.步骤③存在着极性键断裂和形成 |
您最近一年使用:0次
2023-07-28更新
|
95次组卷
|
4卷引用:河北省石家庄市辛集市2023-2024学年高三上学期2月期末考试化学试题
名校
解题方法
9 . 如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
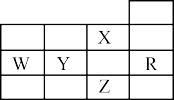
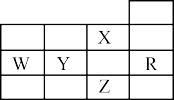
| A.W元素的第一电离能大于Y元素的第一电离能 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.p能级未成对电子最多的是Z元素 |
| D.X元素是电负性最大的元素 |
您最近一年使用:0次
2022-04-19更新
|
177次组卷
|
3卷引用:河北省石家庄市第二十三中学2021-2022学年高二下学期期中考试化学试题
10 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元它们的原子序数依次增大。请根据下列相关信息,回答问题:
(1)写出A的元素符号____ ,D的元素名称____ 。
(2)B基态原子中能量最高的电子,其电子云在空间有____ 个方向,原子轨道呈____ 形。
(3)某同学根据上述信息,推断C基态原子的核外轨道表示式为 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了____ 。
(4)E元素原子核外有____ 种运动状态不同的电子。
(5)G位于____ 族____ 区,价电子排布式为____ 。
(6)检验F元素的方法是____ ,请用原子结构的知识解释产生此现象的原因是____ 。
| A元素原子半径在元素周期表中最小,也是宇宙中最丰富的元素 |
| B元素原子的核外p能级总电子数比s能级总电子数少1个 |
| C元素原子的第一至第四电离能分别是I1=738kJ·mol-1;I2=l451kJ·mol-1;I3=7733kJ·mol-1;I4=10540kJ·mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4,原子半径同周期最小 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外轨道表示式为
 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了(4)E元素原子核外有
(5)G位于
(6)检验F元素的方法是
您最近一年使用:0次



