名校
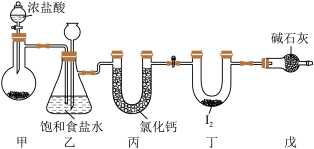
1 . 氯化碘(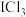 )在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃,遇水易反应。实验室可用如图装置(部分夹持装置已略去)制取
)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃,遇水易反应。实验室可用如图装置(部分夹持装置已略去)制取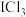 ,到备的反应原理:
,到备的反应原理: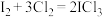 ,下列说法正确的是
,下列说法正确的是
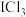 )在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃,遇水易反应。实验室可用如图装置(部分夹持装置已略去)制取
)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃,遇水易反应。实验室可用如图装置(部分夹持装置已略去)制取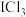 ,到备的反应原理:
,到备的反应原理: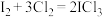 ,下列说法正确的是
,下列说法正确的是
A.甲装置是制备 的装置,可利用 的装置,可利用 和浓盐酸的反应 和浓盐酸的反应 |
| B.装置乙中长颈漏斗内液面上升说明装置可能发生堵塞 |
C.装置丙和戊的作用为除水,防止与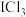 反应,可更换为浓硫酸 反应,可更换为浓硫酸 |
D.装置丁中生成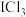 ,碘元素的化合价为 ,碘元素的化合价为 |
您最近一年使用:0次
2023-10-13更新
|
297次组卷
|
3卷引用:八省联考河北卷2024届高三上学期10月月考化学试题
2 . 钛酸钙矿物的晶胞结构如图(a)所示,某钙钛矿型太阳能光伏电池的有机半导材料的结构如图(b)所示,其中A为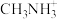 ,另两种离子为
,另两种离子为 和
和 。下列说法错误的是
。下列说法错误的是

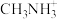 ,另两种离子为
,另两种离子为 和
和 。下列说法错误的是
。下列说法错误的是
A.钛酸钙晶体中距离 最近的 最近的 有8个 有8个 |
B.图(b)中,X为 |
| C.电负性:O>N>C |
D.钛酸钙晶胞中距离 最近的 最近的 形成了正八面体, 形成了正八面体, 位于其中心 位于其中心 |
您最近一年使用:0次
2022-08-27更新
|
300次组卷
|
8卷引用:河北省石家庄精英中学2022-2023高三上学期开学考试化学试题
名校
3 . 短周期主族元素X、Y、Z、W的原子序数依次增大。基态Y原子最外层电子排布式为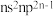 ,Y和W位于同主族,Z是短周期元素中金属性最强的元素。这四种元素的原子最外层电子数之和等于15。下列叙述正确的是
,Y和W位于同主族,Z是短周期元素中金属性最强的元素。这四种元素的原子最外层电子数之和等于15。下列叙述正确的是
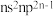 ,Y和W位于同主族,Z是短周期元素中金属性最强的元素。这四种元素的原子最外层电子数之和等于15。下列叙述正确的是
,Y和W位于同主族,Z是短周期元素中金属性最强的元素。这四种元素的原子最外层电子数之和等于15。下列叙述正确的是A.简单离子半径: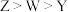 | B.电负性: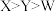 |
| C.ZXY含离子键和共价键 | D.工业上电解熔融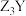 制备Z的单质 制备Z的单质 |
您最近一年使用:0次
2024-01-11更新
|
248次组卷
|
2卷引用:河北省石家庄市第九中学2023-2024学年高三上学期12月联考化学试题
名校
解题方法
4 . 由原子序数依次增大的短周期元素X、Y、Z、W、R组成的一种离子液体(其阳离子中五元环上5个原子共面),其结构如图。Z的最简单氢化物易液化,可用作制冷剂。W的氢化物的水溶液能腐蚀玻璃,Z、R为同一主族元素。下列说法错误的是
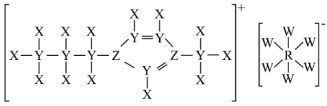
| A.电负性:W>Z>Y |
| B.该离子液体中的Z原子的杂化方式均为sp2 |
C.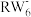 空间结构为正八面体形 空间结构为正八面体形 |
| D.最简单氢化物的沸点:Z<R |
您最近一年使用:0次
5 . 氮化锗(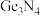 )具有耐腐蚀、硬度高等优点,应用广泛。下列说法正确的是
)具有耐腐蚀、硬度高等优点,应用广泛。下列说法正确的是
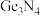 )具有耐腐蚀、硬度高等优点,应用广泛。下列说法正确的是
)具有耐腐蚀、硬度高等优点,应用广泛。下列说法正确的是| A.锗是金属,不能做半导体材料 |
| B.第4周期基态原子与锗未成对电子数相等的元素共有2种 |
C.基态锗原子的电子排布式可表示为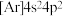 |
| D.氮化锗中氮显-3价,说明氮的电负性比锗大 |
您最近一年使用:0次
2022-10-08更新
|
281次组卷
|
2卷引用:河北省石家庄市第十七中学2022-2023高二下学期第一次月考化学试题
名校
解题方法
6 . 著名的观赏石-崂山璐石主要成分可表示为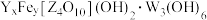 ,其中W、Y、Z表示三种原子序数依次增大的第三周期元素,W没有未成对电子,Z的最高正价与最低负价的代数和为0.下列说法错误的是
,其中W、Y、Z表示三种原子序数依次增大的第三周期元素,W没有未成对电子,Z的最高正价与最低负价的代数和为0.下列说法错误的是
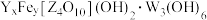 ,其中W、Y、Z表示三种原子序数依次增大的第三周期元素,W没有未成对电子,Z的最高正价与最低负价的代数和为0.下列说法错误的是
,其中W、Y、Z表示三种原子序数依次增大的第三周期元素,W没有未成对电子,Z的最高正价与最低负价的代数和为0.下列说法错误的是| A.Y的离子半径在同周期元素中最小 |
| B.Z在它的简单氢化物中显负价 |
| C.W、Y、Z的最高价氧化物的水化物都属于弱电解质 |
| D.三种元素的电负性由大到小的顺序为Z>Y>W |
您最近一年使用:0次
2021-12-02更新
|
556次组卷
|
3卷引用:河北省石家庄市第二中学2022-2023学年高二上学期10月月考化学试题
河北省石家庄市第二中学2022-2023学年高二上学期10月月考化学试题辽宁省沈阳市第一二〇中学2021-2022学年高二上学期期中考试化学试题(已下线)第一单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)
7 . W、X、Y、Z、M、Q是原子序数依次增大的前四周期元素,其元素性质或原子结构如下表所示。
(1)W、Z、Q的元素符号分别为_______ 、_______ 、_______ 。
(2)X的基态原子有_______ 种空间运动状态不同的电子,其中能量最高的电子所占据的原子轨道呈_______ 形。
(3)与Y处于同一周期的所有元素中,第一电离能比Y大的元素有_______ 种。
(4)M位于元素周期表的_______ 区, 简化的电子排布式为
简化的电子排布式为_______ 。
(5)Q位于元素周期表的第_______ 周期_______ 族,其价层电子排布图为_______
(6)W、X、Y、Z的电负性由大到小的顺序为_______ (填元素符号)。
| 元素 | 元素性质或原子结构 | ||||||||||||||||||
| W | 电子只有一种自旋取向 | ||||||||||||||||||
| X | 最外层电子排布式为 | ||||||||||||||||||
| Y | 非金属元素,且s能级上的电子总数与p能级上的电子总数相等 | ||||||||||||||||||
| Z |
| ||||||||||||||||||
| M | 前四周期元素中原子核外未成对电子数最多 | ||||||||||||||||||
| Q | 与X同主族 | ||||||||||||||||||
(2)X的基态原子有
(3)与Y处于同一周期的所有元素中,第一电离能比Y大的元素有
(4)M位于元素周期表的
 简化的电子排布式为
简化的电子排布式为(5)Q位于元素周期表的第
(6)W、X、Y、Z的电负性由大到小的顺序为
您最近一年使用:0次
名校
解题方法
8 . Ⅰ.尿素[CO(NH2)2]是人工合成的第一种有机物,可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
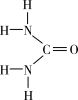
(1)[Fe(H2NCONH2)6](NO3)3中所含元素的电负性由大到小的顺序是______________ 。
(2)尿素中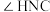
______________ 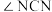 (填“>”“=”“<”),理由是
(填“>”“=”“<”),理由是______________ 。
(3)[Fe(H2NCONH2)6](NO3)3中不存在 的化学键____________ (填序号)。
A.离子键 B.金属键 C.配位键 D. 键 E.
键 E. 键
键
Ⅱ.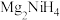 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
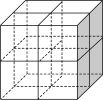
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。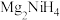 晶胞形状为如图立方体,边长为
晶胞形状为如图立方体,边长为 ,
, 原子占据顶点和面心,
原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
(4) 原子的价电子排布式为
原子的价电子排布式为______________ 。
(5) 位于
位于 原子形成的
原子形成的______________ (填“八面体空隙”或“四面体空隙”)。
(6)该晶体的密度为___________  (用含a、
(用含a、 代数式表示)。
代数式表示)。

(1)[Fe(H2NCONH2)6](NO3)3中所含元素的电负性由大到小的顺序是
(2)尿素中
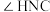
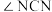 (填“>”“=”“<”),理由是
(填“>”“=”“<”),理由是(3)[Fe(H2NCONH2)6](NO3)3中
A.离子键 B.金属键 C.配位键 D.
 键 E.
键 E. 键
键Ⅱ.
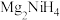 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。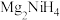 晶胞形状为如图立方体,边长为
晶胞形状为如图立方体,边长为 ,
, 原子占据顶点和面心,
原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
(4)
 原子的价电子排布式为
原子的价电子排布式为(5)
 位于
位于 原子形成的
原子形成的(6)该晶体的密度为
 (用含a、
(用含a、 代数式表示)。
代数式表示)。
您最近一年使用:0次
名校
9 . 下列说法正确的是
| A.电负性越大的元素对键合电子的吸引力强,其第一电离能也越大 |
B.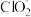 与 与 两种离子的空间构型相同,但其中心原子的杂化方式不同 两种离子的空间构型相同,但其中心原子的杂化方式不同 |
| C.H2O2与C2H2均为既含σ键又含π键的非极性分子 |
| D.NH3的稳定性强于AsH3的原因为NH3存在分子间氢键 |
您最近一年使用:0次
名校
解题方法
10 . 法国一家公司研发出一种比锂电池成本更低、寿命更长、充电速度更快的钠离子电池,该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)C、O、Cl三种元素电负性由大到小的顺序为_______ 。
(2)基态Na原子中,核外不同电子运动状态的数目为_______ ,Te属于元素周期表中_______ 区元素,其基态原子的价电子排布式为_______ 。
(3) 的空间结构为
的空间结构为_______ ,碳酸丙烯酯的结构简式如图所示,其中碳原子的杂化轨道类型为_______ ,1mol碳酸丙烯酯中σ键的数目为_______ 。

(4)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为_______ ,该晶胞的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_______ cm(用含有ρ、NA的代数式表示)。

回答下列问题:
(1)C、O、Cl三种元素电负性由大到小的顺序为
(2)基态Na原子中,核外不同电子运动状态的数目为
(3)
 的空间结构为
的空间结构为
(4)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为

您最近一年使用:0次
2021-09-09更新
|
578次组卷
|
6卷引用:河北省石家庄市第一中学2020-2021学年高二下学期学情反馈(一)化学试题