名校
解题方法
1 . 过渡元素中,Ti被誉为“未来金属”、“战略金属”,其具有稳定的化学性质。回答下列问题:
(1)基态钛原子的电子排布式为_______ 。
(2)Ti可形成多种配合物。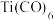 、
、 、
、 的配体所含原子中电负性由大到小的顺序是
的配体所含原子中电负性由大到小的顺序是_______ (写元素符号);CO作配体时,配位原子是C而不是O,其原因是_______ ; 中
中
_______ (填“大于”、“小于”或“等于”)单个水分子中 。
。
(3) 是氧化法制取钛的中间产物。
是氧化法制取钛的中间产物。 的分子结构与
的分子结构与 相同,二者在常温下都是液体。
相同,二者在常温下都是液体。 分子的空间构型是
分子的空间构型是_______ ,其中Ti原子采取_______ 杂化。
(4)如图为四方晶系的 晶体结构:
晶体结构:
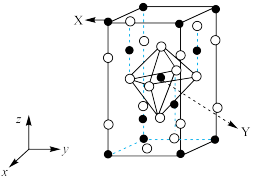
●表示_______ 原子(填元素符号),晶胞参数 ,底面边长为
,底面边长为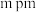 ,高为
,高为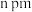 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,
, 的密度为
的密度为 ,则m的表达式为
,则m的表达式为_______ pm(列出计算式)。
(1)基态钛原子的电子排布式为
(2)Ti可形成多种配合物。
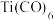 、
、 、
、 的配体所含原子中电负性由大到小的顺序是
的配体所含原子中电负性由大到小的顺序是 中
中
 。
。(3)
 是氧化法制取钛的中间产物。
是氧化法制取钛的中间产物。 的分子结构与
的分子结构与 相同,二者在常温下都是液体。
相同,二者在常温下都是液体。 分子的空间构型是
分子的空间构型是(4)如图为四方晶系的
 晶体结构:
晶体结构:
●表示
 ,底面边长为
,底面边长为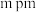 ,高为
,高为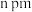 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,
, 的密度为
的密度为 ,则m的表达式为
,则m的表达式为
您最近一年使用:0次
2 . 2022年诺贝尔化学奖授予开发“点击化学”科学家。分子R称为“点击化学试剂”,如图所示。下列叙述错误的是
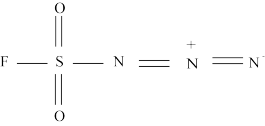
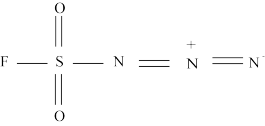
A.电负性: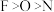 |
B.第一电离能: |
| C.S原子核外有6种运动状态不同的电子 |
| D.基态F原子核外电子占据3个能级 |
您最近一年使用:0次
2023-01-04更新
|
402次组卷
|
3卷引用:福建省泉州市三校2022-2023学年高二下学期4月期中联考化学试题
福建省泉州市三校2022-2023学年高二下学期4月期中联考化学试题湖北省荆州市八县市2022-2023学年高二上学期期末联考化学试题(已下线)北京市海淀区2023届高三上学期期末考试变式汇编(8-14)
名校
解题方法
3 . 非金属硼化物在现代工农业、医学和国防中有着重要的应用价值。回答下列问题:
(1)氨硼烷(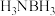 )是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是___________(填序号)。
)是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是___________(填序号)。
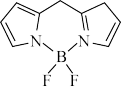
(2)氮杂氟硼二吡咯具有作为光动力学治疗(PDT)光敏剂的潜能,结构如图所示,分子内含有一个大Π键,大Π键可用符号 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为 )、该大Π键的表示形式为
)、该大Π键的表示形式为___________ ,该分子中所有元素的电负性由大到小的顺序为___________ 。
(3)硼氢化钠( )是一种常用的还原剂,其晶胞结构如图所示:
)是一种常用的还原剂,其晶胞结构如图所示:
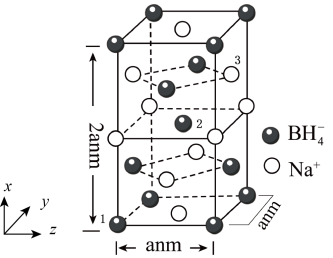
① 的配位数是
的配位数是___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标参数,其中原子坐标参数“1”为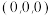 ;“2”为
;“2”为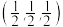 ;标注为“3”的
;标注为“3”的 坐标参数为
坐标参数为___________ 。
③已知硼氢化钠晶体的密度为 ,
, 代表阿伏加德罗常数的值,则
代表阿伏加德罗常数的值,则 与
与 之间的最近距离为
之间的最近距离为___________ nm(用含ρ、 的代数式表示)。
的代数式表示)。
④若硼氢化钠晶胞上、下底心处的 被
被 取代,得到晶体的化学式为
取代,得到晶体的化学式为___________ 。
(1)氨硼烷(
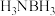 )是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是___________(填序号)。
)是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是___________(填序号)。A. 和 和 | B.LiH和HCN | C. 和 和 | D. 和 和 |
 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为 )、该大Π键的表示形式为
)、该大Π键的表示形式为
(3)硼氢化钠(
 )是一种常用的还原剂,其晶胞结构如图所示:
)是一种常用的还原剂,其晶胞结构如图所示:
①
 的配位数是
的配位数是②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标参数,其中原子坐标参数“1”为
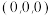 ;“2”为
;“2”为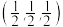 ;标注为“3”的
;标注为“3”的 坐标参数为
坐标参数为③已知硼氢化钠晶体的密度为
 ,
, 代表阿伏加德罗常数的值,则
代表阿伏加德罗常数的值,则 与
与 之间的最近距离为
之间的最近距离为 的代数式表示)。
的代数式表示)。④若硼氢化钠晶胞上、下底心处的
 被
被 取代,得到晶体的化学式为
取代,得到晶体的化学式为
您最近一年使用:0次
名校
解题方法
4 . 某锂电池材料的结构如图,M、W、X、Y、Z是原子序数依次增大的同周期主族元素,Y元素原子的价电子数是W的两倍。下列说法正确的是
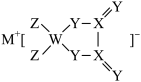
| A.简单氢化物沸点:X>Y |
| B.第一电离能:M>Z |
| C.元素X与Y原子轨道中含有的未成对电子数相同 |
| D.五种元素电负性最大的是X |
您最近一年使用:0次
2022-12-23更新
|
555次组卷
|
4卷引用:福建省厦门外国语学校2022-2023学年高二下学期期中考试化学试题
名校
解题方法
5 . Ⅰ.尿素[CO(NH2)2]是人工合成的第一种有机物,可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
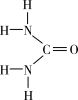
(1)[Fe(H2NCONH2)6](NO3)3中所含元素的电负性由大到小的顺序是______________ 。
(2)尿素中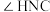
______________ 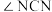 (填“>”“=”“<”),理由是
(填“>”“=”“<”),理由是______________ 。
(3)[Fe(H2NCONH2)6](NO3)3中不存在 的化学键____________ (填序号)。
A.离子键 B.金属键 C.配位键 D. 键 E.
键 E. 键
键
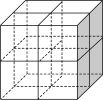
Ⅱ. 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。 晶胞形状为如图立方体,边长为
晶胞形状为如图立方体,边长为 ,
, 原子占据顶点和面心,
原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
(4) 原子的价电子排布式为
原子的价电子排布式为______________ 。
(5) 位于
位于 原子形成的
原子形成的______________ (填“八面体空隙”或“四面体空隙”)。
(6)该晶体的密度为___________  (用含a、
(用含a、 代数式表示)。
代数式表示)。

(1)[Fe(H2NCONH2)6](NO3)3中所含元素的电负性由大到小的顺序是
(2)尿素中
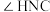
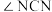 (填“>”“=”“<”),理由是
(填“>”“=”“<”),理由是(3)[Fe(H2NCONH2)6](NO3)3中
A.离子键 B.金属键 C.配位键 D.
 键 E.
键 E. 键
键Ⅱ.
 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。 晶胞形状为如图立方体,边长为
晶胞形状为如图立方体,边长为 ,
, 原子占据顶点和面心,
原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
(4)
 原子的价电子排布式为
原子的价电子排布式为(5)
 位于
位于 原子形成的
原子形成的(6)该晶体的密度为
 (用含a、
(用含a、 代数式表示)。
代数式表示)。
您最近一年使用:0次
名校
解题方法
6 . 已知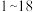 号元素的离子
号元素的离子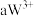 、
、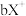 、
、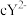 、
、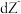 都具有相同电子层结构,下列关系正确的是
都具有相同电子层结构,下列关系正确的是
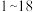 号元素的离子
号元素的离子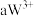 、
、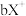 、
、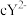 、
、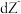 都具有相同电子层结构,下列关系正确的是
都具有相同电子层结构,下列关系正确的是A.质子数: ,离子的还原性: ,离子的还原性: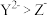 |
B.电负性: |
C.氢化物的稳定性: |
D.原子半径: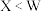 ,第一电离能: ,第一电离能: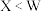 |
您最近一年使用:0次
2022-12-02更新
|
1077次组卷
|
34卷引用:福建省三明市第一中学2016-2017学年高二下学期半期考试化学试题
福建省三明市第一中学2016-2017学年高二下学期半期考试化学试题福建省厦门市思明区厦门外国语学校2019-2020学年高二上学期周末练习10——化学试题2015-2016学年贵州省思南中学高二下第一次月考化学试卷2015-2016学年山西大学附属中学高二下3月月考化学试卷2015-2016学年吉林省汪清六中高二3月月考化学试卷2015-2016学年山西大学附中高二下3月月考化学试卷2016-2017学年河北省衡水中学高二上学期五调考试化学试卷2016-2017学年河南省洛阳市第一高级中学高二(平行班)3月月考化学试卷2016-2017学年山西省大同市第一中学高二3月月考化学试卷贵州省思南中学2016-2017学年高二下学期期中考试化学试题人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质1河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题【全国百强校】甘肃省嘉峪关市酒钢三中2017-2018学年高二下学期期中考试化学试题【全国百强校】宁夏吴忠中学2017-2018学年高二6月月考化学试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择提升专练】河南省林州市林虑中学2019-2020学年高二3月线上考试化学试题河北省石家庄市启明中学2019-2020学年高二四月月考化学试题吉林省白山市第七中学2019-2020学年高二下学期3月份月考化学试题鲁科版(新)必修第二册第一章检测题辽宁省六校协作体2019-2020学年高二下学期期中考试化学试卷(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第3节 元素性质及其变化规律(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质(人教版2019)选择性必修2第一章 原子结构与性质 第二节 原子结构与元素的性质 第3课时 元素的电负性及其变化规律鲁科版2019选择性必修2第1章 原子结构与元素性质 第3节 元素性质及其变化规律 第2课时 元素的电负性及其变化规律(已下线)模块同步卷03 第一章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)专题强化练2 电离能和电负性的应用吉林省辉南县第六中学2022-2023学年高二上学期期中考试化学试题湖南省长沙市周南中学2022-2023学年高二上学期期末考试化学试题安徽省池州市第一中学2022-2023学年高二下学期第一次月考化学试题北京市第三十五中学2021-2022学年高三上学期期中考试化学试题四川省内江市资中县第二中学2023-2024学年高二下学期3月月考化学试题黑龙江省黑河市第一中学2023-2024学年高二下学期4月月考化学试题内蒙古自治区赤峰第四中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
7 . 当汽车遭受一定碰撞力量以后,安全气囊中的物质会发生剧烈的反应:NaN3+KNO3=K2O+Na2O+N2↑(未配平),生成大量气体。下列说法正确的是
| A.半径大小:r(Na+)<r(N3-) | B.电负性大小:χ(N)>χ(O) |
| C.电离能大小:I1(Na)>I1(O) | D.碱性强弱:KOH<NaOH |
您最近一年使用:0次
2022-11-27更新
|
249次组卷
|
3卷引用:福建省龙岩市连城县第一中学2023-2024学年高三上学期10月月考化学试题
8 . 钛和锆为同族的元素,它们形成的化合物用途广泛。
(1)锆为第五周期元素,基态原子的价层电子排布式为_______ 。
(2)钛与EDTA(乙二胺四乙酸根离子,结构如图1)形成的配位离子如图2所示。
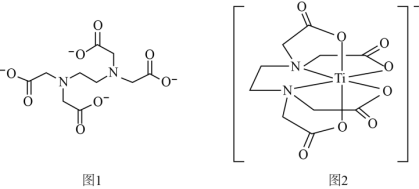
①EDTA中所含元素的电负性从大到小的顺序为_______ ;
②EDTA中键角∠NCC_______ (填“>”、“<”或“=”)∠CNC;
③钛与EDTA形成的配位离子中配位数为_______ 。
(3)常温下TiCl4为液体,ZrCl4为易升华的固体。两者熔点不同的原因是_______ 。
(4)ZrO2是制作全瓷牙的主要原料。ZrO2的晶体有立方晶相(如图3)、单斜晶相(如图4,微粒未画出,微粒分布与立方晶相相似,晶胞参数α=γ=900≠β,apm、bpm、cpm)等。
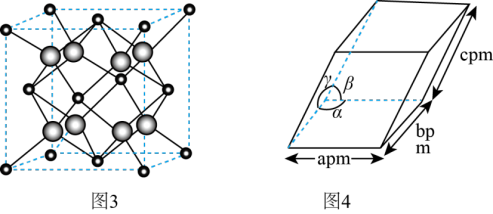
①ZrO2立方晶相中,与Zr等距离且最近的O围成的几何图形是_______ 。
②设阿伏加德罗常数的值为NA,则单斜晶相ZrO2的密度为_______ g·cm-3(列出含字母的计算表达式)。
(1)锆为第五周期元素,基态原子的价层电子排布式为
(2)钛与EDTA(乙二胺四乙酸根离子,结构如图1)形成的配位离子如图2所示。

①EDTA中所含元素的电负性从大到小的顺序为
②EDTA中键角∠NCC
③钛与EDTA形成的配位离子中配位数为
(3)常温下TiCl4为液体,ZrCl4为易升华的固体。两者熔点不同的原因是
(4)ZrO2是制作全瓷牙的主要原料。ZrO2的晶体有立方晶相(如图3)、单斜晶相(如图4,微粒未画出,微粒分布与立方晶相相似,晶胞参数α=γ=900≠β,apm、bpm、cpm)等。

①ZrO2立方晶相中,与Zr等距离且最近的O围成的几何图形是
②设阿伏加德罗常数的值为NA,则单斜晶相ZrO2的密度为
您最近一年使用:0次
9 . “律动世界”国际化学元素周期表主题年活动报告中,提到了一种具有净水作用的物质,它由Q、W、X、Y、Z五种原子序数依次增大的元素组成。该五种元素的性质或结构信息如下表:
下列说法正确的是
| 元素 | 信息 |
| Q | 基态原子只有一种形状的轨道填有电子,并容易形成共价键 |
| W | 基态原子有5个原子轨道填充有电子,有2个未成对电子 |
| X | 最高价氧化物对应的水化物与Y、Z最高价氧化物对应的水化物都能反应 |
| Y | 在元素周期表中位于第3周期、第ⅥA族 |
| Z | 焰色反应为紫色 |
| A.电负性:Q<W<Y | B.第一电离能:W<X<Z |
| C.简单离子半径:X<W<Z<Y | D.这种物质只含离子键 |
您最近一年使用:0次
2022-11-02更新
|
1058次组卷
|
6卷引用:福建省福州高级中学2022-2023学年高二下学期4月期中考试化学试题
10 . 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为_______ ,最高能级电子的电子云轮廓形状为_______ 。
(2)比较下列锗卤化物的熔点和沸点,分析其变化的原因_______ 。
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是_______ 。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______ ,微粒之间存在的作用力是_______ 。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为(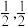 ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为_______ 。
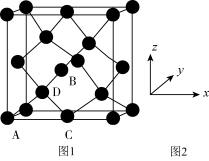
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为_______ g·cm-3(列出计算式即可)。
(1)基态Ge原子的核外电子排布式为
(2)比较下列锗卤化物的熔点和沸点,分析其变化的原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为(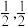 ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为
您最近一年使用:0次



