解题方法
1 . 与石墨结构相似的六方氮化硼(BN)晶体在高温高压下可以转化为立方氮化硼(BN),立方氮化硼的结构与金刚石相似,硬度与金刚石相当。下列关于该物质的分析中正确的是
| A.六方氮化硼转化为立方氮化硼是物理变化 |
B.立方氮化硼(BN)中氮元素的化合价为 |
C.和 键相比, 键相比, 键的键长更长 键的键长更长 |
| D.立方氮化硼比晶体硅的熔点更高,硬度更大 |
您最近一年使用:0次
2021-09-22更新
|
542次组卷
|
4卷引用:福建泉州市第六中学2020-2021学年高二下学期期中考试化学试题
福建泉州市第六中学2020-2021学年高二下学期期中考试化学试题2021年湖北高考化学试题变式题1-103.2.2 共价晶体-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)(已下线)第3.2.2讲 共价晶体-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
名校
解题方法
2 . 下列有关微拉性质的比较中,正确的是
A.原子半径: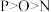 | B.最高正价: |
C.第一电离能: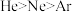 | D.电负性: |
您最近一年使用:0次
2021-09-22更新
|
465次组卷
|
5卷引用:福建泉州市第六中学2020-2021学年高二下学期期中考试化学试题
福建泉州市第六中学2020-2021学年高二下学期期中考试化学试题(已下线)第1章 原子结构与性质(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)陕西省宝鸡市金台区2021-2022学年高二下学期期中考试化学试题吉林省吉林市田家炳高级中学2022-2023学年高二上学期期末线上考试化学试题四川省南充市阆中中学校2023-2024学年高二下学期3月月考化学试卷
名校
3 . 在以离子键为主的离子化合物中,形成离子键的两种元素电负性差距越小,则含有共价键的成分越高;下列各对原子形成的化学键中含有共价键成分最少的是
| A.Li F | B.Na F | C.Na Cl | D.Mg O |
您最近一年使用:0次
2021-09-22更新
|
139次组卷
|
2卷引用:福建省泉州市培元中学2020-2021学年高二下学期期中考试化学试题
真题
名校
4 . 元素X、Y、Z、Q、R的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是
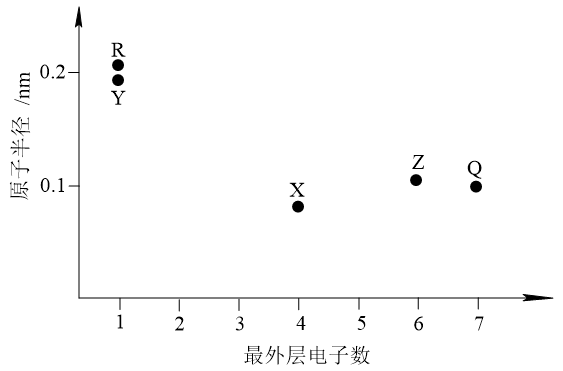

| A.X的电负性比Q的大 |
| B.Q的简单离子半径比R的大 |
| C.Z的简单气态氢化物的热稳定性比Q的强 |
| D.Y的最高价氧化物对应的水化物的碱性比R的强 |
您最近一年使用:0次
2021-09-07更新
|
6248次组卷
|
16卷引用:福建省福州第十五中学2022-2023学年高三上学期11月线上限时训练化学试题
福建省福州第十五中学2022-2023学年高三上学期11月线上限时训练化学试题2021年新高考天津化学高考真题湖北省仙桃中学、天门中学(A班)2021-2022学年高二上学期期中考试化学试题2021年天津高考化学试题变式题1-12(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)易错点14 元素周期表和元素周期律-备战2023年高考化学考试易错题(已下线)专题12 元素周期律推断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第五章 物质结构与性质 元素周期律 第27讲 元素周期表和元素周期律(已下线)题型10 元素“位—构—性”关系的综合应用广东番禺中学2022-2023学年高二下学期4月期中考试化学试题(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)天津市第二南开学校2023-2024学年高三上学期期中质量调查化学试题广东省普宁市勤建学校2023-2024学年高三上学期第三次月考化学试题天津市南仓中学2023-2024学年高三上学期教学质量过程性检测与诊断化学试卷
名校
解题方法
5 . 回答下列问题:
(1)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是___________ 。
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的是___________ 。
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为___________ 。
(2)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(II)双核配合物的内界。

①配合物中每个中心离子的配位数为___________ 。
②Co2+的最高能层电子排布式为___________ 。
③下列状态的钴中,电离最外层一个电子所需能量最大的是___________ (填标号)
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)二氯甲醛的结构简式为 ,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是
,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是___________ 。
(4)碳酸亚乙酯( )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因___________ 。
(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱___________ 。
(6)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

该晶胞中由O2-形成的正八面体的空隙数为___________ 。
②晶胞中距离最近的两个O2-之间的距离为a pm,MnO晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值为___________ (用含a和ρ的最简代数式表示)
(1)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的是
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为
(2)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(II)双核配合物的内界。

①配合物中每个中心离子的配位数为
②Co2+的最高能层电子排布式为
③下列状态的钴中,电离最外层一个电子所需能量最大的是
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)二氯甲醛的结构简式为
 ,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是
,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是(4)碳酸亚乙酯(
 )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱
(6)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

该晶胞中由O2-形成的正八面体的空隙数为
②晶胞中距离最近的两个O2-之间的距离为a pm,MnO晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值为
您最近一年使用:0次
6 . 科学工作者合成了含镁、镍、碳3种元素的超导材料,具有良好的应用前景,回答下列问题:
(1)镍元素位于周期表第_______ 列,基态镍原子d轨道中成对电子与单电子的数量比为_______ 。
(2)在CO分子中,C与O之间形成_______ 个σ键、_______ 个π键,在这些化学键中,O原子共提供了_______ 个电子。
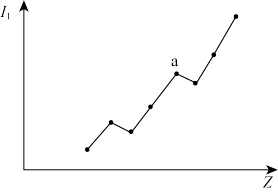
(3)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是_______ 。原子核对外层电子的引力增大,导致I1在a点出现齿峰的原因是_______ 。
(4)VA族元素及其化合物在生产、生活中用途广泛。如P4S3常用于制造火柴,As4S4俗称雄黄,那么
①P、S、As电负性由大到小的顺序是_______ 。
②NH3、PH3、AsH3中沸点最高的是_______ ,其主要原因是_______ 。
(1)镍元素位于周期表第
(2)在CO分子中,C与O之间形成
(3)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是
(4)VA族元素及其化合物在生产、生活中用途广泛。如P4S3常用于制造火柴,As4S4俗称雄黄,那么
①P、S、As电负性由大到小的顺序是
②NH3、PH3、AsH3中沸点最高的是

您最近一年使用:0次
2021-05-11更新
|
128次组卷
|
2卷引用:福建省泉州一中2020-2021学年高三上学期期末化学试题
名校
解题方法
7 . 在碱性溶液中,Cu2+可以与缩二脲形成紫色配离子,其结构如图所示。下列说法错误的是
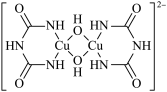

| A.该配离子与水分子形成氢键的原子只有N和O |
| B.该配离子中铜离子的配位数是4 |
| C.基态Cu原子的价电子排布式是 3d104s1 |
| D.该配离子中非金属元素的电负性大小顺序为O>N>C>H |
您最近一年使用:0次
2021-04-29更新
|
916次组卷
|
19卷引用:福建省连城县第一中学2021-2022学年高三上学期10月月考化学试题
福建省连城县第一中学2021-2022学年高三上学期10月月考化学试题湖北省2021年普通高中学业水平选择考适应性测试化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练河北省石家庄市第二中学2021届高三3月学情考试化学试题湖北武汉市蔡甸区汉阳一中2020-2021学年高二下学期3月月考化学试题辽宁省实验中学东戴河分校两校2020-2021学年高二4月联考化学试题四川省成都市树德中学2020-2021学年高二下学期4月月考化学试题(已下线)押山东卷第04题 物质结构与性质选择题-备战2021年高考化学临考题号押题(山东卷)山东省滨州市无棣县2020-2021学年高二下学期期中考试化学试题河北省石家庄市第二十四中学2020-2021学年高二第二学期期中考试化学试题(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)浙江金华第一中学2021-2022学年高二下学期期中考试化学试题第三章 本章达标检测2北京市海淀实验中学2022-2023学年高三上学期10月学科展示化学试题(已下线)专题十 物质结构与性质(选择性必修2)能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)江西省景德镇一中2022-2023学年高二上学期期中考试化学试题山东省菏泽市单县二中2021-2022学年高二下学期开学考试 化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第7讲 配合物与超分子
13-14高二上·江苏泰州·期中
名校
解题方法
8 . 如图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是
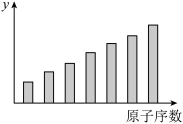
| A.y轴表示的可能是第一电离能 |
| B.y轴表示的可能是电负性 |
| C.y轴表示的可能是原子半径 |
| D.y轴表示的可能是形成基态离子转移的电子数 |
您最近一年使用:0次
2021-04-24更新
|
1003次组卷
|
51卷引用:福建省平和县第一中学2018-2019学年高二下学期期末考试化学试题
福建省平和县第一中学2018-2019学年高二下学期期末考试化学试题福建省福州市格致中学2018-2019学年高二下学期期中考试化学试题福建省建瓯市芝华中学2019-2020学年高二下学期居家学习检测化学试题福建省建瓯市芝华中学2019-2020学年高二下学期第一次阶段考试化学试题福建省漳州市正兴学校等三校2021-2022学年高二下学期期中联考化学试题福建省宁德市柘荣县第一中学2021-2022学年高二下学期月考八化学试题福建省南平市浦城县2022-2023学年高二下学期期中考试化学试题(已下线)2013-2014学年江苏省泰州市姜堰区高二上学期期中考试化学试卷2015-2016学年黑龙江省哈尔滨六中高二下期中化学试卷2016-2017学年河南省商丘市第一高级中学高二上学期期末考试化学试卷湖北省蕲春县2016-2017学年高二下学期期中考试化学试题2018版化学(苏教版)高考总复习专题十一课时跟踪训练--原子结构与元素的性质山东师范大学附属中学2017-2018学年高二下学期期中考试(理)化学试题山东省师范大学附属中学2017-2018学年高二下学期第七次学分认定考试(期中)(理)化学试题【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题【全国百强校】山西省大同市第一中学2017-2018学年高二5月月考化学试题河南省兰考县第二高级中学2017-2018学年高二下学期期中考试化学试题吉林省辽源市田家炳高级中学2018-2019学年高二下学期期中考试化学试题山西省阳泉市第二中学2018-2019学年高二下学期期中考试化学试题鲁科版高中化学选修3模块综合测评卷黑龙江省哈尔滨市呼兰一中、阿城二中、宾县三中、尚志五中四校2018-2019学年高二下学期期中考试化学试题新疆阿勒泰地区第二高级中学2018-2019学年高二下学期期末(A卷)化学试题山东省济宁市2018-2019学年高二期末模块检测化学试题宁夏回族自治区石嘴山市平罗中学2019-2020学年高二上学期期中考试化学试题四川省南充市白塔中学2019-2020学年高二上学期期中考试化学试题人教化学选修3第一章第二节课时5天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题第1章 原子结构——C挑战区 模拟高考(鲁科版选修3)安徽省定远县育才学校2019-2020学年高一6月月考化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题河南省洛阳市2019-2020学年高二下学期期末质量检测化学试题(已下线)第35讲 原子结构与性质(精练)-2021年高考化学一轮复习讲练测(已下线)第1章 原子结构与元素性质(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)新疆维吾尔自治区乌鲁木齐市第四中学2020-2021学年高二年级下学期期中考试化学试题吉林省长春市清蒲中学2020-2021学年高二下学期期中考试化学试题甘肃省兰州第一中学2021-2022学年高二下学期期中考试化学试题(已下线)专题13 原子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)新疆乌鲁木齐高级中学2021-2022学年高二上学期期末考试化学试题湖南省长沙市长郡梅溪湖中学2021-2022学年高二下学期入学考试化学试题河北省石家庄市第二十七中学2022-2023学年高三上学期九月月考化学试题新疆疏勒县实验学校2021-2022学年高二下学期期末考试化学试题陕西省西安市阎良区关山中学2021-2022学年高二下学期期末质量检测化学试题重庆市缙云教育联盟2022-2023学年高二上学期期末联考化学试题黑龙江省大庆市大庆中学2022-2023学年高二下学期4月月考化学试题新疆维吾尔自治区皮山县高级中学2022-2023学年高二下学期4月期中化学试题重庆市2022-2023学年高二上学期期末考试化学试题(已下线)寒假作业10 原子结构与性质-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)天津市九十六中学2023-2024学年高三上学期12月月考化学试题四川省阆中中学校2023-2024学年高二下学期4月期中化学试题(已下线)清单01 原子结构与性质(考点清单)(讲+练)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
9 . 四种元素的基态原子的电子排布式如下:下列说法中正确的是
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。
| A.原子半径:④>③>②>① | B.最高正化合价:④>①>③=② |
| C.电负性:④>③>②>① | D.第一电离能:④>③>②>① |
您最近一年使用:0次
2021-04-21更新
|
660次组卷
|
5卷引用:福建省福州市连江第五中学2020-2021学年高二下学期第一次质量检测化学试题
10 . 二氟化二氧(O2F2)是一种极强的氧化剂和氟化剂,可以发生反应:H2S+4O2F2=SF6+2HF+4O2。下列有关说法不正确的是
| A.还原性:H2S>HF |
| B.离子半径:S2->O2->F- |
| C.上述反应中被还原的元素的基态原子的成对电子个数为4 |
D.上述反应的四种元素中电负性最强的元素的基态原子价层电子排布图为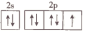 |
您最近一年使用:0次
2021-03-17更新
|
311次组卷
|
4卷引用:福建省建瓯市芝华中学2023-2024学年高二下学期第一次阶段考试化学试题



