10-11高二下·江西南昌·期末
1 . 以下有关元素性质的说法不正确的是( )
| A.具有下列电子排布式的原子中:①1s22s22p63s23p2,②1s22s22p3,③1s22s22p2,④1s22s22p63s23p4,原子半径最大的是① |
| B.下列价电子排布式的原子中:①3s23p1,②3s23p2,③3s23p3,④3s23p4,第一电离能最大的是③ |
| C.①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl中,元素的电负性随原子序数增大而递增的是④ |
| D.某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
您最近一年使用:0次
2020-08-21更新
|
1226次组卷
|
37卷引用:福建省建瓯市芝华中学2021-2022学年高二下学期第一次阶段考化学试题
福建省建瓯市芝华中学2021-2022学年高二下学期第一次阶段考化学试题福建省建瓯市芝华中学2023-2024学年高二下学期第一次阶段考试化学试题(已下线)2010-2011学年江西省新建二中高二下学期期末考试化学试卷(已下线)2014年高考化学苏教版总复习 12-1 原子结构与元素的性质练习卷2015-2016学年辽宁省沈阳二中高二下期中化学试卷黑龙江省牡丹江市第一高级中学2016-2017学年高二下学期期中考试化学试题山西省怀仁县第一中学2016-2017学年高二下学期第三次(5月)月考化学试题河南省洛阳名校2017-2018学年高二上学期第二次联考化学试题【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题山西省沁县中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期期中考试化学试题吉林省白山市第七中学2018-2019学年高二下学期期中考试化学试题(已下线)2019年6月16日 《每日一题》选修3-每周一测甘肃省临泽一中2018-2019学年高二下学期期末模拟化学试题(已下线)2019年11月22日 《每日一题》2020年高考化学一轮复习——电离能和电负性江苏省南京师范大学苏州实验学校2019-2020学年高二上学期期中考试化学试题(已下线)专题11.3 晶体结构与性质(练)-《2020年高考一轮复习讲练测》辽宁省实验中学东戴河分校2019-2020学年高二12月月考化学试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择基础专练】第1章 原子结构——B拓展区综合拓展(鲁科版选修3)甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(普通班)辽宁省大连市大连海湾高级中学2019-2020学年高二下学期第一次质量检测化学试题山东省潍坊昌乐县第二中学2020届高三上学期期末化学模拟试题二(已下线)山东省邹城市2018-2019学年高二上学期12月月考化学试卷(人教版2019)选择性必修2 第一章 原子结构与性质 综合检测卷鲁科版2019选择性必修2第1章综合检测卷高二选择性必修2(人教版2019)第一章 原子结构与性质 第二节综合训练(已下线)第一单元 原子结构(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)河南省开封市五县2020-2021学年高二下学期月考化学试题四川省汉源县第二中学2019-2020学年高二下学期第二次月考化学试题安徽省六安第一中学2021-2022学年高二上学期期末考试化学试题第二节 原子结构与元素的性质 第2课时 元素周期律——原子半径、电离能、电负性的递变规律四川省绵阳中学2022-2023学年高二上学期第一次月考化学试题河南省焦作市第一中学2022-2023学年高二下学期3月份教学质量检测 化学试题山东省青岛一中2023-2024学年高一下学期4月月考化学试卷新疆乌鲁木齐市第三十一中学2023-2024学年高二下学期3月月考 化学试题
2 . 短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
| 元素 | X | Y | Z | W |
| 最高价氧化物的水化物 | H3ZO4 | |||
 溶液对应的pH(25℃) 溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
| A.元素电负性:Z<W | B.简单离子半径:W<Y |
| C.元素第一电离能:Z<W | D.简单氢化物的沸点:X<Z |
您最近一年使用:0次
2020-07-11更新
|
8531次组卷
|
45卷引用:福建省福州第一中学2021-2022学年高二下学期期中考试化学试题
福建省福州第一中学2021-2022学年高二下学期期中考试化学试题2020年天津卷化学高考试题(已下线)专题06 物质结构 元素周期律-2020年高考真题和模拟题化学分项汇编(已下线)第8单元 原子结构 元素周期律(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷山东省潍坊市诸城一中2021届高三11月份模拟化学试题(已下线)小题必刷22 元素周期表(律)及其应用——2021年高考化学一轮复习小题必刷(通用版)(人教版2019)选择性必修2 第一章 原子结构与性质 章末综合检测卷(已下线)热点6 物质结构与元素周期律-2021年高考化学专练【热点·重点·难点】(新高考)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)专题04 物质结构和元素周期律——备战2021年高考化学纠错笔记(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练甘肃省兰州市第一中学2020-2021学年高二下学期4月月考化学试题湖北省沙市第五中学2020-2021学年高二下学期3月月考化学试题(已下线)小题15 元素周期表、律(根据物质性质角度的元素推断)——备战2021年高考化学经典小题考前必刷(全国通用)山东省济南大学城实验高级中学2021届高三4月阶段性测试化学试题河南省开封市铁路中学2020-2021学年高二下学期期中考试化学试题(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第36讲 原子结构与性质(精练)-2022年一轮复习讲练测(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题04 物质结构与元素周期律—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)2020年天津卷化学高考真题变式题1-12湖北省沙市中学2021-2022学年高二上学期期末考试化学试题广东省云浮市云安区云安中学2021-2022学年高二下学期第一次统测化学试题(已下线)考点07 元素周期律和元素周期表-备战2023年高考化学一轮复习考点帮(全国通用)专题1~2 综合检测(提升卷)(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第29讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第29讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京市第八十中学2022-2023学年高三上学期期末测试化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型80 用表格承载信息考查元素周期律(已下线)第五章 物质结构与性质元素周期律 第27练 元素周期表和元素周期律北京市第八十中学2023届高三下学期二模适应考试化学试题(已下线)专题07 元素周期表与元素周期律(已下线)第2讲 元素素周期表 元素周期律天津市耀华中学2023-2024学年度高三上学期开学检测化学试题天津市红桥区2023-2024学年高三上学期期中考试化学试题河北省保定市唐县第一中学2023-2024学年高二上学期12月期中考试化学试题河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题北京师范大学附属实验中学2023-2024学年高二下学期开学检测化学试题云南省保山市腾冲市第八中学2024届高三上学期期末模拟考试化学试卷广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题北京市第十四中学2023-2024学年高三下学期三模化学试题
名校
解题方法
3 . 如图为周期表的一小部分,A、B、C、D、E的位置关系如图所示。其中B元素最高化合价是最低化合价绝对值的3倍,它的最高价氧化物中含氧60%。下列说法正确的是( )
| A | ||
| D | B | E |
| C |
| A.D、B、E三种元素的第一电离能逐渐减小 |
| B.电负性:E>C |
| C.D、B、E三种元素形成的简单离子的半径逐渐增大 |
| D.气态氢化物的稳定性顺序:D>B>E |
您最近一年使用:0次
2020-06-09更新
|
342次组卷
|
9卷引用:福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题
福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 B素养拓展区四川省西充中学 2021-2022 学年高二上学期期中考试化学试题专题2 原子结构与元素性质 第二单元 元素性质的递变规律 第2课时 元素第一电离能和电负性的周期性变化天津市耀华中学2022-2023学年高二上学期期末考试化学试题2.2.2元素第一电离能和电负性的周期性变化 课后湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题
名校
4 . 下列说法正确的是( )
| A.原子半径:P<S<Cl |
| B.电负性:C<N<O |
| C.热稳定性:HF<HCl<HBr |
| D.第一电离能:Na<Mg<Al |
您最近一年使用:0次
2020-05-19更新
|
413次组卷
|
6卷引用:福建省莆田第七中学2020-2021学年高二下学期期中考试化学(A卷)试题
名校
解题方法
5 . 我国科研人员发现了一种新型超导体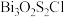 ,由
,由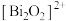 和
和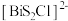 交替堆叠构成。已知
交替堆叠构成。已知 位于第六周期VA族,下列有关说法错误的是
位于第六周期VA族,下列有关说法错误的是
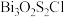 ,由
,由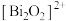 和
和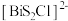 交替堆叠构成。已知
交替堆叠构成。已知 位于第六周期VA族,下列有关说法错误的是
位于第六周期VA族,下列有关说法错误的是A. 的价电子排布式为 的价电子排布式为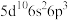 |
B.有关元素的电负性: |
C.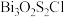 属于含共价键的离子化合物 属于含共价键的离子化合物 |
| D.该新型超导体的组成元素全部位于元素周期表p区 |
您最近一年使用:0次
2020-05-12更新
|
840次组卷
|
17卷引用:福建省泉州实验中学2021届高三3月测试(二)化学试题
福建省泉州实验中学2021届高三3月测试(二)化学试题山东省青岛市2020届高三4月统一质量检测(一模)化学试题山东省烟台市中英文学校2021届高三上学期期末考试化学试题(已下线)2021年高考化学押题预测卷(湖北卷)03(含考试版、答题卡、参考答案、全解全析)山东省潍坊第四中学2022届高三上学期第一次过程检测化学试题河北省石家庄市第二十三中学2021-2022学年高二下学期期中考试化学试题专题1~2 综合检测(提升卷)第二节综合拔高练山西省临汾市尧都区山西师范大学实验中学2021-2022学年高二下学期第一次月考化学考试试题山东省青岛市即墨区第一中学2022-2023学年高三上学期10月月考化学试题山东省济宁市育才中学2022-2023学年高二上学期第二次学情检测化学试题广东省深圳市盐田高级中学2021-2022学年高二下学期4月考试化学试题广东省潮阳一中、宝安中学等七校联考2022-2023学年高三上学期第二次(11月)联考化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五高级中学(前郭五中)2023-2024学年高三上学期第三次考试 化学试卷 河南省郑州市宇华实验学校2023-2024学年高三上学期1月期末化学试题新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高二下学期第一次月考化学试卷河南省郑州市宇华实验学校2023-2024学年高二下学期5月月考化学试题
名校
解题方法
6 . 下图为元素周期表的一部分:

I.(1)元素③的基态原子轨道表示式为_________________ 。
(2)元素③④⑤的第一电离能由大到小的顺序为___________ (填元素符号)。
(3)以下组合的原子间反应最容易形成离子键的是_____ (选填A、B、C、D,下同)。
A.②和⑤ B.和⑤ C.⑤和⑥ D.⑥和⑧
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式_________________________________ 。
II.(1)如图是部分元素原子的第一电离能I1随原子序数变化关系(其中12号至17号元素的有关数据缺失)。
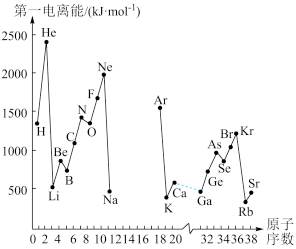
①根据同图示变化规律,可推测S的第一电离能的大小(最小)范围为___ < S <___ (填元素符号)
②图中第一电离能最小的元素在周期表中的位置____________________
(2)用In表示元素的第n电离能,则图中的a、b、c分别代表( )
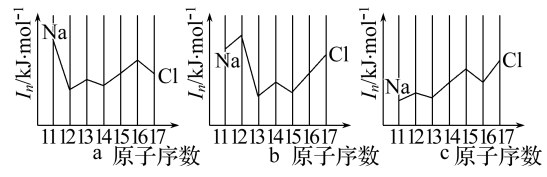
A.a为I1、b为I2、c为I3 B.a为I3、b为I2、c为I1
C.a为I2、b为I3、c为I1 D.a为I1、b为I3、c为I2
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________________________________________

I.(1)元素③的基态原子轨道表示式为
(2)元素③④⑤的第一电离能由大到小的顺序为
(3)以下组合的原子间反应最容易形成离子键的是
A.②和⑤ B.和⑤ C.⑤和⑥ D.⑥和⑧
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式
II.(1)如图是部分元素原子的第一电离能I1随原子序数变化关系(其中12号至17号元素的有关数据缺失)。

①根据同图示变化规律,可推测S的第一电离能的大小(最小)范围为
②图中第一电离能最小的元素在周期表中的位置
(2)用In表示元素的第n电离能,则图中的a、b、c分别代表

A.a为I1、b为I2、c为I3 B.a为I3、b为I2、c为I1
C.a为I2、b为I3、c为I1 D.a为I1、b为I3、c为I2
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
| 电离能/kJ/mol | I1 | I2 |
| Cu | 746 | 1958 |
| Zn | 906 | 1733 |
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是
您最近一年使用:0次
2020-05-02更新
|
159次组卷
|
2卷引用:福建省福州一中2019-2020学年高二下学期第一次月考化学试题
名校
7 . 下列各组元素中,电负性依次减小的是
| A.O、Cl、H | B.K、Na、Al | C.As、P、H | D.O、S、Cl |
您最近一年使用:0次
2020-04-27更新
|
379次组卷
|
11卷引用:福建省福州市金山中学2020-2021学年高二下期中考试化学试题
福建省福州市金山中学2020-2021学年高二下期中考试化学试题2015-2016学年湖北省长阳一中高二第一学期第一次月考化学试卷2014-2015学年宁夏平罗中学高二上学期期中化学试卷河北省唐山市第十一中学2018-2019学年高二下学期期中考试化学试题海南省三亚华侨学校2019-2020学年高二上学期期中考试化学试题辽宁省丹东市2017-2018学年高二下学期期末质量监测化学试题新疆喀什地区巴楚县第一中学2020-2021学年高二上学期期中考试化学试题海南省海南鑫源高级中学2020-2021学年高二下学期第一次月考化学试题第二节 原子结构与元素的性质 第2课时 元素周期律——原子半径、电离能、电负性的递变规律1.3.2元素的电离能、电负性及其变化规律(课中)-鲁科版选择性必修21.2.2 元素周期律-课堂例题
名校
解题方法
8 . 铜是重要的贵重金属,其化合物在催化剂研究和光电材料等方面应用广泛。回答下列问题:
(1)在铜的配合物中,H2O、NH3、CO等常用作配体。
①基态Cu2+的价电子轨道表示式为_________ 。
②H、C、N、O元素中,元素的第一电离能最高的为_____ ,元素电负性由大到小的顺序为________ 。
③水溶液中有H3O+、H5O2+、H9O4+等微粒的形式。H3O+中O的杂化轨道类型为_____ ,其H-O-H键角_______ (填“>”或“<”)H2O中H-O-H的键角。H5O2+内部存在氢键,H5O2+的结构式可表示为__________ 。
④Cu2Cl2·2CO·2H2O是一种配合物,其结构如图所示: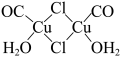 ,其中每个Cu原子能与其他原子形成
,其中每个Cu原子能与其他原子形成_________ 个配位键。
(2)CuCl结构属于立方晶系,其晶胞如图所示:
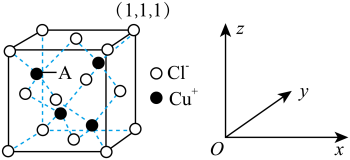
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。则A原子分数坐标为_________ 。
②晶胞中距离每个Cu+最近的Cl-的个数为_______ ,若晶胞的棱长为a pm,晶体的密度为ρ g·cm-3,计算阿伏加 德罗常数NA=________ (列式表示)。
(1)在铜的配合物中,H2O、NH3、CO等常用作配体。
①基态Cu2+的价电子轨道表示式为
②H、C、N、O元素中,元素的第一电离能最高的为
③水溶液中有H3O+、H5O2+、H9O4+等微粒的形式。H3O+中O的杂化轨道类型为
④Cu2Cl2·2CO·2H2O是一种配合物,其结构如图所示:
 ,其中每个Cu原子能与其他原子形成
,其中每个Cu原子能与其他原子形成(2)CuCl结构属于立方晶系,其晶胞如图所示:

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。则A原子分数坐标为
②晶胞中距离每个Cu+最近的Cl-的个数为
您最近一年使用:0次
2020-04-01更新
|
152次组卷
|
2卷引用:福建省连城县第一中学2021届高三上学期第二次月考化学试题
名校
解题方法
9 . 氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1)。
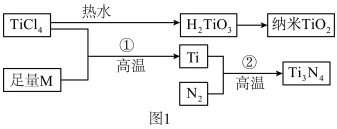
图中的M是短周期金属元素,M的部分电离能如表:
请回答下列问题:
(1)Ti的基态原子外围电子排布式为________________ 。
(2)M是________ (填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为____ 。
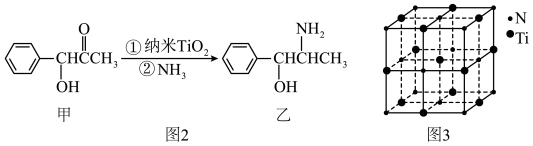
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中采取sp2方式杂化的碳原子有________ 个,化合物乙中采取sp3方式杂化的原子3对应的元素的电负性由大到小的顺序为________________ 。
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为________________ g/cm3 (NA为阿伏加 德罗常数的值,只列计算式)。该晶体中与氮原子距离相等且最近的氮原子有________ 个。
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据:
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为__________________ 。

图中的M是短周期金属元素,M的部分电离能如表:
I1 | I2 | I3 | I4 | I5 | |
| 电离能/(kJ/mol) | 738 | 1451 | 7733 | 10540 | 13630 |
请回答下列问题:
(1)Ti的基态原子外围电子排布式为
(2)M是
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中采取sp2方式杂化的碳原子有

(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ/mol) | 786 | 715 | 3401 |
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为
您最近一年使用:0次
2020-03-30更新
|
297次组卷
|
7卷引用:2016届福建省漳州八校高三下学期第三次联考理科综合化学试卷
10 . 已知 元素原子的价电子排布式为
元素原子的价电子排布式为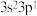 ,
, 元素位于周期表中第三周期,其原子最外层
元素位于周期表中第三周期,其原子最外层 轨道为半充满状态,下列叙述错误的是( )
轨道为半充满状态,下列叙述错误的是( )
 元素原子的价电子排布式为
元素原子的价电子排布式为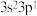 ,
, 元素位于周期表中第三周期,其原子最外层
元素位于周期表中第三周期,其原子最外层 轨道为半充满状态,下列叙述错误的是( )
轨道为半充满状态,下列叙述错误的是( )A. 为金属元素, 为金属元素, 为非金属元素 为非金属元素 |
B. 与 与 为同周期元素 为同周期元素 |
C. 的电负性大于 的电负性大于 |
D. 的第一电离能大于 的第一电离能大于 |
您最近一年使用:0次
2020-03-04更新
|
239次组卷
|
10卷引用:福建省三明市宁化第六中学2021-2022学年高二下学期第一次月考化学试题
福建省三明市宁化第六中学2021-2022学年高二下学期第一次月考化学试题人教化学选修3第一章第二节课时4第3节 原子结构与元素性质——A学习区 夯实基础(鲁科版选修3)山东省临朐县实验中学2020-2021学年高二上学期12月月结学情检测化学试题新疆乌苏市第一中学2020-2021学年高二3月月考化学(4-21班)试题广东省汕尾市2021-2022学年高二上学期期末考试化学试题海南省儋州川绵中学2021-2022学年高二下学期第一次月考化学试题新疆克拉玛依市高级中学2021-2022学年高二下学期期末考试化学试题广东省揭阳市惠来县第一中学2021-2022学年高二下学期第一次阶段考试化学试题 新疆生产建设兵团第二师八一中学2022-2023学年高二下学期期中考试化学试题



