1 . 第ⅣA族元素及其化合物在生产、生活中应用广泛。回答下列问题:
(1)基态锗原子的价层电子轨道表示式为______ ,第ⅣA族元素位于______ 区。
(2) 的电负性比
的电负性比 大,其主要原因是
大,其主要原因是_________________ 。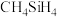 、
、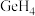 的稳定性依次减弱,其主要原因是
的稳定性依次减弱,其主要原因是______________________ 。
(3) 的VSEPR模型名称为
的VSEPR模型名称为________________________________ 。
(4)碳化硅( )熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为
)熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为______ 。
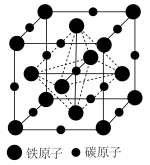
(5)铁和碳能形成如图所示的晶胞。它可以看成是铁晶胞中插入若干个碳原子,晶胞体积不变。铁碳晶体的化学式为______ ,铁晶体转化为铁碳晶体时晶体密度净增______ %(结果保留3位有效数字)。
(1)基态锗原子的价层电子轨道表示式为
(2)
 的电负性比
的电负性比 大,其主要原因是
大,其主要原因是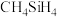 、
、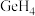 的稳定性依次减弱,其主要原因是
的稳定性依次减弱,其主要原因是(3)
 的VSEPR模型名称为
的VSEPR模型名称为(4)碳化硅(
 )熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为
)熔点为2700°C,常作砂轮磨料,用于切割金属。由此推知,碳化硅晶体类型为(5)铁和碳能形成如图所示的晶胞。它可以看成是铁晶胞中插入若干个碳原子,晶胞体积不变。铁碳晶体的化学式为
您最近一年使用:0次
名校
2 . 用化学知识解答问题:
(1)铜器在潮湿的空气中,表面会慢慢地生成一层铜锈(碱式碳酸铜),该反应的化学方程式为___________ 。
(2)在日常生活中常用一些铝制器皿,在清洗铝制器皿表面的污垢时,不能使用热的碱性溶液的原因时(用化学方程式解释)___________ 。
(3)发射卫星的火箭用联氨( )作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为
)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为___________ 。
(4)比较甲酸、乙酸、丙酸的酸性大小,并解释原因___________
(5)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
比较两元素的 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,对此你的解释是
再失去1个电子难,对此你的解释是___________ 。
(1)铜器在潮湿的空气中,表面会慢慢地生成一层铜锈(碱式碳酸铜),该反应的化学方程式为
(2)在日常生活中常用一些铝制器皿,在清洗铝制器皿表面的污垢时,不能使用热的碱性溶液的原因时(用化学方程式解释)
(3)发射卫星的火箭用联氨(
 )作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为
)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,该反应的化学方程式为(4)比较甲酸、乙酸、丙酸的酸性大小,并解释原因
(5)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
| 元素 | Mn | Fe | |
电离能/ |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,对此你的解释是
再失去1个电子难,对此你的解释是
您最近一年使用:0次
2023-08-19更新
|
126次组卷
|
2卷引用:河北省昌黎第一中学2023届高三下学期第五次调研考试化学试题
名校
解题方法
3 . W、X、Y、Z、M是原子序数依次增大的前四周期元素,其元素性质或结构如下:
回答下列问题:
(1)写出X元素的名称_______ 。
(2)写出M元素+2价离子的价电子轨道表示式_______ 。
(3)基态Z元素原子核外电子占据的最高能层包含的原子轨道数为_______ 。
(4)W、X、Z可形成强还原性物质 ,W、X、Z三种元素电负性由大到小的顺序是
,W、X、Z三种元素电负性由大到小的顺序是_______ (用元素符号表示)。
(5)大π键可用符号 表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大
表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大 键写作
键写作 ,石墨中的大π键写作
,石墨中的大π键写作 (见下图a),
(见下图a), 被称为“无机苯”,结构与苯类似,写出
被称为“无机苯”,结构与苯类似,写出 的大π键
的大π键_______ ,某化合物XY的结构(见下图b)中也存在 的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因
的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因_______ 。

| 元素 | 元素性质或原子结构 |
| W | 电子只有一种自旋取向 |
| X | 核外只有一个未成对电子,且电子有三种空间运动状态 |
| Y | s轨道电子数比p轨道多一个,且第一电离能大于同周期相邻元素 |
| Z | 电负性是短周期中最小的 |
| M | +3价基态离子最高能级处于半满状态 |
(1)写出X元素的名称
(2)写出M元素+2价离子的价电子轨道表示式
(3)基态Z元素原子核外电子占据的最高能层包含的原子轨道数为
(4)W、X、Z可形成强还原性物质
 ,W、X、Z三种元素电负性由大到小的顺序是
,W、X、Z三种元素电负性由大到小的顺序是(5)大π键可用符号
 表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大
表示,m为参与形成大π键的原子数目,n为平行p轨道里的电子数,如苯分子的大 键写作
键写作 ,石墨中的大π键写作
,石墨中的大π键写作 (见下图a),
(见下图a), 被称为“无机苯”,结构与苯类似,写出
被称为“无机苯”,结构与苯类似,写出 的大π键
的大π键 的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因
的大π键,但石墨是电的良导体,XY却具有优异的电绝缘性,从电负性角度分析化合物XY不导电的可能原因
您最近一年使用:0次
2023-02-23更新
|
641次组卷
|
2卷引用:2024届山东省潍坊市昌乐二中高三模拟预测化学试题
22-23高三上·江苏连云港·期中
4 . 转化 的方法主要有电催化、热还原等。
的方法主要有电催化、热还原等。
(1) 电催化制CO。在电解过程中向电解质中加入离子导体(
电催化制CO。在电解过程中向电解质中加入离子导体( )可以提高CO的选择性(CO是指
)可以提高CO的选择性(CO是指 转化生成CO的百分比,下同)。
转化生成CO的百分比,下同)。
①离子导体M中含有H、B、C、N、F等元素,其中B、C、N、F四种元素的第一电离能由小到大的顺序为_______ 。 的空间构型是
的空间构型是_______ 。
②电催化还原 制CO的示意图如下图所示。请在虚线框中画出还有可能得到的中间体的结构示意图
制CO的示意图如下图所示。请在虚线框中画出还有可能得到的中间体的结构示意图_______ 。
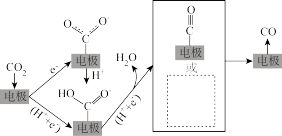
(2) 热还原制
热还原制 和CO。在常压、
和CO。在常压、 催化下,
催化下, 和
和 混和气体(体积比1:4)进行反应,测得
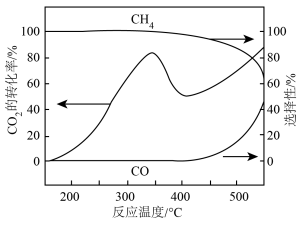
混和气体(体积比1:4)进行反应,测得 转化率、
转化率、 和CO的选择性随温度变化如图所示。
和CO的选择性随温度变化如图所示。
反应I:

反应II:

①400℃后,随温度升高 转化率不断上升的原因是
转化率不断上升的原因是_______ 。
②反应II中 和
和 在
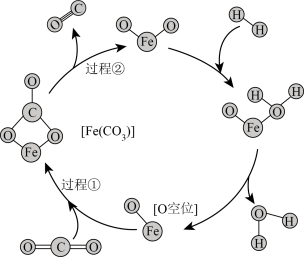
在 (存在O空位)催化剂的作用下,可以提高CO的选择性,反应机理如图所示。从电负性的角度,过程①和②能发生的原因是
(存在O空位)催化剂的作用下,可以提高CO的选择性,反应机理如图所示。从电负性的角度,过程①和②能发生的原因是_______ 。
 的方法主要有电催化、热还原等。
的方法主要有电催化、热还原等。(1)
 电催化制CO。在电解过程中向电解质中加入离子导体(
电催化制CO。在电解过程中向电解质中加入离子导体( )可以提高CO的选择性(CO是指
)可以提高CO的选择性(CO是指 转化生成CO的百分比,下同)。
转化生成CO的百分比,下同)。①离子导体M中含有H、B、C、N、F等元素,其中B、C、N、F四种元素的第一电离能由小到大的顺序为
 的空间构型是
的空间构型是②电催化还原
 制CO的示意图如下图所示。请在虚线框中画出还有可能得到的中间体的结构示意图
制CO的示意图如下图所示。请在虚线框中画出还有可能得到的中间体的结构示意图
(2)
 热还原制
热还原制 和CO。在常压、
和CO。在常压、 催化下,
催化下, 和
和 混和气体(体积比1:4)进行反应,测得
混和气体(体积比1:4)进行反应,测得 转化率、
转化率、 和CO的选择性随温度变化如图所示。
和CO的选择性随温度变化如图所示。
反应I:


反应II:


①400℃后,随温度升高
 转化率不断上升的原因是
转化率不断上升的原因是②反应II中
 和
和 在
在 (存在O空位)催化剂的作用下,可以提高CO的选择性,反应机理如图所示。从电负性的角度,过程①和②能发生的原因是
(存在O空位)催化剂的作用下,可以提高CO的选择性,反应机理如图所示。从电负性的角度,过程①和②能发生的原因是
您最近一年使用:0次
名校
解题方法
5 . 材料的发展水平始终是时代进步和人类文明的标志。当前含铁的磁性材料在国防、电子信息等领域中具有广泛应用。请回答下列问题:
(1)基态铁原子的价电子排布图为_______ ,基态铁原子核外电子的空间运动状态有_______ 种, 其处在最高能层的电子的电子云形状为_______ 。
(2)一种新研发出的铁磁性材料M的分子结构如图1所示。
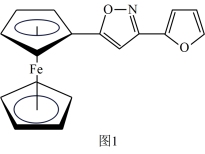
①M分子中C、N、O三种元素的电负性由大到小的顺序为_______ 。
②M分子中的Fe2+与上下两个五元碳环通过配位键相连且Fe2+共提供了6个杂化轨道,则铁原子最可能的杂化方式为_______ (填序号)。
A. sp2 B. sp3 C. dsp2 D.d2sp3
③分子中的大π键可用符号π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ), 则M分子中由碳、氧组成的五元环中的大π键应表示为
), 则M分子中由碳、氧组成的五元环中的大π键应表示为_______ 。
(3)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物的立方晶胞结构如图2所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为_______ 。
②该化合物的化学式为_______ ,若晶胞中距离最近的铁原子和氮原子的距离为apm,阿伏加德罗常数的值为NA,则该晶胞的密度为_______ g·cm-3 (列出计算式即可)。
(1)基态铁原子的价电子排布图为
(2)一种新研发出的铁磁性材料M的分子结构如图1所示。

①M分子中C、N、O三种元素的电负性由大到小的顺序为
②M分子中的Fe2+与上下两个五元碳环通过配位键相连且Fe2+共提供了6个杂化轨道,则铁原子最可能的杂化方式为
A. sp2 B. sp3 C. dsp2 D.d2sp3
③分子中的大π键可用符号π
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ), 则M分子中由碳、氧组成的五元环中的大π键应表示为
), 则M分子中由碳、氧组成的五元环中的大π键应表示为(3)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物的立方晶胞结构如图2所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为
②该化合物的化学式为
您最近一年使用:0次
2022-05-31更新
|
918次组卷
|
5卷引用:内蒙古自治区赤峰市2022届高三下学期4月模拟考试理综合化学试题
内蒙古自治区赤峰市2022届高三下学期4月模拟考试理综合化学试题(已下线)易错点13 原子结构与核外电子排布-备战2023年高考化学考试易错题(已下线)第十二章 物质结构与性质(测)-2023年高考化学一轮复习讲练测(全国通用)河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题湖北省武汉市武钢三中2023-2024学年高二下学期3月月考化学试题
6 . 三草酸合铁酸钾 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解:
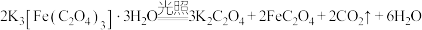 。回答下列问题:
。回答下列问题:
(1)基态 原子的电子排布式为
原子的电子排布式为___________ ,基态 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为___________ 。
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是___________ (填元素符号,下同),电负性最大的是___________ 。
(3)1个 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为___________ , 分子的立体构型为
分子的立体构型为___________ 。
(4)金刚石的晶胞结构如图所示,碳原子分别位于顶点、面心和体内。

若图中原子1的坐标为 ,则原子2的坐标为
,则原子2的坐标为___________ 。
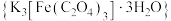 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解: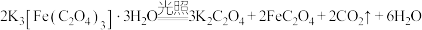 。回答下列问题:
。回答下列问题:(1)基态
 原子的电子排布式为
原子的电子排布式为 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为(2)三草酸合铁酸钾所含元素中,第一电离能最大的是
(3)1个
 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为 分子的立体构型为
分子的立体构型为(4)金刚石的晶胞结构如图所示,碳原子分别位于顶点、面心和体内。

若图中原子1的坐标为
 ,则原子2的坐标为
,则原子2的坐标为
您最近一年使用:0次
2022-05-09更新
|
515次组卷
|
3卷引用:福建省莆田市2022届高三下学期第三次质量检测化学试题
福建省莆田市2022届高三下学期第三次质量检测化学试题山西省怀仁市大地中学高中部2021-2022学年高二下学期第三次月考化学试题(已下线)第十二章 物质结构与性质(测)-2023年高考化学一轮复习讲练测(全国通用)
7 . 螯合树脂吸附法处理废水具有吸附容量大、速度快以及选择性好等特点,已成为近年来的研究热点。螯合树脂M与Cu2+形成新的螯合物Q,从而达到去除Cu2+的效果,吸附机理如图所示。
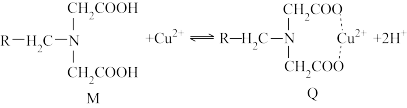
资料:
①吸附原理
螯合树脂M中的—COOH解离出H+,变成—COO-,而且树脂中含有N原子,在与Cu2+接触时,树脂中的—COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
(1)M中四种元素电负性由大到小的顺序为(用元素符号表示)____ 。
(2)M中N原子的杂化轨道类型为____ 。
(3)Q中存在配位键,其中提供空轨道的是____ 。
(4)在螯合树脂M处理含铜废水过程中,发现体系pH对Cu2+的吸附量有影响,实验结果如图所示。

①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为____ 时吸附效果最好。
②解释体系碱性过强时,吸附能力下降的原因____ 。
③从结构角度解释:体系酸性较强时,吸附能力下降的原因____ 。
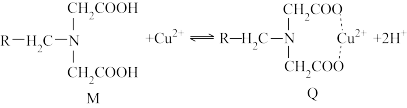
资料:
①吸附原理
螯合树脂M中的—COOH解离出H+,变成—COO-,而且树脂中含有N原子,在与Cu2+接触时,树脂中的—COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
(1)M中四种元素电负性由大到小的顺序为(用元素符号表示)
(2)M中N原子的杂化轨道类型为
(3)Q中存在配位键,其中提供空轨道的是
(4)在螯合树脂M处理含铜废水过程中,发现体系pH对Cu2+的吸附量有影响,实验结果如图所示。

①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为
②解释体系碱性过强时,吸附能力下降的原因
③从结构角度解释:体系酸性较强时,吸附能力下降的原因
您最近一年使用:0次
名校
8 . 近日,我国研究人员利用硫氰酸甲基铵{[CH3NH3]+[SCN]-}气相辅助生长技术,成功制得稳定的钙钛矿型甲脒铅碘(FAPbI3)。请回答下列问题:
(1)基态S原子的价电子排布图为___________ 。
(2)甲脒(FA)的结构简式为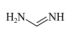
①其组成元素的电负性由小到大的排序为___________ ,其中碳原子的杂化方式为___________ 。
②甲脒比丙烷的熔点更高的原因是___________ 。
(3)FAPbI3的晶体结构单元如图所示,图中Y表示Pb,位于八面体中心,则甲脒的碘配位数为___________ 。
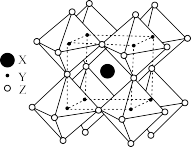
(1)基态S原子的价电子排布图为
(2)甲脒(FA)的结构简式为

①其组成元素的电负性由小到大的排序为
②甲脒比丙烷的熔点更高的原因是
(3)FAPbI3的晶体结构单元如图所示,图中Y表示Pb,位于八面体中心,则甲脒的碘配位数为

您最近一年使用:0次
2021-10-13更新
|
585次组卷
|
5卷引用:天津市五校2023届高三一模联考化学试题
天津市五校2023届高三一模联考化学试题福建省宁化第一中学2021-2022学年高三上学期第二次阶段考试化学试题天津市西青区杨柳青第一中学2021--2022 学年高三上学期第一次阶段检测化学试题(已下线)第19讲元素周期律与元素周期表(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
解题方法
9 . 光刻技术需要利用深紫激光,我国是唯一掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟代硼铍酸钾晶体 KBBF(KBe2BO3F2),实验室可用 BeO、KBF4和 B2O3 在 700℃左右灼烧获得氟代硼铍酸钾晶体(晶胞如下图所示,其中 K 原子已经给出,氧原子略去),并放出 BF3气体。回答下列问题:
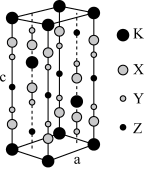
(1)基态钾原子的核外电子排布式为___________ ,能量最高的电子的电子云轮廓图形状为___________ 。
(2)BF3的空间构型为___________ ,与其互为等电子体的阴离子为___________ (填一种即可)。
(3)氟代硼铍酸钾晶体 KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为___________ 。
(4)KBF4中心 B 原子的杂化方式为___________ 杂化。
(5) 三卤化硼的性质如下:
BF3、BCl3、BBr3、BI3的沸点逐渐升高的原因是:___________ 。
(6)指出图中代表硼原子的字母为___________ ,该KBBF晶体的晶胞参数分别为a pm 和 c pm,α=β=γ=90°,则晶体密度为___________ g·cm-3(M 代表 KBBF 的摩尔质量,NA表示阿伏加德罗常数的值,列出计算式)。

(1)基态钾原子的核外电子排布式为
(2)BF3的空间构型为
(3)氟代硼铍酸钾晶体 KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为
(4)KBF4中心 B 原子的杂化方式为
(5) 三卤化硼的性质如下:
| BF3 | BCl3 | BBr3 | BI3 | |
| 熔点/℃ | -127. | | -107 | -46 | 49.9 |
| 沸点/℃ | -99 | 12.5 | 91.3 | 210. |
BF3、BCl3、BBr3、BI3的沸点逐渐升高的原因是:
(6)指出图中代表硼原子的字母为
您最近一年使用:0次
解题方法
10 . 硅铝合金广泛应用于航空、交通、建筑、汽车等行业。
完成下列填空:
(1)硅原子的结构示意图为___________ ;比较硅铝的原子半径:r(Si)___________ r(Al)(选填:“>”、“<”或“=”)。硅铝合金中的铝与氢氧化钠溶液反应的化学方程式为___________ 。
(2)氟化铝和氯化铝的熔点分别为1040 和194
和194 ,它们熔点差异大的原因可能是
,它们熔点差异大的原因可能是___________ 。
(3)门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为___________ ,推断的依据是___________ 。
(4)制备硅铝合金时,在高温真空炉中发生如下反应:
 ;
;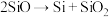 ;
;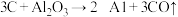
上述反应的最终还原产物为___________ ;当有1mol C参加反应时,转移的电子数目为___________ 。
完成下列填空:
(1)硅原子的结构示意图为
(2)氟化铝和氯化铝的熔点分别为1040
 和194
和194 ,它们熔点差异大的原因可能是
,它们熔点差异大的原因可能是(3)门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为
(4)制备硅铝合金时,在高温真空炉中发生如下反应:
 ;
;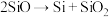 ;
;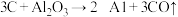
上述反应的最终还原产物为
您最近一年使用:0次
2021-04-20更新
|
410次组卷
|
3卷引用:上海市浦东新区2021届高三二模化学试题
上海市浦东新区2021届高三二模化学试题(已下线)第15讲 原子结构 化学键(练)-2023年高考化学一轮复习讲练测(全国通用)上海市奉贤区致远高级中学2021-2022学年高二上学期期末教学评估(等级考)化学试题



