名校
1 . Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是_____________________ ,M2+的核外电子排布式为________________________ 。
(2)M2Z的熔点比M2W的_________ (填“高”或“低”) ,请解释原因___________ 。
(3)N3-和YZ2是等电子体,则N3-的结构式为_________________ 。
(4)WZ2分子中W原子价层电子对数是_____________ 对,WZ2的VSEPR 模型名称为______________________ ,WZ3气态为单分子,该分子中W原子的杂化轨道类型为__________________ ;WZ3的三聚体环状结构如图1所示,该结构中W原子的杂化轨道类型为__________ ;该结构中W-Z键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为___________ (填图2中字母) ,该分子中含有___ 个σ键。
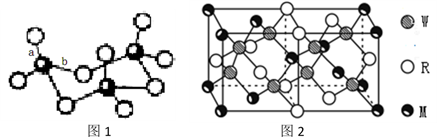
(5)MRW2的晶胞如图2所示,晶胞参数a=0.524nm、c=1.032nm;MRW2的晶胞中每个M原子与_______ 个W原子相连,晶体密度ρ=_______ g/cm3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA=6.02×1023mol-1)。
| 元素 | 相关信息 |
| Y | 原子核外有6个不同运动状态的电子 |
| Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
| W | 主族元素,与Z原子的价电子数相同 |
| R | 价层电子排布式为3d64s2 |
| M | IB族,其被称作“电器工业的主角” |
(1)Z、W元素相比,第一电离能较大的是
(2)M2Z的熔点比M2W的
(3)N3-和YZ2是等电子体,则N3-的结构式为
(4)WZ2分子中W原子价层电子对数是

(5)MRW2的晶胞如图2所示,晶胞参数a=0.524nm、c=1.032nm;MRW2的晶胞中每个M原子与
您最近一年使用:0次
2 . 工业上常利用铜萃取剂,使溶液中的Cu2+富集进入有机相,再经过进一步的反萃取实现金属铜的沉积、再生,铜萃取剂富集Cu2+的原理如下:
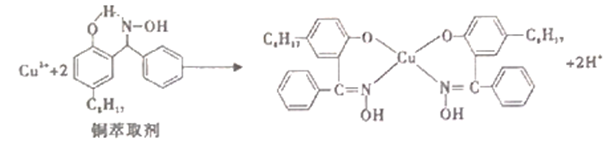
(1)基态铜原子所失去的第一个电子所占据的能层符号是______ , 价铜离 子的简化电子排布式为_________ 。
(2)铜萃取剂中所含 元素的电负性由大到小顺序为______ ,N原子以_____ 杂化轨道与O原子形成σ键。
(3)铜萃取剂与 Cu2+形成的配合物在水相的溶解度______ 有机相的溶解度(填“>”、“<”、“=”),该配合物晶体类型为_____ 。
(4)某学生用硫酸铜溶液与氨水做了一组实 验:CuSO4溶液 蓝色沉淀
蓝色沉淀 沉淀溶解。写出蓝色沉淀溶于氨水的离子方程式
沉淀溶解。写出蓝色沉淀溶于氨水的离子方程式_________ ;沉淀溶解后溶液中的阳离子内存在的化学键类型有________ 。
(5)铜的一种氯化物的晶胞如图所示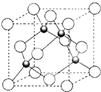 ,该氯化物的化学式
,该氯化物的化学式_____ ,Cu 和Cl之间最短距离为460.0pm,则晶体密度为______ g/cm3。(列式表示)

(1)基态铜原子所失去的第一个电子所占据的能层符号是
(2)铜萃取剂中所含 元素的电负性由大到小顺序为
(3)铜萃取剂与 Cu2+形成的配合物在水相的溶解度
(4)某学生用硫酸铜溶液与氨水做了一组实 验:CuSO4溶液
 蓝色沉淀
蓝色沉淀 沉淀溶解。写出蓝色沉淀溶于氨水的离子方程式
沉淀溶解。写出蓝色沉淀溶于氨水的离子方程式(5)铜的一种氯化物的晶胞如图所示
 ,该氯化物的化学式
,该氯化物的化学式
您最近一年使用:0次
名校
3 . 锰及其化合物用途非常广泛。回答下列问题:
(1)Al70Pd21Mn9是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法是___________ 。
(2)基态Mn原子的价电子排布式为_________ ,未成对电子数为_____ 个。
(3)MnS熔点(1610℃)比MnO熔点(1650℃)低,其原因是____________ 。
(4)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为________ 。
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是_____ ,该分子中碳原子的杂化方式为_______ ;C、H、N的电负性从大到小的顺序为________ 。
(5)锰的含氧酸有HMnO4(高锰酸)、H2MnO3(亚锰酸),高锰酸的酸性比亚锰酸强,理由是_________ 。
(6)某种含锰特殊材料的晶胞结构如下图所示:
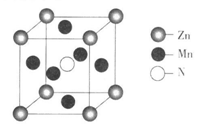
若晶胞参数为a nm,用NA表示阿伏伽德罗常数的值,则该晶胞的密度为____ ( 列出代数式即可)。
(1)Al70Pd21Mn9是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法是
(2)基态Mn原子的价电子排布式为
(3)MnS熔点(1610℃)比MnO熔点(1650℃)低,其原因是
(4)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是
(5)锰的含氧酸有HMnO4(高锰酸)、H2MnO3(亚锰酸),高锰酸的酸性比亚锰酸强,理由是
(6)某种含锰特殊材料的晶胞结构如下图所示:

若晶胞参数为a nm,用NA表示阿伏伽德罗常数的值,则该晶胞的密度为
您最近一年使用:0次
2018-05-17更新
|
388次组卷
|
2卷引用:【全国市级联考】河南省安阳市2018届高三第三次模拟考试理综化学试题
4 . 我国考古人员在秦陵挖掘的宝剑,到现们还是锋利无比,原因是剑锋上面覆盖了一层铬。
(1)写出Cr的外围电子排布式_______ 。与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是__________ 。
(2)根据下表Cr原子的能级电离能(I:k]/mol)数据,解释原子逐级电离能增大的原因:_______ 。
(2)CrCl3·6H2O有三种水合异构体,蓝绿色的[Cr(H2O)5C1]Cl2·6H2O,绿色的[Cr(H2O)4C12]Cl·6H2O和紫色的______ ,其中Cr的配体水分子也可以被NH3置换,如[Cr(NH3)5Cl]2+,则NH3的VSEPR模型为_____ ,N的杂化方式为________ ,写出NH3的一种等电子体___________ 。
(4)CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是___________ 。
(5)Cr晶体的堆积模型是体心立方堆积。
①下列金属晶体也采取这种堆积模型的是__________
A.Na B.Po C.Mg D.Cu
②晶胞中Cr的配位数为_________
③已知Cr的相对原子质量为M,Cr的密度为ρg/cm3,阿伏伽德罗常数用NA表示,则Cr的原子半径是__ pm.(写出表达式即可)
(1)写出Cr的外围电子排布式
(2)根据下表Cr原子的能级电离能(I:k]/mol)数据,解释原子逐级电离能增大的原因:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 |
(4)CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是
(5)Cr晶体的堆积模型是体心立方堆积。
①下列金属晶体也采取这种堆积模型的是
A.Na B.Po C.Mg D.Cu
②晶胞中Cr的配位数为
③已知Cr的相对原子质量为M,Cr的密度为ρg/cm3,阿伏伽德罗常数用NA表示,则Cr的原子半径是
您最近一年使用:0次
5 . 物质的组成与结构决定了物质的性质与变化。请回答下列问题:
(1)C、H、N、O四种元素中电负性最大的是____ (填元素符号),写出Fe2+的最外层电子排布式____ 。
(2)根据等电子原理,写出CN-的电子式___ ,CNO-中心原子的杂化方式为 ________ 。
(3)MgO、CaO两种晶体的结构与NaCl晶体结构相似,则两种离子晶体的熔点由高到低顺序是___ (用化学式表示),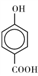 的沸点比
的沸点比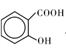
____ (填“高”或“低”);原因是______________________ .
(4)铁有δ、γ、α三种同素异形体,如下图所示。
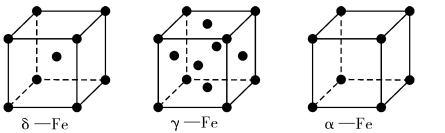
γ -Fe晶体的一个晶胞中所含有的铁原子数为____ ,δ一Fe、α- Fe两种晶胞中铁原子的配位数之比为____ 。已知δ-Fe晶体的密度为dg/cm3,NA表示阿伏伽德罗常数的数值,则Fe原子半径为____ pm(列表达式)。
(1)C、H、N、O四种元素中电负性最大的是
(2)根据等电子原理,写出CN-的电子式
(3)MgO、CaO两种晶体的结构与NaCl晶体结构相似,则两种离子晶体的熔点由高到低顺序是
 的沸点比
的沸点比
(4)铁有δ、γ、α三种同素异形体,如下图所示。

γ -Fe晶体的一个晶胞中所含有的铁原子数为
您最近一年使用:0次
6 . 某硅酸盐研究所在硅酸盐材料和闪烁晶体等领域研究上取得了重大的成就。
(1)[SiO4]4-是构成硅酸盐的基本结构单元,通过共用氧相连可形成硅氧组群。
①基态硅原子价电子的轨道表示式是_____________ 。
②与[SiO4]4-互为等电子体的微粒符号是_____________ 任写一种)。
③下图为一种硅氧组群的结构示意图,其离子符号为_____________ ,其中Si原子的杂化方式为_____________ 。
④电负性:Si______ O(填“>”、 “=”或“<” )。
(2)钨酸铅(PWO)是一种闪烁晶体,晶胞结构如图所示。
PWO中钨酸根结构式为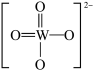 ,该离子中,σ键和π键的个数比是
,该离子中,σ键和π键的个数比是_____________ 。
②PWO晶体中含有的微粒间作用力是___________________
A.范德华力 B.离子键 C.共价键 D.金属键
③已知PWO的摩尔质量为Mg·mol-1,则该晶体的密度d=_____________ g·cm-3。
(1)[SiO4]4-是构成硅酸盐的基本结构单元,通过共用氧相连可形成硅氧组群。
①基态硅原子价电子的轨道表示式是
②与[SiO4]4-互为等电子体的微粒符号是
③下图为一种硅氧组群的结构示意图,其离子符号为

④电负性:Si
(2)钨酸铅(PWO)是一种闪烁晶体,晶胞结构如图所示。
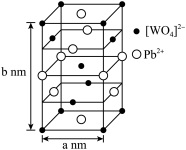
PWO中钨酸根结构式为
 ,该离子中,σ键和π键的个数比是
,该离子中,σ键和π键的个数比是②PWO晶体中含有的微粒间作用力是
A.范德华力 B.离子键 C.共价键 D.金属键
③已知PWO的摩尔质量为Mg·mol-1,则该晶体的密度d=
您最近一年使用:0次
2017-05-11更新
|
430次组卷
|
4卷引用:福建省宁德市2017届高三毕业班第二次质量检查理科综合化学试题
7 . 黑火药是我国古代的四大发明之一,距今已有1000多年的历史,其成分是木炭(C)、硫粉(S)和硝酸钾(KNO3)。回答下列有关问题:
(1)黑火药爆炸生成无毒的气体和K2S,该反应的化学方程式为________________ 。
(2)Se与S同主族,则Se原子的核外电子排布式为〔Ar〕________ ,有____ 对成对电子。
(3)C、N、O、K的电负性由大到小的顺序是_________________ 。
(4)黑火药爆炸除生成K2S外,还生成少量K2S2,其结构类似于Na2O2。则K2S2中含有的化学键类型为_______________ 。
(5)K2S遇酸生成H2S,H2S分子中,S原子的杂化轨道类型是_________ ;KNO3可电离出NO3-,NO3-的空间构型是______________ 。
(6)K2S的晶胞结构如图所示。其中K+的配位数为_______ ,若K2S晶体的密度为ρg·cm-3,则晶胞中距离最近的两个S2-核间距为_________ cm(用NA表示阿伏伽德罗常数的值)
(1)黑火药爆炸生成无毒的气体和K2S,该反应的化学方程式为
(2)Se与S同主族,则Se原子的核外电子排布式为〔Ar〕
(3)C、N、O、K的电负性由大到小的顺序是
(4)黑火药爆炸除生成K2S外,还生成少量K2S2,其结构类似于Na2O2。则K2S2中含有的化学键类型为
(5)K2S遇酸生成H2S,H2S分子中,S原子的杂化轨道类型是
(6)K2S的晶胞结构如图所示。其中K+的配位数为
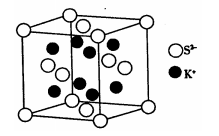
您最近一年使用:0次
名校
解题方法
8 . 新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____ ,该能层具有的原子轨道数为_____ .
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____ ,B原子的杂化轨道类型是_____ .
Li、B、H元素的电负性由大到小排列顺序为_____ .
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____ H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是_____ (填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____ ,NaH的理论密度是___________ g•cm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是
Li、B、H元素的电负性由大到小排列顺序为
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+
| I1/kJ•mol﹣1 | I2/kJ•mol﹣1 | I3/kJ•mol﹣1 | I4/kJ•mol﹣1 | I5/kJ•mol﹣1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
M是
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为
您最近一年使用:0次
2016-12-09更新
|
390次组卷
|
7卷引用:2016届山东省邹城一中高三下学期4月模拟考试理科综合化学试卷
9 . 物质结构与性质》从原子、分子水平上帮助我们认识物质构成的规律:以微粒之间不同的作用力为线索,研究不同类型物质的有关性质:从物质结构决定性质的视角预测物质的有关性质。
(1)下列说法正确的是_______ (填序号)。
A.元素电负性由大到小的顺序为O>N>C
B.一个乙烯分子含2个π键和4个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Al>Mg>Na
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为_______ ;光气(COCl2)各原子最外层都满 足8电子稳定结构,则光气分子的空间构型为_______ (用文字描述);
(3)Cu 2+基态的电子排布式为_______ ;向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,硫酸根离子中硫原子的杂化方式为_______ ;不考虑空间构型,其内界结构可用示意图表示为_______ 。
(1)下列说法正确的是

A.元素电负性由大到小的顺序为O>N>C
B.一个乙烯分子含2个π键和4个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Al>Mg>Na
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为
(3)Cu 2+基态的电子排布式为
您最近一年使用:0次
2013·河北邯郸·二模
10 . 冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为2Al(OH)3+12HF+3A =2Na3AlFs+3CO2+9H2O。
(1)熔融晶体A时痛要破坏的作用力是_______ ,冰晶石中的配位体是______ 。
(2)上述反应的生成物中属于非极性分子的中心原子的杂化轨道类型为________________ ,该分子的空间构型为___________ 。
(3)上述反应的反应物中有两种元素在元素周期表中的位置相邻,用化学方程式表示二者的电负性大小:____________ ;写出含有其中电负性较小元素的原子,且形成的分子的空间构型呈“V”形的物质的化学式(单质和化合物各写一种)_______________ 、________________ 。
(4)某种Al—Fe合金的晶胞如图所示,该合金的化学式为_________ 。若晶胞的边长为a nm,则合金的密度为______ g• cm-3。
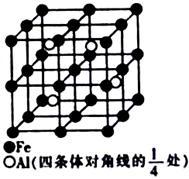
(1)熔融晶体A时痛要破坏的作用力是
(2)上述反应的生成物中属于非极性分子的中心原子的杂化轨道类型为
(3)上述反应的反应物中有两种元素在元素周期表中的位置相邻,用化学方程式表示二者的电负性大小:
(4)某种Al—Fe合金的晶胞如图所示,该合金的化学式为

您最近一年使用:0次



