解题方法
1 . 硅铝合金广泛应用于航空、交通、建筑、汽车等行业。
完成下列填空:
(1)硅原子的结构示意图为___________ ;比较硅铝的原子半径:r(Si)___________ r(Al)(选填:“>”、“<”或“=”)。硅铝合金中的铝与氢氧化钠溶液反应的化学方程式为___________ 。
(2)氟化铝和氯化铝的熔点分别为1040 和194
和194 ,它们熔点差异大的原因可能是
,它们熔点差异大的原因可能是___________ 。
(3)门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为___________ ,推断的依据是___________ 。
(4)制备硅铝合金时,在高温真空炉中发生如下反应:
 ;
;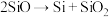 ;
;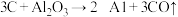
上述反应的最终还原产物为___________ ;当有1mol C参加反应时,转移的电子数目为___________ 。
完成下列填空:
(1)硅原子的结构示意图为
(2)氟化铝和氯化铝的熔点分别为1040
 和194
和194 ,它们熔点差异大的原因可能是
,它们熔点差异大的原因可能是(3)门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为
(4)制备硅铝合金时,在高温真空炉中发生如下反应:
 ;
;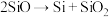 ;
;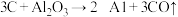
上述反应的最终还原产物为
您最近一年使用:0次
2021-04-20更新
|
416次组卷
|
3卷引用:上海市浦东新区2021届高三二模化学试题
上海市浦东新区2021届高三二模化学试题(已下线)第15讲 原子结构 化学键(练)-2023年高考化学一轮复习讲练测(全国通用)上海市奉贤区致远高级中学2021-2022学年高二上学期期末教学评估(等级考)化学试题
2 . 研究K、Ca、Fe、As、T等第四周期元素对生产、生活有重要意义。回答下列问题:
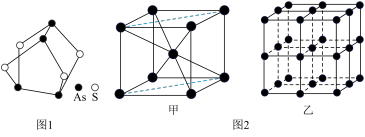
(1)我国中医把雄黄作为解毒剂,用来治疗癣疥、中风等。雄黄的结构如图1.雄黄分子中孤电子对数与成键电子对数之比为___ ,砷酸常用于制备颜料、砷酸盐、杀虫剂等,则AsO 的空间构型是
的空间构型是___ 。
(2)已知KCl、MgO、CaO、TiN的晶体于NaCl的晶体结构相似,且三种离子晶体的晶格能数据如表所示。
①Ti3+的电子排布式为___ 。
②KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为___ ,原因是___ 。
(3)Fe的一种晶体结构如图2甲、乙所示,若按甲虚线方向切割乙,得到的截面图中正确的是___ 。(填字母标号)假设铁原子的半径是rcm,铁的相对原子质量为M,则该晶体的密度为___ g/cm3。(列式即可,设阿伏加 德罗常数的值为NA)


(1)我国中医把雄黄作为解毒剂,用来治疗癣疥、中风等。雄黄的结构如图1.雄黄分子中孤电子对数与成键电子对数之比为
 的空间构型是
的空间构型是(2)已知KCl、MgO、CaO、TiN的晶体于NaCl的晶体结构相似,且三种离子晶体的晶格能数据如表所示。
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
①Ti3+的电子排布式为
②KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为
(3)Fe的一种晶体结构如图2甲、乙所示,若按甲虚线方向切割乙,得到的截面图中正确的是

您最近一年使用:0次
名校
解题方法
3 . 黑磷是磷的一种稳定的同素异形体,黑磷具有正交晶系的晶体结构(图A),晶胞参数a=3.310A,b=4.380A,c=10.500A。黑磷烯是二维的单层黑磷(图B),黑磷烯与石墨烯结构相似,P的配位数为3。与石墨烯相比,黑磷烯具有半导体性质,更适合于制作电子器件。已知黑磷结构中只有一种等效的三配位P,所有P原子的成键环境一样,图A中编号为①的P原子的晶胞内坐标为(0.50,0.090,0.598)。请回答下列问题:
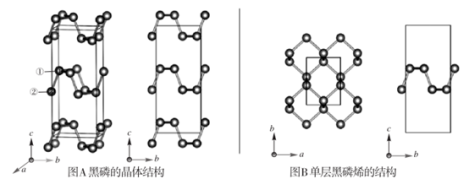
(1)写出P原子的价电子排布:___ 。
(2)P和F的电负性大小顺序是X(P)___ X(F)。(填“<”“=”或“>”)P和F形成的分子PF3和PF5,它们的几何构型分别为__ 、__ 。
(3)①黑磷中P原子杂化类型是__ 。黑磷中不存在__ (选填字母序号)。
A.共价键 B.σ键 C.π键 D.范德华力
②红磷、白磷与黑磷熔点从高到低的顺序为__ ,原因是__ 。
(4)图A中编号为②的P原子的晶胞内坐标为__ ,黑磷的晶胞中含有__ 个P原子。

(1)写出P原子的价电子排布:
(2)P和F的电负性大小顺序是X(P)
(3)①黑磷中P原子杂化类型是
A.共价键 B.σ键 C.π键 D.范德华力
②红磷、白磷与黑磷熔点从高到低的顺序为
(4)图A中编号为②的P原子的晶胞内坐标为
您最近一年使用:0次
2020-07-13更新
|
233次组卷
|
2卷引用:江西省吉安、抚州、赣州市2020届高三一模理科综合化学试题
4 . 铁及其化合物在生产、生活中有广泛应用。
(1)铁原子核外有__________ 种运动状态不同的电子,Fe3+基态核外电子排布式为_______________ 。
(2)实验室常用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中三种元素电负性由大到小的顺序为________ (用元素符号表示),CN-中σ键与π键的数目比n(σ)∶n(π)=__________ ;HCN中C原子轨道的杂化类型为__________ 。HCN的沸点为25.7℃,既远大于N2的沸点(-195.8℃)也大于HCl的沸点(-85℃)的原因是__________ 。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(Fe2Cl6)存在,该双聚分子的结构式为________ ,其中Fe的配位数为_____________ 。
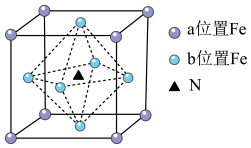
(4)铁氮化合物(Fe4N)在磁记录材料领域有着广泛的应用前景,其晶胞如上图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中b位置Fe原子的坐标为(0, ,
, )、(
)、( ,0,
,0, )和(
)和( ,
, ,0),则a位置Fe原子和N原子的坐标分别为
,0),则a位置Fe原子和N原子的坐标分别为__________ 、__________ 。N与Fe原子之间最短距离a pm。设阿伏加 德罗常数的值为NA,则该铁氮化合物的密度是__________ g·cm-3(列出计算表达式)。
(1)铁原子核外有
(2)实验室常用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中三种元素电负性由大到小的顺序为
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(Fe2Cl6)存在,该双聚分子的结构式为

(4)铁氮化合物(Fe4N)在磁记录材料领域有着广泛的应用前景,其晶胞如上图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中b位置Fe原子的坐标为(0,
 ,
, )、(
)、( ,0,
,0, )和(
)和( ,
, ,0),则a位置Fe原子和N原子的坐标分别为
,0),则a位置Fe原子和N原子的坐标分别为
您最近一年使用:0次
5 . 按要求作答
(1)钴位于元素周期表的第__ 族,其基态原子中未成对电子个数为__ 。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为__ ,所含非金属元素的电负性由大到小的顺序是__ 。
(3)尿素[CO(NH2)2]分子中σ键与π键的数目之比为__ 。
(4)硒、硅均能与氢气化合形成气态氢化物,若“Si-H”中共用电子对偏向氢,氢气与硒反应时,硒单质做氧化剂,则硒与硅的电负性大小为Se__ Si(填“>”或“<”)
(5)与Si同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表__ 。
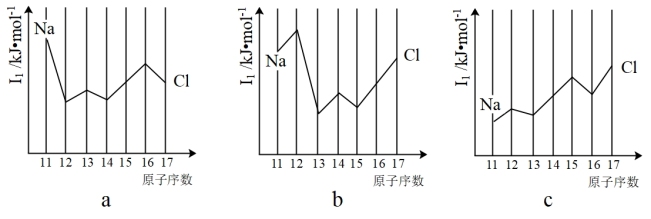
A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2
(1)钴位于元素周期表的第
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为
(3)尿素[CO(NH2)2]分子中σ键与π键的数目之比为
(4)硒、硅均能与氢气化合形成气态氢化物,若“Si-H”中共用电子对偏向氢,氢气与硒反应时,硒单质做氧化剂,则硒与硅的电负性大小为Se
(5)与Si同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表

A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2
您最近一年使用:0次
2020-01-10更新
|
883次组卷
|
4卷引用:化学预测卷(八)-预测卷(浙江专版)
名校
6 . 向硫酸铜水溶液中逐滴滴加氨水,先生成蓝色沉淀,继续滴加氨水得到深蓝色溶液,再向溶液中加入乙醇,有深蓝色晶体[Cu(NH3)4]SO4·H2O析出。
(1)铜元素位于元素周期表中____ 区,高温超导体钇钡铜氧材料中铜元素有+2和+3两种价态,基态Cu3+的电子排布式为____ 。
(2)非金属元素N、O、S的第一电离能由大到小的顺序是____ (用元素符号表示)。
(3)上述深蓝色晶体中含有的元素的电负性最小的是____ (用元素符号表示)。
(4)H2O的中心原子轨道杂化类型为____ 杂化;SO42-离子的立体构型是____ ,写出与SO42-互为等电子体的一种离子____ 。
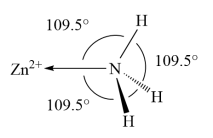
(5)NH3分子在独立存在时H-N-H键角为106.7°。如图为[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因____ 。
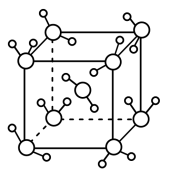
(6)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7 pm,阿伏加 德罗常数的值取6.02×1023,则重冰的密度为____ g.cm-3(只列式,不计算)。
(1)铜元素位于元素周期表中
(2)非金属元素N、O、S的第一电离能由大到小的顺序是
(3)上述深蓝色晶体中含有的元素的电负性最小的是
(4)H2O的中心原子轨道杂化类型为
(5)NH3分子在独立存在时H-N-H键角为106.7°。如图为[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因

(6)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。已知晶胞参数a=333.7 pm,阿伏加 德罗常数的值取6.02×1023,则重冰的密度为

您最近一年使用:0次
2019-11-13更新
|
289次组卷
|
3卷引用:2019年四川省遂宁市高三零诊考试理综化学试题
2010·山东枣庄·一模
7 . 研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题。
(1)C、Si、N元素的电负性由大到小的顺序是___________________________ 。C60和金刚石都是碳的同素异形体,金刚石熔点高于C60熔点,原因是__________________________________________________________________________ 。
(2)A、B均为短周期金属元素。依据下表数据和已学知识,
写出B原子的电子排布式:___________________________ 。
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O) 6]2+显粉红色。据此判断,[Mn(H2O) 6]]2+_______ (填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、络合物Fe(CO)5等。
①已知COCl2分子的结构式为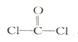 ,则 COCl2分子内含
,则 COCl2分子内含_______ (填标号)。
A.4个 键
键
B.2个 键、2个
键、2个 键
键
C.2个 键、1个
键、1个 键
键
D.3个 键、1个
键、1个 键
键
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是___________ 。
(1)C、Si、N元素的电负性由大到小的顺序是
(2)A、B均为短周期金属元素。依据下表数据和已学知识,
| 电离能/KJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
写出B原子的电子排布式:
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O) 6]2+显粉红色。据此判断,[Mn(H2O) 6]]2+
(4)利用CO可以合成化工原料COCl2、络合物Fe(CO)5等。
①已知COCl2分子的结构式为
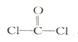 ,则 COCl2分子内含
,则 COCl2分子内含A.4个
 键
键B.2个
 键、2个
键、2个 键
键C.2个
 键、1个
键、1个 键
键D.3个
 键、1个
键、1个 键
键②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是
您最近一年使用:0次
解题方法
8 . (1)Fe基态原子核外电子排布式为_____________________ 。
(2)H、N、O的电负性从小到大的顺序是___________________ 。
(3)与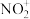 互为等电子体的一种分子为
互为等电子体的一种分子为______________ (填化学式)。
氨基(-NH2)中氮原子的杂化类型为_________________ 。
(4)1mol乙酸分子中含有σ键的数目为____________________ 。
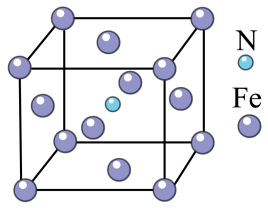
(5)Fe与N形成的某化合物晶胞如图所示,则该晶体的化学式为_______________ 。
(2)H、N、O的电负性从小到大的顺序是
(3)与
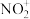 互为等电子体的一种分子为
互为等电子体的一种分子为氨基(-NH2)中氮原子的杂化类型为
(4)1mol乙酸分子中含有σ键的数目为
(5)Fe与N形成的某化合物晶胞如图所示,则该晶体的化学式为

您最近一年使用:0次
名校
解题方法
9 . 1911年,科学家发现汞在4.2K以下时电阻突然趋近于零——即低温超导性。1986年,科学家又发现了Nb3Ge在23K下具有超导性。1987年2月,赵忠贤及合作者独立发现了在液氮温区(沸点77 K)的高温超导体,其晶胞如图所示,元素组成为Ba-Y-Cu-O(临界温度93 K),推动了国际高温超导研究。赵忠贤院士获得2016年度国家最高科学技术奖。
回答下列问题:
(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,Nb位于_______ 族
(2)下列关于Ge元素叙述正确的是______ (从下列选项中选择)
A.Ge晶体属于准金属,且为共价晶体 B.Ge属于p区的过渡金属
C.Ge的第一电离能比As、Se均要小 D.Ge的电负性比C大
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是______________
(4)NH3也常作制冷剂,其键角_______ (填“大于”或“小于”)109°28′,NH3的沸点(239.6 K)高于N2沸点的主要原因是___________________________
(5)图示材料的理想化学式(无空位时)为___________________ ,若Y(钇)元素的化合价为+3,则Cu的平均化合价为_______

(6)金属铜属于面心立方最密堆积,其晶胞中Cu原子的最近距离为a cm,金属铜的晶体密度为ρ g/cm3,阿伏伽德罗常数为NA,则铜的相对原子质量为________ (只含一个系数,用a、ρ、NA表示)。
回答下列问题:
(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,Nb位于
(2)下列关于Ge元素叙述正确的是
A.Ge晶体属于准金属,且为共价晶体 B.Ge属于p区的过渡金属
C.Ge的第一电离能比As、Se均要小 D.Ge的电负性比C大
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是
(4)NH3也常作制冷剂,其键角
(5)图示材料的理想化学式(无空位时)为

(6)金属铜属于面心立方最密堆积,其晶胞中Cu原子的最近距离为a cm,金属铜的晶体密度为ρ g/cm3,阿伏伽德罗常数为NA,则铜的相对原子质量为
您最近一年使用:0次
10 . 硅、硼、铜、硒的单质及化合物在现代工业生产中有着广泛应用。回答下列问题:
(1)基态Cu+的核外价层电子排布式为_______________ ;Be、B、Al的第一电离能由大到小的顺序是______________________________ 。
(2)硒、硅均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se___ Si(填“>”、“<”)。
(3)SeO32-中Se原子的杂化类型为______ ,与其互为等电子体的一种分子的分子式是______________ 。
(4)CuSO4和Cu(NO3)2是自然界中重要的铜盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为_________ ,Cu(NO3)2中的化学键除了σ键外,还存在_______________ 。
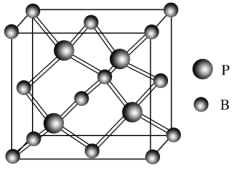
(5)磷化硼(BP)是一种耐磨材料,熔点高,其晶胞结构如图所示。该晶胞中B的堆积方式为___________ ,已知该晶体的晶胞参数a pm,用NA代表阿伏伽德罗常数的值,则该晶体的密度为____ g·cm-3;构成晶体的两种粒子之间的最近距离为__________ pm。
(1)基态Cu+的核外价层电子排布式为
(2)硒、硅均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se
(3)SeO32-中Se原子的杂化类型为
(4)CuSO4和Cu(NO3)2是自然界中重要的铜盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为
(5)磷化硼(BP)是一种耐磨材料,熔点高,其晶胞结构如图所示。该晶胞中B的堆积方式为

您最近一年使用:0次



