解题方法
1 . 化合物F是一种重要的有机合成中间体,某研究小组按下列路线进行合成:
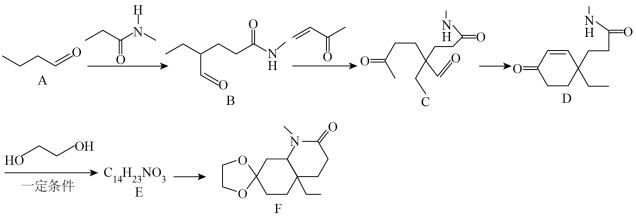
已知: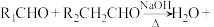
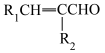
请回答下列问题:
(1)有机物B所含的官能团名称是___________ ,B→C的反应类型为___________ 。
(2)化合物E的结构简式是___________ 。
(3)写出D→E的化学方程式:___________ 。
(4)1分子有机物F分子中含有的手性碳原子数为___________ 。
(5)上述流程涉及的非金属元素中,电负性由大到小的顺序为___________ ,第一电离能最大的为___________ (填元素符号)。
(6)有机物H是D的同分异构体,写出符合下列条件的H的结构简式:___________ (任写一种)。
①IR谱检测表明:分子中含有一个苯环,有 键,无
键,无 、
、 键。
键。
② 谱检测表明:分子中共有5种不同化学环境的氢原子。
谱检测表明:分子中共有5种不同化学环境的氢原子。
③仅含有两种官能团,其中一种为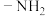 ,且氨基与苯环直接相连。
,且氨基与苯环直接相连。

已知:
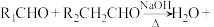
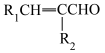
请回答下列问题:
(1)有机物B所含的官能团名称是
(2)化合物E的结构简式是
(3)写出D→E的化学方程式:
(4)1分子有机物F分子中含有的手性碳原子数为
(5)上述流程涉及的非金属元素中,电负性由大到小的顺序为
(6)有机物H是D的同分异构体,写出符合下列条件的H的结构简式:
①IR谱检测表明:分子中含有一个苯环,有
 键,无
键,无 、
、 键。
键。②
 谱检测表明:分子中共有5种不同化学环境的氢原子。
谱检测表明:分子中共有5种不同化学环境的氢原子。③仅含有两种官能团,其中一种为
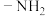 ,且氨基与苯环直接相连。
,且氨基与苯环直接相连。
您最近一年使用:0次
解题方法
2 . 我国化学家研究发现,十八胺在较高温度下具有一定的还原性,由于不同的金属盐从十八胺中获得电子的能力不同,在十八胺体系中反应可以得到不同的产物:当以两种非贵金属盐为原料时得到混合金属氧化物(如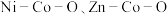 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如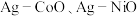 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如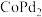 等)。
等)。
回答下列问题:
(1)十八胺中含有氮元素,含氮元素的三种离子 的键角由大到小的顺序是
的键角由大到小的顺序是___________ 。
(2) 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是___________ 。
(3)以 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物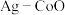 而非
而非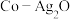 的原因是
的原因是___________ 。
(4)推测 盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为___________ 。
(5)一种含钴的离子结构如图所示: 的价电子轨道表示式是
的价电子轨道表示式是___________ 。已知磁矩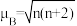 (n表示未成对电子数),则
(n表示未成对电子数),则 的磁矩
的磁矩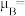
___________ 。
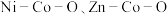 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如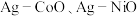 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如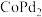 等)。
等)。
| 元素 |  |  |  |  |  |  |  |
| 电负性(鲍林标度) | 1.6 | 1.8 | 1.8 | 1.9 | 2.2 | 2.2 | 2.4 |
(1)十八胺中含有氮元素,含氮元素的三种离子
 的键角由大到小的顺序是
的键角由大到小的顺序是(2)
 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是(3)以
 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物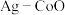 而非
而非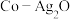 的原因是
的原因是(4)推测
 盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为(5)一种含钴的离子结构如图所示:
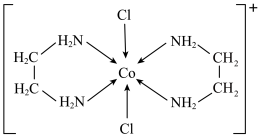
 的价电子轨道表示式是
的价电子轨道表示式是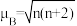 (n表示未成对电子数),则
(n表示未成对电子数),则 的磁矩
的磁矩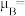
您最近一年使用:0次
名校
解题方法
3 . 我国是世界上最早制得和使用金属锌的国家,锌在人类生产生活中有重要应用。回答下列问题:
I. 一种 Zn2+配合物广泛应用于催化剂,光导体,光动力疗法,其结构如图所示:
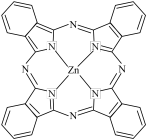
(1)Zn2+价电子轨道表示式为__________ 。
(2)该配合物中电负性最大的元素是__________ 。
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是__________。(填序号)
(4)该配合物中 C 的轨道杂化类型为__________ 。
(5)该配合物中 Zn2+的配位数为__________ 个。
Ⅱ. ZnS 常用作分析试剂、荧光体、白色颜料等。
(6)ZnS 常见有 2 种晶胞结构如下图:立方晶胞(左图)和六方晶胞(右图)。
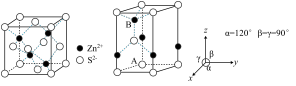
下列说法错误的是__________。(填序号)
(7)立方 ZnS 中,若 Zn2+与 S2-最短距离为 a nm,则晶胞密度ρ=__________ g·cm-3(列出计算式,阿伏加德罗常数的值为 NA)。
I. 一种 Zn2+配合物广泛应用于催化剂,光导体,光动力疗法,其结构如图所示:

(1)Zn2+价电子轨道表示式为
(2)该配合物中电负性最大的元素是
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是__________。(填序号)
| A.[He]2s22p3 | B.[He]2s22p2 |
| C.[He]2s22p23s1 | D.[He]2s22p13s1 |
(5)该配合物中 Zn2+的配位数为
Ⅱ. ZnS 常用作分析试剂、荧光体、白色颜料等。
(6)ZnS 常见有 2 种晶胞结构如下图:立方晶胞(左图)和六方晶胞(右图)。

下列说法错误的是__________。(填序号)
| A.立方 ZnS 中与 S2—最近的 S2—有 12 个 | B.两种晶胞中 Zn2+的个数都为4 |
| C.立方 ZnS 中 S2—的配位数为 4 | D.可用 X—射线衍射实验鉴别六方 ZnS 是否属于晶体 |
您最近一年使用:0次
解题方法
4 . 近日,济南大学原长洲教授制备了一种高性能的钾离子电池负极材料( Bi - MOF),反应可简单表示为Bi( NO3)3·5H2O + BTC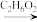 Bi – MOF。回答下列问题:
Bi – MOF。回答下列问题:
(1)铋(Bi)位于元素周期表中第6周期VA族,基态Bi原子的价层电子排布式为___________ 。
Bi(NO3)3中阴离子的立体构型为___________ 。基态O原子核外成对电子数与未成对电子数之比为___________ 。
(2)BTC分子中组成元素C、N、O的电负性由大到小排序为___________ 。C2H5OH的沸点高于CH3OCH3,原因是___________ 。
(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。
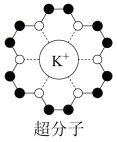
已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
①冠醚分子中C原子的杂化类型为___________ 。
②下列叙述正确的是___________ (填字母)。
A.含该超分子的物质属于分子晶体
B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变
D.冠醚与碱金属离子之间形成离子键
(4)铋的相关晶胞如图所示。
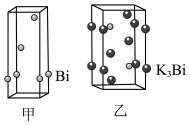
①等晶胞数的甲、乙中含铋原子数之比为___________ 。
②已知乙晶胞底边长为acm,高为bcm,NA为阿伏伽德罗常数的值。该晶体密度___________ g·cm-3(只列计算式)。
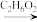 Bi – MOF。回答下列问题:
Bi – MOF。回答下列问题:(1)铋(Bi)位于元素周期表中第6周期VA族,基态Bi原子的价层电子排布式为
Bi(NO3)3中阴离子的立体构型为
(2)BTC分子中组成元素C、N、O的电负性由大到小排序为
(3)冠醚是皇冠状的分子,可用不同大小的空穴适配不同大小的碱金属离子。18-冠-6(18指C、O原子总数为18,6指氧原子数)与钾离子形成的超分子结构如图所示。

已知:超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子定义中的分子是广义的,包括离子。
①冠醚分子中C原子的杂化类型为
②下列叙述正确的是
A.含该超分子的物质属于分子晶体
B.冠醚可用于分离不同的碱金属离子
C.中心碱金属离子的配位数固定不变
D.冠醚与碱金属离子之间形成离子键
(4)铋的相关晶胞如图所示。

①等晶胞数的甲、乙中含铋原子数之比为
②已知乙晶胞底边长为acm,高为bcm,NA为阿伏伽德罗常数的值。该晶体密度
您最近一年使用:0次
名校
解题方法
5 . 氢能是一种极具发展潜力的清洁能源,下列物质都是具有广阔应用前景的储氢材料。按要求回答下列问题:
(1)氢化钠( )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为___________ 。
(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为___________ 。
(3) (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(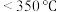 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是___________ ,键角:
___________  (填“
(填“ ”或“
”或“ ”)。
”)。
(4)咔唑(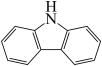 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比(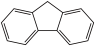 )的高,其主要原因是
)的高,其主要原因是___________ 。
(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
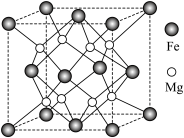
①距离 原子最近的
原子最近的 原子个数是
原子个数是___________ 。
②铁镁合金的化学式为___________ 。
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为___________  。
。
④若该晶体储氢时, 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为___________ L。
(1)氢化钠(
 )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为
(3)
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(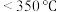 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是
 (填“
(填“ ”或“
”或“ ”)。
”)。(4)咔唑(
 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比( )的高,其主要原因是
)的高,其主要原因是(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离
 原子最近的
原子最近的 原子个数是
原子个数是②铁镁合金的化学式为
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为
 。
。④若该晶体储氢时,
 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为
您最近一年使用:0次
2023-05-25更新
|
348次组卷
|
3卷引用:天津市新华中学2023届高三二模化学试题
名校
解题方法
6 .  在催化剂作用下,与水反应生成
在催化剂作用下,与水反应生成 的前2步可能机理为:
的前2步可能机理为:
第1步: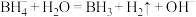
第2步:
……完成下列填空:
(1)已知电负性: 。
。 中B的化合价为
中B的化合价为_______ 。第1步反应的氧化产物是_______ ,(填化学式或离子符号)。
(2) 的分子空间构型是
的分子空间构型是_______ , 中B原子的杂化类型是
中B原子的杂化类型是_______ 。比较 与
与 的键角:
的键角:
_______ 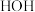 (填“>”、“<”或“=”),其原因是:
(填“>”、“<”或“=”),其原因是:_______ 。
(3)上述机理的第3、4步与第2步类似,最终生成 。用化学方程式表示第3步的机理:
。用化学方程式表示第3步的机理:_______ 。写出 的结构式:
的结构式:_______ 。根据上述机理, 与
与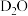 反应时,所得气体产物为
反应时,所得气体产物为_______ (填写化学式)。
(4) 分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是
分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是_______ 。
(5) 溶液中存在平衡:
溶液中存在平衡: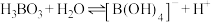 。下列叙述正确的是
。下列叙述正确的是
 在催化剂作用下,与水反应生成
在催化剂作用下,与水反应生成 的前2步可能机理为:
的前2步可能机理为:第1步:
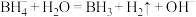
第2步:

……完成下列填空:
(1)已知电负性:
 。
。 中B的化合价为
中B的化合价为(2)
 的分子空间构型是
的分子空间构型是 中B原子的杂化类型是
中B原子的杂化类型是 与
与 的键角:
的键角:
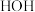 (填“>”、“<”或“=”),其原因是:
(填“>”、“<”或“=”),其原因是:(3)上述机理的第3、4步与第2步类似,最终生成
 。用化学方程式表示第3步的机理:
。用化学方程式表示第3步的机理: 的结构式:
的结构式: 与
与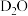 反应时,所得气体产物为
反应时,所得气体产物为(4)
 分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是
分子中B原子与三个O原子构成平面三角形,则B原子的杂化类型是(5)
 溶液中存在平衡:
溶液中存在平衡: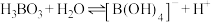 。下列叙述正确的是
。下列叙述正确的是A. 的水溶液显酸性 的水溶液显酸性 |
B.B原子杂化轨道中s轨道的成分: 大于 大于 |
| C.上述反应的2种反应物分子中,所有原子都达到8电子构型 |
D. 溶液中还可能存在 溶液中还可能存在 、 、 等系列微粒 等系列微粒 |
您最近一年使用:0次
解题方法
7 . 氮元素形成的化合物种类众多,用途广泛。根据信息回答下列问题。
(1)NH3BH3(氨硼烷)因具有很高的储氢容量及相对低的放氢温度(<350°C),而成为颇具潜力的化学储氢材料之一 ,它可通过环硼氮烷、CH4与H2O进行合成。
①基态氮原子的电子排布图为________________ 。
②上述涉及的元素H、B 、C、N、O中电负性最大的是_____ (填元素符号)。
(2)BF3、NH3和PH3分子中键角由大到小的顺序为_____ 。
(3)若配离子[Co(CN) x](x-3)-的中心离子价电子数与配体提供的电子数之和为18,则x=__________________ 。
(4)咪唑、噻唑、吡啶是含N 和S的有机杂环类化合物,结构如图所示:
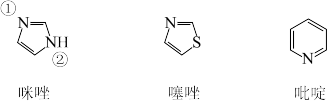
①上述三种物质中,沸点最高的是_____ (填化学名称)。
②吡啶中氮原子的杂化轨道的空间构型为_____________ 。
③已知咪唑中存在类似苯的大π键,则在咪唑分子的两个氮原子中,更容易与Cu2+形成配位键的是_____ (填“①”或“②” )号氮原子。
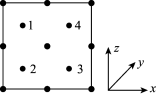
(5)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。如图为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为( ,
, ,
, ),则原子3的原子分数坐标为
),则原子3的原子分数坐标为________ 。
(6)某铁氮化合物晶体的晶胞结构如图所示。
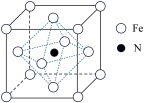
①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为_____ 。
②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为NA,则该晶体的密度为____ g·cm-3(列出计算式即可)。
(1)NH3BH3(氨硼烷)因具有很高的储氢容量及相对低的放氢温度(<350°C),而成为颇具潜力的化学储氢材料之一 ,它可通过环硼氮烷、CH4与H2O进行合成。
①基态氮原子的电子排布图为
②上述涉及的元素H、B 、C、N、O中电负性最大的是
(2)BF3、NH3和PH3分子中键角由大到小的顺序为
(3)若配离子[Co(CN) x](x-3)-的中心离子价电子数与配体提供的电子数之和为18,则x=
(4)咪唑、噻唑、吡啶是含N 和S的有机杂环类化合物,结构如图所示:

①上述三种物质中,沸点最高的是
②吡啶中氮原子的杂化轨道的空间构型为
③已知咪唑中存在类似苯的大π键,则在咪唑分子的两个氮原子中,更容易与Cu2+形成配位键的是
(5)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。如图为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(
 ,
, ,
, ),则原子3的原子分数坐标为
),则原子3的原子分数坐标为
(6)某铁氮化合物晶体的晶胞结构如图所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为
②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
名校
解题方法
8 . 生产、生活和科技发展离不开化学。请回答下列问题:
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。
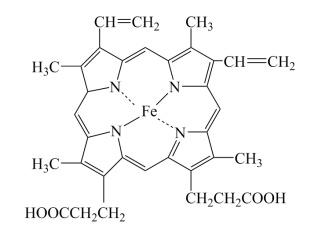
①基态Fe原子的价电子排布图为___________ ,Fe2+核外电子有___________ 种空间运动状态。
②血红素中各非金属元素的电负性由小到大的顺序为___________ 。
③Fe2+与邻二氮菲(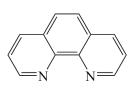 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:___________ ;若OH-浓度高,OH-又会与Fe2+作用,同邻二氮菲形成竞争。
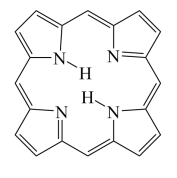
④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取___________ 杂化。
(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的___________ 区,找出距离As(0.25,0.25,0.25)最近的As___________ (用分数坐标表示)。
②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为___________ pm(列出计算式)。
(1)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。

①基态Fe原子的价电子排布图为
②血红素中各非金属元素的电负性由小到大的顺序为
③Fe2+与邻二氮菲(
 )等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:
)等多齿配体在水溶液中可以形成稳定的橙红色邻二氮菲亚铁离子,该配合物的颜色常用于Fe2+浓度的测定。实验表明,邻二氮菲检测Fe2+的适宜pH范围是2-9,主要原因:④卟琳是含有平面共轭大环结构的有机分子材料,具有独特的电子结构和光物理性质,卟琳分子结构如图,N原子的杂化轨道类型相同,采取

(2)立方砷化硼(BAs)在理论上具有比硅更好的导热性,以及更高的双极性迁移率,有潜力成为比硅更优良的半导体材料。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,立方砷化硼晶胞结构如图所示。As位于元素周期表的

②已知晶体密度为ag·cm-3,As半径为bpm,假设As、B原子相切,则B原子的半径为
您最近一年使用:0次
2023-03-14更新
|
1068次组卷
|
2卷引用:四川省成都市第七中学2023届高三下学期二诊模拟考试理科综合化学试题
9 . 西北工业大学曾华强课题组借用足球烯核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。
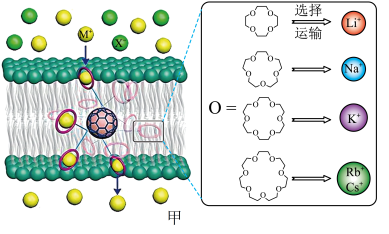
已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为___________ 。基态K原子的核外电子云有___________ 个伸展方向。
(2)运输Cs+的冠醚名称是___________ 。冠醚分子中氧原子的杂化类型是___________ ,冠醚与碱金属离子之间存在微弱的配位键,配位原子是___________ (填元素符号)。
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
18-冠醚-6不能识别和运输Na+和Cs+的原因是___________ 。观察图甲,冠醚不能识别和运输X-的主要原因可能是___________ 。
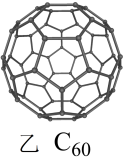
(4)足球烯的结构如图乙所示。1mol足球烯含___________ molσ键。
(5)铷晶胞为体心立方堆积,如图丙所示。
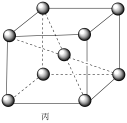
铷晶胞的原子空间利用率为___________ (用含π的式子表示)。
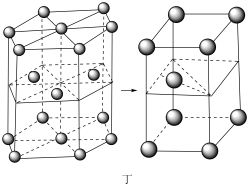
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为___________ g· cm-3(用含字母的式子表示)。

已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为
(2)运输Cs+的冠醚名称是
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
| 冠醚 | 冠醚空腔直径/pm | 适合的粒子直径/pm |
| 12冠醚- 4 | 120~ 150 | Li+ (152) |
| 15 -冠醚-5 | 170~ 220 | Na+ (204) |
| 18 -冠醚- 6 | 260~ 320 | K+ (276) |
| ___________ | 340~ 430 | Rb+ (304) |
| Cs+ (334) |
(4)足球烯的结构如图乙所示。1mol足球烯含

(5)铷晶胞为体心立方堆积,如图丙所示。

铷晶胞的原子空间利用率为
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为

您最近一年使用:0次
解题方法
10 . 如图甲,铜离子与有机物HA可形成一种螯合物 ,从而萃取水中的铜离子。
,从而萃取水中的铜离子。
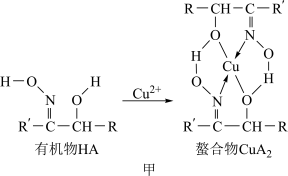
图中的R、R′均为烷烃基,该萃取反应可简单表示为2HA+Cu2+ CuA2+2H+
CuA2+2H+
回答下列问题:
(1)基态铜原子的价电子排布式为_______ 。
(2)有机物HA中,C、N、O三种元素电负性由大到小的顺序是_______ 。
(3)螯合物 中的氮原子杂化方式为
中的氮原子杂化方式为_______ ,氧原子的杂化方式为_______ 。
(4)下列关于螯合物 的说法中,正确的是
的说法中,正确的是_______ (填序号)。
① 中O的配位能力比N强
中O的配位能力比N强
②与 配位的4个原子可能呈平面构型
配位的4个原子可能呈平面构型
③ 既溶于水又溶于有机溶剂
既溶于水又溶于有机溶剂
④每个 分子中含2个氢键、2个π键
分子中含2个氢键、2个π键
(5)萃取后,铜离子进入有机相中,反萃取时,螯合物释放出铜离子,铜离子进入水相,可用于铜离子的富集及提纯,则反萃取时常加入的试剂是_______ 。
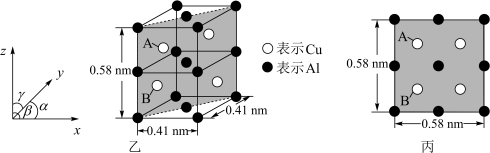
(6)金属铜与铝可形成多种不同的合金,其中一种合金的晶胞如图乙所示,晶胞参数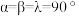 ,
, ,
,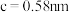 ,按图乙中阴影面进行投影得到图丙。
,按图乙中阴影面进行投影得到图丙。
该晶体的化学式为_______ ,密度为_______  (结果保留两位有效数字)。
(结果保留两位有效数字)。
 ,从而萃取水中的铜离子。
,从而萃取水中的铜离子。
图中的R、R′均为烷烃基,该萃取反应可简单表示为2HA+Cu2+
 CuA2+2H+
CuA2+2H+回答下列问题:
(1)基态铜原子的价电子排布式为
(2)有机物HA中,C、N、O三种元素电负性由大到小的顺序是
(3)螯合物
 中的氮原子杂化方式为
中的氮原子杂化方式为(4)下列关于螯合物
 的说法中,正确的是
的说法中,正确的是①
 中O的配位能力比N强
中O的配位能力比N强②与
 配位的4个原子可能呈平面构型
配位的4个原子可能呈平面构型③
 既溶于水又溶于有机溶剂
既溶于水又溶于有机溶剂④每个
 分子中含2个氢键、2个π键
分子中含2个氢键、2个π键(5)萃取后,铜离子进入有机相中,反萃取时,螯合物释放出铜离子,铜离子进入水相,可用于铜离子的富集及提纯,则反萃取时常加入的试剂是
(6)金属铜与铝可形成多种不同的合金,其中一种合金的晶胞如图乙所示,晶胞参数
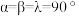 ,
, ,
,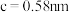 ,按图乙中阴影面进行投影得到图丙。
,按图乙中阴影面进行投影得到图丙。
该晶体的化学式为
 (结果保留两位有效数字)。
(结果保留两位有效数字)。
您最近一年使用:0次



