12-13高二下·福建三明·阶段练习
名校
解题方法
1 . 下列物质的分子中既有σ键,又有π键的是
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
| A.①②③ | B.③⑤⑥ | C.①③⑥ | D.③④⑤⑥ |
您最近一年使用:0次
2023-03-18更新
|
942次组卷
|
40卷引用:2012-2013学年福建三明泰宁一中高二下第一次阶段考试化学试卷
(已下线)2012-2013学年福建三明泰宁一中高二下第一次阶段考试化学试卷(已下线)2012-2013学年山东省淄博市沂源一中高二下学期期中模块检测化学卷(已下线)2013-2014黑龙江省鹤岗一中高二下学期期末考试化学试卷2015-2016学年山东省桓台二中高二上学期期中测试化学试卷2015-2016学年山西省太原五中高二下3月周练化学试卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2017届河南信阳高考化学暑假自学自测专练:原子结构与性质河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:2.1 第1课时吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高二上学期期末考试化学试题福建省宁德市六校2018-2019学年高二第二学期期中联合考试化学试题课时1 共价键——A学习区 夯实基础(鲁科版选修3)辽宁省锦州市黑山县黑山中学2019-2020学年高二下学期线上教学检测化学试题河北省唐山市路北区第十一中学2019-2020学年高二下学期期末考试化学试题宁夏大学附属中学2020-2021学年高二上学期期中考试化学试题云南省昆明师范专科学校附属中学2022-2023学年高二下学期4月月考化学试题高二选择性必修2(人教版2019)第二章 分子结构与性质 第一节 共价键 课时1 共价键的特征与类型吉林省白城市第一中学2020-2021学年高二下学期3月月考化学试题新疆维吾尔自治区乌鲁木齐市第四中学2020-2021学年高二年级下学期期中考试化学试题福建省福州高级中学2020-2021学年高二下学期期中考试化学试题宁夏长庆高级中学2020-2021学年高二上学期期中考试化学试卷甘肃省兰州二十七中学2020-2021学年高二下学期期中考试化学试题陕西省宝鸡市金台区2020-2021学年高二下学期期末考试化学试题内蒙古霍林郭勒市第一中学2021-2022学年高二下学期第一次月考化学试题湖南省常德市安乡县第一中学2021-2022 学年高二下学期期中考试化学试题吉林省通化市部分重点中学校2021-2022学年高二下学期期末联考化学试题黑龙江省肇东市第四中学2021-2022学年高二下学期期中考试化学试题宁夏银川市景博中学2021-2022学年高二下学期第二次月考化学试题黑龙江省双鸭山市饶河县高级中学2021-2022学年高二下学期期中考试化学试题重庆市璧山来凤中学2022-2023学年高二下学期第一次月考化学试题湖北省部分普通高中联盟2022-2023学年高二下学期期中联考化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高二下学期期中考试化学试题新疆乌鲁木齐市六校联考2022-2023学年高二下学期6月期末考试化学试题黑龙江省哈尔滨市宾县第二中学2022-2023学年高二下学期第二次月考化学试题河南省驻马店市环际大联考2022-2023学年高二下学期4月期中考试化学试题2.1共价键模型(课前)-鲁科版选择性必修22.1共价键模型(课后)-鲁科版选择性必修2(已下线)2.1.1 共价键(基础)2.1.1 共价键-随堂练习福建省建瓯市芝华中学2023-2024学年高二下学期第一次阶段考试化学试题
名校
解题方法
2 . 向含Fe2+的溶液中加入少量K3[Fe(CN)6]溶液,可生成蓝色沉淀(Turbull blue,滕氏蓝),这是鉴别Fe2+的灵敏反应。回答下列问题:
(1)基态Fe原子的电子排布式为__________________ 。
(2)K3[Fe(CN)6]中C原子的杂化方式为_______ ,C、N和同周期的O比较,第一电离能由小到大的顺序为________ , C、 N、O的最简单氢化物的沸点由低到高的顺序为________________ 。(用分子式表示)。
(3)写出两种与CN-互为等电子体的分子___________ 、____________ (填分子式)。
(4)经X射线衔射证明,滕氏蓝的立方晶胞结构由如图所示的8个小立方体构成,一个晶胞中有4个K+,占有4个互不相邻的小立方体的体心。滕氏蓝的化学式为[以最简整数比表示,其中铁用Fe(II)、Fe(III)表示]_______ , Fe3+的配位数为_________ 。

(5)若滕氏蓝晶体的密度为ρg∙cm-3,计算其晶胞参数a=_____ nm。(列出计算式,设NA为阿伏加德罗常数的值)。
(1)基态Fe原子的电子排布式为
(2)K3[Fe(CN)6]中C原子的杂化方式为
(3)写出两种与CN-互为等电子体的分子
(4)经X射线衔射证明,滕氏蓝的立方晶胞结构由如图所示的8个小立方体构成,一个晶胞中有4个K+,占有4个互不相邻的小立方体的体心。滕氏蓝的化学式为[以最简整数比表示,其中铁用Fe(II)、Fe(III)表示]

(5)若滕氏蓝晶体的密度为ρg∙cm-3,计算其晶胞参数a=
您最近一年使用:0次
名校
解题方法
3 . 钛和钛的化合物用途比较广泛。
I.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理如图所示。请根据该反应机理中所涉及的元素及其化合物,回答下列问题:

(1)氧原子核外电子的空间运动状态有__ 种,基态钛原子的价电子排布式为__ ,该基态原子最外层的电子电子云轮廓图为__ 。
(2)C、O和Ti电负性由大到小的顺序为__ 。
(3)与CO分子互为等电子体的分子和离子各写出1种,分别为__ 和___ (填化学式)。
(4)在一定条件下CO可与铁单质反应生成配位化合物——羰基铁Fe(CO)5,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断Fe(CO)5晶体类型为__ 。从电负性角度分析,Fe(CO)5中与Fe形成配位键的是__ (填“碳”或“氧”)原子。
(5)同主族化学性质相似,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是___ 。H4SiO4中Si的轨道杂化类型为__ 。
II.钙钛矿晶体为高温超导领域里的一种化合物,其结构如图所示,该结构是具有代表性的最小重复单位。
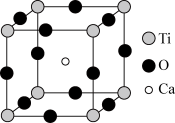
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有__ 个。
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为___ g/cm3。
I.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理如图所示。请根据该反应机理中所涉及的元素及其化合物,回答下列问题:

(1)氧原子核外电子的空间运动状态有
(2)C、O和Ti电负性由大到小的顺序为
(3)与CO分子互为等电子体的分子和离子各写出1种,分别为
(4)在一定条件下CO可与铁单质反应生成配位化合物——羰基铁Fe(CO)5,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断Fe(CO)5晶体类型为
(5)同主族化学性质相似,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是
II.钙钛矿晶体为高温超导领域里的一种化合物,其结构如图所示,该结构是具有代表性的最小重复单位。

(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为
您最近一年使用:0次
名校
解题方法
4 . 硼(B)及其化合物在化学中具有十分重要的地位,请回答下列有关问题。
(1)基态硼原子中有_______ 种能量不同的电子,第一电离能介于B和N之间的第二周期元素有_______ 种。
(2)硼酸( )能够屏蔽核辐射,其晶体具有层状结构(每一层结构如图所示),成片状,有滑腻感,可作润滑剂。
)能够屏蔽核辐射,其晶体具有层状结构(每一层结构如图所示),成片状,有滑腻感,可作润滑剂。

①硼酸晶体内所含有作用力类型有__________________ ,根据硼酸的分子结构判断硼酸应属于________ (填“强酸”“中强酸”或“弱酸”),你的判断依据是_________________________ 。
②三氟化硼( )水解生成硼酸和氟硼酸(
)水解生成硼酸和氟硼酸( ),与
),与 互为等电子体的一种阴离子是
互为等电子体的一种阴离子是_________ (写化学式)。
(3)六方氮化硼的结构与石墨结构相类似(如图甲),上、下层平行,B、N原子相互交替,层内B—N核间距为acm,层间距为 ,晶体密度为
,晶体密度为 ,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为___________ ,其结构与石墨相似却不导电,原因是___________________ ,网状加德罗常数
________ 。(用含 的式子表示)。
的式子表示)。

(1)基态硼原子中有
(2)硼酸(
 )能够屏蔽核辐射,其晶体具有层状结构(每一层结构如图所示),成片状,有滑腻感,可作润滑剂。
)能够屏蔽核辐射,其晶体具有层状结构(每一层结构如图所示),成片状,有滑腻感,可作润滑剂。
①硼酸晶体内所含有作用力类型有
②三氟化硼(
 )水解生成硼酸和氟硼酸(
)水解生成硼酸和氟硼酸( ),与
),与 互为等电子体的一种阴离子是
互为等电子体的一种阴离子是(3)六方氮化硼的结构与石墨结构相类似(如图甲),上、下层平行,B、N原子相互交替,层内B—N核间距为acm,层间距为
 ,晶体密度为
,晶体密度为 ,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
 的式子表示)。
的式子表示)。
您最近一年使用:0次
名校
解题方法
5 . 2019年诺贝尔化学奖由来自美、英、日的三人分获,以表彰他们在锂离子电池研究方面做出的贡献,他们最早发明用LiCoO2作离子电池的正极,用聚乙炔作负极。回答下列问题:
(1)基态Co原子价电子排布图为______________ (轨道表达式)。第四电离能I4(Co)比I4(Fe)小,是因为_____________________ 。
(2)LiCl的熔点(605℃)比LiF的熔点(848℃)低,其原因是_________________________ .
(3)乙炔(C2H2)分子中δ键与π键的数目之比为_______________ 。
(4)锂离子电池的导电盐有LiBF4等,碳酸亚乙酯(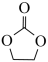 )是一种锂离子电池电解液的添加剂。
)是一种锂离子电池电解液的添加剂。
①LiBF4中阴离子的空间构型是___________ ;与该阴离子互为等电子体的分子有_____________ 。(列一种)
②碳酸亚乙酯分子中碳原子的杂化方式有_______________________ 。
(5)Li2S是目前正在开发的锂离子电池的新型固体电解质,其晶胞结构如图所示,已知晶胞参数a=588pm。
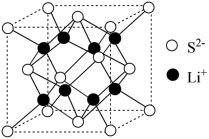
①S2-的配位数为______________ 。
②设NA为阿伏加 德罗常数的值,Li2S的晶胞密度为____________ (列出计算式) 。
。
(1)基态Co原子价电子排布图为
(2)LiCl的熔点(605℃)比LiF的熔点(848℃)低,其原因是
(3)乙炔(C2H2)分子中δ键与π键的数目之比为
(4)锂离子电池的导电盐有LiBF4等,碳酸亚乙酯(
 )是一种锂离子电池电解液的添加剂。
)是一种锂离子电池电解液的添加剂。①LiBF4中阴离子的空间构型是
②碳酸亚乙酯分子中碳原子的杂化方式有
(5)Li2S是目前正在开发的锂离子电池的新型固体电解质,其晶胞结构如图所示,已知晶胞参数a=588pm。

①S2-的配位数为
②设NA为阿伏加 德罗常数的值,Li2S的晶胞密度为
 。
。
您最近一年使用:0次
2020-01-09更新
|
588次组卷
|
6卷引用:云南省昆明市第一中学2020届高三上学期12月月考理综试卷化学试题
云南省昆明市第一中学2020届高三上学期12月月考理综试卷化学试题2019年湖北省十堰市高三元月调研考试理综化学试题河北省邢台市2020届高三上学期第四次月考化学试题河南省驻马店市2020届高三上学期期末统一考试化学试题海南省2020届高三下学期新高考线上诊断性测试化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编
名校
解题方法
6 . 碱金属及碳族元素在科研领域、生活和生产方面有广泛的应用。回答下列问题:
(1)在元素周期表中,与Li的化学性质最相似的邻族元素是__________ (填元素符号),该元素基态原子最外层电子的自旋状态___________ (填“相同”或“相反”)。
(2)碳和硅的有关化学键键能如下所示:
SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________ 。
(3)天然硅酸盐都是由[SiO4]四面体以顶角氧原子相连而成,可成链状也可成环,所以硅酸盐种类繁多。下图a代表SiO44-,b、c是硅氧四面体形成的环状结构。
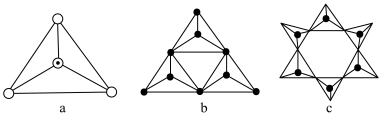
硅氧四面体中Si的轨道杂化类型为____________ ; 图b环状结构硅酸根的化学式为______________ 若在环状结构中硅的原子数为n,写出环状结构中硅酸根的通式_____________ 。
(4)钾与溴作用能形成溴化钾晶体,该晶体类型为___________ ,其晶格能可通过下图的Borm-Haber循环计算得到。
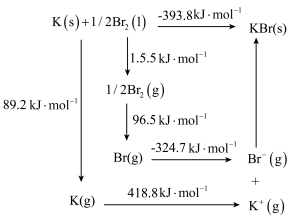
从上图可知,K原子的第一电离能为_____ kJ/mol, Br-Br键键能为______ kJ/ mol,KBr的晶格能为______ kJ/mol,晶格能越大,该晶体的熔点越______ 。
(1)在元素周期表中,与Li的化学性质最相似的邻族元素是
(2)碳和硅的有关化学键键能如下所示:
| 化学键 | C-H | C-O | Si-H | Si-O |
| 键能/kJ▪mol-1 | 413 | 336 | 318 | 452 |
SiH4的稳定性小于CH4,更易生成氧化物,原因是
(3)天然硅酸盐都是由[SiO4]四面体以顶角氧原子相连而成,可成链状也可成环,所以硅酸盐种类繁多。下图a代表SiO44-,b、c是硅氧四面体形成的环状结构。

硅氧四面体中Si的轨道杂化类型为
(4)钾与溴作用能形成溴化钾晶体,该晶体类型为

从上图可知,K原子的第一电离能为
您最近一年使用:0次
2019-12-06更新
|
256次组卷
|
3卷引用:云南省昆明市第一中学2019-2020高三第三次双基检测化学试题
名校
解题方法
7 . 太阳能电池可分为:硅太阳能电池,化合物太阳能电池,如砷化镓(GaAs)、铜铟镓硒(CIGS)、硫化镉(CdS),功能高分子太阳能电池等,Al-Ni常作电极。据此回答问题:
(1)镍(Ni)在周期表中的位置为______ ;S原子的价电子排布式为________ ;Ga、As和Se的第一电离能由大到小的顺序是________ 。
(2)Na3As3中As原子的杂化方式为_____ ;AsCl3的空间构型为____ 。
(3)GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为__________ 。
(4)写出一种与SO42-互为等电子体的分子_________ 。
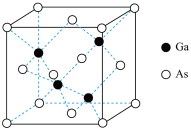
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为_____ 。已知GaAs的密度为ρg/cm3,Ga和As的摩尔质量分别为 MGa g/mol和MAsg/mol,则GaAs晶胞中Ga之间的最短距离为________ pm。
(1)镍(Ni)在周期表中的位置为
(2)Na3As3中As原子的杂化方式为
(3)GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为
(4)写出一种与SO42-互为等电子体的分子
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为

您最近一年使用:0次
2019-03-16更新
|
975次组卷
|
4卷引用:云南省昆明市寻甸一中2020届高三第一次全真模拟考试理综化学试题
解题方法
8 . [化学——选修3:物质结构与性质]
金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。已知钼在元素周期表中呈现的信息为

回答下列问题
(1)钼位于元素周期表的位置是__________ ,基态Mo原子核外有_________ 种不同运动状态的电子,其中核外电子占据最高能层的符号是______________ 。
(2)辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势,可用H2S硫化(NH4)2MoO4溶液生产辉钼。O、N、S的第一电离能由大到小的顺序________________ ,H2S中心原子的杂化轨道类型为____________ 。
(3)MoS2纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是_________ 。
(4)Mo能与CO形成Mo(CO)6的配合物,其中Mo的化合价为_________ ,其配体分子与N2具有相似的化学结构,则该配体分子中σ键与π键数目之比为_________ 。
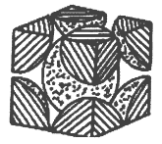
(5)金属钼晶体中的原子堆积方式如图所示,这种堆积方式为_________ 堆积。若晶体钼的密度为ρg·cm-3,钼原子半径为rpm,NA表示阿伏伽德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为__________________ (用含有ρ、r、NA、M的代数式表示)。
金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。已知钼在元素周期表中呈现的信息为

回答下列问题
(1)钼位于元素周期表的位置是
(2)辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势,可用H2S硫化(NH4)2MoO4溶液生产辉钼。O、N、S的第一电离能由大到小的顺序
(3)MoS2纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是
(4)Mo能与CO形成Mo(CO)6的配合物,其中Mo的化合价为
(5)金属钼晶体中的原子堆积方式如图所示,这种堆积方式为

您最近一年使用:0次
解题方法
9 . 由ⅢA、VA族元素组成的新型材料有着广泛用途。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。与BCl3互为等电子体,且由第二周期元素组成的一种阴离子为__________ (填离子符号)。
(2)氨硼烷(H3N—BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料。
①H3N—BH3中N原子的轨道杂化类型为________________ 。
②Ti(BH4)3由TiCl3和LiBH4反应制得。基态Ti3+的未成对电子数为____________ ;BH 的立体构型是
的立体构型是_______ ;该制备反应的化学方程式为______________ 。
(3)氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:
3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。
下列有关叙述错误的是_____________
(4)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为_____________ 。Ga的配位原子(As)数目为________ ;Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGacm和rAscm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为__________ 。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。与BCl3互为等电子体,且由第二周期元素组成的一种阴离子为
(2)氨硼烷(H3N—BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料。
①H3N—BH3中N原子的轨道杂化类型为
②Ti(BH4)3由TiCl3和LiBH4反应制得。基态Ti3+的未成对电子数为
 的立体构型是
的立体构型是(3)氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:
3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。
下列有关叙述错误的是_____________
| A.氨硼烷中存在配位键 |
| B.第一电离能大小关系:N>O>C>B>H |
| C.反应前后碳原子的杂化类型不变 |
| D.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |

您最近一年使用:0次
9-10高一下·浙江温州·期中
名校
10 . 已知自然界氧的同位素有16O、17O、18O,氢的同位素有H、D,从水分子的原子组成来看,自然界的水一共有( )
| A.3种 | B.6种 | C.9种 | D.12种 |
您最近一年使用:0次
2016-12-09更新
|
456次组卷
|
12卷引用:09-10学年昆明三中高一下学期期末化学试卷
(已下线)09-10学年昆明三中高一下学期期末化学试卷(已下线)2010年浙江省温州二中高一第二学期期中考试化学试题(已下线)2010—2011学年四川省乐山一中高一下学期第一次月考化学试卷(已下线)2010—2011学年山西省平遥中学高一下学期期中考试化学试卷(已下线)2010—2011学年浙江省杭州十四中高一下学期期中考试化学试题(已下线)2011-2012学年浙江省诸暨中学高一上学期期中考试化学试卷(已下线)2011-2012学年浙江省温州中学高一下学期期中考试文科化学试卷江西省南昌市八一中学、洪都中学、麻丘中学、十七中、桑海中学2016-2017学年高一下学期期中考试化学试题陕西省黄陵中学2017-2018学年高一(普通班)下学期期末考试化学试题四川省南充市阆中中学2020届高三化学选择题专项训练(14)(已下线)第1讲 原子-2020-2021学年秋季班高一上学期化学教材知识点精讲练(沪科版)上海市华师大张江实验中学2021-2022学年高一下学期线上期末考试化学试题



