名校
解题方法
1 . 铋的化合物在电催化和光催化领域都有广泛应用。一种以氧化铋渣(主要成分是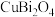 、
、 、
、 和
和 等)为原料,制取高纯
等)为原料,制取高纯 的工业流程如图所示:
的工业流程如图所示:
回答下列问题:
(1)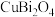 中的Cu的化合价为+2,则Bi的化合价是
中的Cu的化合价为+2,则Bi的化合价是_______ ,Bi与N同族,Bi原子处于基态时电子占据最高能级的电子云轮廓图为_______ 形。
(2)“沉铋”时加入NaOH溶液, 转化为BiOCl沉淀的离子方程式是
转化为BiOCl沉淀的离子方程式是_______ 。
(3)“洗涤”滤饼时先用水洗,再用稀硫酸洗涤(已知:BiOCl不溶于稀硫酸),用稀硫酸洗涤的目的是为了除去滤饼中的_______ (填化学式)杂质。
(4)“转化”过程中BiOCl转化为 沉淀,当溶液中
沉淀,当溶液中 浓度为
浓度为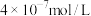 时溶液的pH为
时溶液的pH为_______ 。(该温度下,已知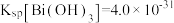 )
)
(5)硫代乙酰胺(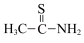 )中碳原子的杂化方式分别为
)中碳原子的杂化方式分别为_______ 。
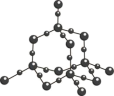
(6)钼酸铋( )可用于光催化水的分解,其晶胞结构(不含氧原子)如图所示,晶胞参数为
)可用于光催化水的分解,其晶胞结构(不含氧原子)如图所示,晶胞参数为 ,晶胞棱边夹角均为90°。
,晶胞棱边夹角均为90°。 ,则原子2的分数坐标为
,则原子2的分数坐标为_______ 。
②设阿伏加德罗常数的值为 ,
, 的相对分子质量为
的相对分子质量为 ,则
,则 晶体的密度为
晶体的密度为_______  。
。
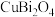 、
、 、
、 和
和 等)为原料,制取高纯
等)为原料,制取高纯 的工业流程如图所示:
的工业流程如图所示: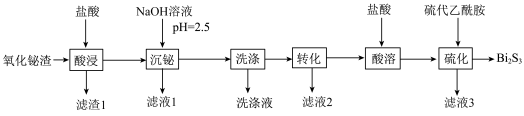
| 离子 |  |  |  |
| 开始沉淀的pH | 1.5 | 3.6 | 4.5 |
| 沉淀完全的pH | 3.2 | 4.7 | 6.7 |
(1)
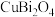 中的Cu的化合价为+2,则Bi的化合价是
中的Cu的化合价为+2,则Bi的化合价是(2)“沉铋”时加入NaOH溶液,
 转化为BiOCl沉淀的离子方程式是
转化为BiOCl沉淀的离子方程式是(3)“洗涤”滤饼时先用水洗,再用稀硫酸洗涤(已知:BiOCl不溶于稀硫酸),用稀硫酸洗涤的目的是为了除去滤饼中的
(4)“转化”过程中BiOCl转化为
 沉淀,当溶液中
沉淀,当溶液中 浓度为
浓度为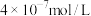 时溶液的pH为
时溶液的pH为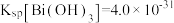 )
)(5)硫代乙酰胺(
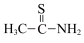 )中碳原子的杂化方式分别为
)中碳原子的杂化方式分别为(6)钼酸铋(
 )可用于光催化水的分解,其晶胞结构(不含氧原子)如图所示,晶胞参数为
)可用于光催化水的分解,其晶胞结构(不含氧原子)如图所示,晶胞参数为 ,晶胞棱边夹角均为90°。
,晶胞棱边夹角均为90°。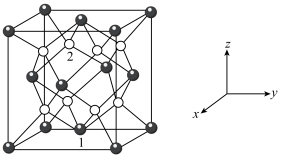
 ,则原子2的分数坐标为
,则原子2的分数坐标为②设阿伏加德罗常数的值为
 ,
, 的相对分子质量为
的相对分子质量为 ,则
,则 晶体的密度为
晶体的密度为 。
。
您最近一年使用:0次
名校
2 . 微观的世界多姿多彩,下列说法正确的是
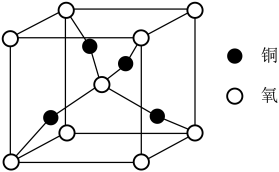
| A.上图为铜和氧形成的一种晶体,该氧化物为CuO |
| B.氧元素位于周期表的s区 |
C. 分子中,氮原子存在孤电子对 分子中,氮原子存在孤电子对 |
| D.四氨合铜离子中存在离子键 |
您最近一年使用:0次
名校
解题方法
3 . 下列有关说法表达正确的是
A.基态Cu原子的价层电子排布式: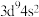 |
| B.基态Si原子中,有两个未成对电子 |
C.第二周期元素中,电负性: |
D. 与 与 均为直线型分子 均为直线型分子 |
您最近一年使用:0次
名校
解题方法
4 . 科学家已获得极具理论研究意义的N4分子,其结构为正四面体(如下图所示),与白磷分子相似。已知断裂1 mol N-N键吸收193 kJ热量 ,形成1 mol N≡N叁键放出941 kJ热量,则
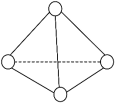
| A.N4分子中的N是sp2杂化 | B.N4是极性分子 |
| C.N4和N2互为同分异构体 | D.1 mol N4气体转化为N2时放出724 kJ 能量 |
您最近一年使用:0次
名校
解题方法
5 . 按要求回答下列问题:
(1)A.乙烷 B.乙烯 C.乙炔 D.苯是有机化学中的代表物质,其中:
①既有 键又有
键又有 键的是
键的是_______ (填序号,下同)。
②碳碳键的键长由大到小排序是:_______ 。
③上述分子中所有原子均在同一平面是:_______ 。
(2)含硫元素的微粒有很多,例如 、
、 、
、 、
、 、
、 ,其中
,其中 的分子结构如下图所示,像一顶皇冠,请回答下列问题:
的分子结构如下图所示,像一顶皇冠,请回答下列问题: 中含有的
中含有的 键数目是
键数目是_______ 。
② 中S原子的杂化轨道类型是
中S原子的杂化轨道类型是_______ , 的空间结构是
的空间结构是_______ 。
③ 分子的VSEPR模型是
分子的VSEPR模型是_______ , 是
是_______ (填“极性”或“非极性”)分子。
④沸点:
_______  (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是_______ 。
(1)A.乙烷 B.乙烯 C.乙炔 D.苯是有机化学中的代表物质,其中:
①既有
 键又有
键又有 键的是
键的是②碳碳键的键长由大到小排序是:
③上述分子中所有原子均在同一平面是:
(2)含硫元素的微粒有很多,例如
 、
、 、
、 、
、 、
、 ,其中
,其中 的分子结构如下图所示,像一顶皇冠,请回答下列问题:
的分子结构如下图所示,像一顶皇冠,请回答下列问题: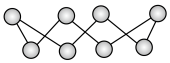
 中含有的
中含有的 键数目是
键数目是②
 中S原子的杂化轨道类型是
中S原子的杂化轨道类型是 的空间结构是
的空间结构是③
 分子的VSEPR模型是
分子的VSEPR模型是 是
是④沸点:

 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是
您最近一年使用:0次
名校
解题方法
6 . 下列粒子中,与 分子的空间构型相同的是
分子的空间构型相同的是
 分子的空间构型相同的是
分子的空间构型相同的是A. | B. | C. | D. |
您最近一年使用:0次
名校
解题方法
7 . 常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,其中心原子Cl为sp2杂化已被联合国卫生组织(WTO)列为Al级高效安全消毒剂,其中心原子Cl为sp2杂化。已知,工业上制备二氧化氯的方法之一是用甲醇在酸性条件下与氯酸钠反应,其反应的化学方程式:CH3OH+6NaClO3+3H2SO4=CO2↑+6ClO2↑+3Na2SO4+5H2O,则下列说法错误的是
| A.CO2是非极性分子 | B.键角: < < |
| C.CH3OH在反应中发生氧化反应 | D.ClO2分子空间构型为V形 |
您最近一年使用:0次
名校
解题方法
8 . 观察下列模型并结合信息,判断有关说法错误的是
| 石英 | FeSO4·7H2O | |
| 结构模型示意图 |
|
|
| 结构模型示意图 | S8分子 | HCN |
|
|
| A.石英属于共价晶体,且两原子个数比为2:1 |
| B.FeSO4·7H2O结构中键角1、2、3由大到小的顺序:3>1>2 |
| C.固态硫S8中S原子为sp2杂化 |
D.HCN的结构式为 |
您最近一年使用:0次
9 . 下表中A、B、C、D、E为原子序数依次增大的短周期主族元素,F、G为第四周期元素,其相关信息如下:
(1)E元素在周期表中的位置是___________ ,其基态原子最高能层的电子占据的原子轨道电子云为_____________ 形。
(2)F元素位于元素周期的_____________ 区,其基态原子的价层电子轨道表示式为______________ 。
(3)C元素单质的结构式为_____________ ,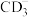 中心原子的杂化方式为
中心原子的杂化方式为___________ ,分子空间构型为_______________ 。
(4)B、C、D、E四种元素的原子半径由大到小的顺序:____________ (填元素符号)。
(5)气态F2+比气态G2+再失去一个电子难,原因是____________ 。
(6)下列关于B2A4的说法中正确的是____________(填序号)。
| A.元素原子是元素周期表中半径最小的原子 |
| B.基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| C.元素原子最高能级的不同轨道都有电子,且只有一种自旋方向 |
| D.原子核外s能级上的电子总数与p能级上的电子总数相等 |
| E.与D为同主族元素 |
| F.其+2价离子的3d轨道为半充满状态 |
| G.目前年产量最大、使用最广泛的金属 |
(2)F元素位于元素周期的
(3)C元素单质的结构式为
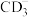 中心原子的杂化方式为
中心原子的杂化方式为(4)B、C、D、E四种元素的原子半径由大到小的顺序:
(5)气态F2+比气态G2+再失去一个电子难,原因是
(6)下列关于B2A4的说法中正确的是____________(填序号)。
| A.B2A4分子中中心原子的杂化类型为sp2 |
| B.B2A4是只由极性键形成的非极性分子 |
| C.B2A4中的所有原子都满足8电子稳定结构 |
| D.B2A4分子中σ键和π键数目比为5:1 |
您最近一年使用:0次
名校
10 . 物质世界缤纷多彩,物质的性质与分子的结构紧密关联。回答下列问题:
I.非金属氟化物在生产、生活和科研中应用广泛。
(1)基态F原子核外电子的空间运动状态有____________ 种。
(2)O、F、Cl电负性由大到小的顺序为______________ ;OF2的熔、沸点___________ (填“高于”或“低于”)Cl2O,原因是__________ 。
Ⅱ、过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应。
(3)对于基态Cr原子,下列叙述正确的是_________ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d44s2
B.从空间角度看,4s轨道比3s轨道大,其空间包含了3s轨道
C.电负性比钾高,原子对键合电子的吸引力比钾大
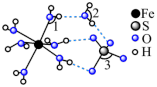
(4)三价铬离子能形成多种配位化合物。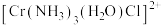 中提供孤电子对形成配位键的原子是
中提供孤电子对形成配位键的原子是___________ ,中心离子的配位数为___________ 。
(5)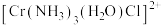 中配体分子NH3、H2O
中配体分子NH3、H2O
①键角:NH3___________ H2O(填“>”或“<”)。
②NH3极易溶于水,原因是____________ 。
(6)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是____________ 原子。设Cr和Al原子半径分别为 和
和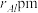 ,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为________ %(列出计算表达式)。
I.非金属氟化物在生产、生活和科研中应用广泛。
(1)基态F原子核外电子的空间运动状态有
(2)O、F、Cl电负性由大到小的顺序为
Ⅱ、过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应。
(3)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d44s2
B.从空间角度看,4s轨道比3s轨道大,其空间包含了3s轨道
C.电负性比钾高,原子对键合电子的吸引力比钾大
(4)三价铬离子能形成多种配位化合物。
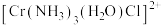 中提供孤电子对形成配位键的原子是
中提供孤电子对形成配位键的原子是(5)
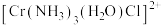 中配体分子NH3、H2O
中配体分子NH3、H2O①键角:NH3
②NH3极易溶于水,原因是
(6)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是
 和
和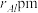 ,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
,晶胞参数如图所示,已知:空间占有率=晶胞中原子总体积/晶胞体积,则金属原子空间占有率为
您最近一年使用:0次