1 . 下列过程或事实不涉及电子转移的是
| A.钢铁部件表面进行发蓝处理 | B.硫酸铜溶液导电 |
| C.用二氧化硅作原料制单晶硅 | D.氯化银溶解于浓氨水中 |
您最近一年使用:0次
名校
2 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.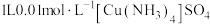 溶液中所含 溶液中所含 数目为 数目为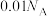 |
B.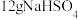 晶体中阴、阳离子总数为 晶体中阴、阳离子总数为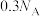 |
C.0.1mol环氧乙烷( )中所含σ键数目为 )中所含σ键数目为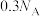 |
D.常温常压下,4.6g乙醇中所含 杂化的原子数目为 杂化的原子数目为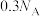 |
您最近一年使用:0次
2024-02-23更新
|
198次组卷
|
2卷引用:重庆市松树桥中学校2023-2024学年高二下学期期中考试化学试题
名校
3 . X、Y、Z、W、P、Q是元素周期表前四周期的六种常见元素,原子序数依次增大。X在自然界中有多种同素异形体,其中一种是自然界中最硬的单质;Z是地壳中含量最多的元素;W基态原子核外的9个原子轨道上填充了电子,且有1个未成对电子;P是常见的金属元素,其单质能与盐酸反应,不与碱反应,它的某种氧化物可用作红色颜料;Q基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。回答以下问题:
(1)P、Q中位于周期表的d区的是__________ (填元素符号,下同),基态Q原子的价层电子排布式为__________ ;元素X、Y、Z中,电负性最大的是__________ 。
(2)烃 的1个分子中含有
的1个分子中含有__________ 个σ键;X和Y的简单氢化物中沸点更高的是__________ (填化学式),理由是__________ (答2点)。
(3)化合物 可用作杀菌消毒剂和漂白剂,
可用作杀菌消毒剂和漂白剂, 分子的中心原子杂化类型是
分子的中心原子杂化类型是__________ ;工业上可用W的单质与潮湿的碳酸钠反应制取 ,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式
,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式__________ 。
(1)P、Q中位于周期表的d区的是
(2)烃
 的1个分子中含有
的1个分子中含有(3)化合物
 可用作杀菌消毒剂和漂白剂,
可用作杀菌消毒剂和漂白剂, 分子的中心原子杂化类型是
分子的中心原子杂化类型是 ,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式
,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式
您最近一年使用:0次
2024-02-22更新
|
169次组卷
|
4卷引用:重庆市铜梁一中等重点中学2023-2024学年高二下学期3月月考化学试题
名校
4 . 短周期主族元素W、X、Y、Z的原子序数依次增大,W的最高正价与最低负价代数和为0,W、X、Y形成的化合物甲的结构如图所示,Z原子M层上有2个未成对电子且此能级无空轨道。下列说法正确的是
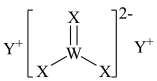
A.简单离子半径大小: | B.简单氢化物的沸点: |
C. 是由极性键构成的极性分子 是由极性键构成的极性分子 | D.甲中阴离子的空间构型为三角锥形 |
您最近一年使用:0次
2024-02-21更新
|
211次组卷
|
3卷引用:重庆市渝西中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
5 . X、Y、R、Q为前四周期元素且原子序数依次增大,X的单质与氢气可以化合生成气体G,其水溶液呈碱性;Y的一种单质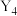 中分子为正四面体结构;R基态原子的核外有6个单电子;Q的基态原子M层电子全充满,N层只有一个电子。请回答下列问题:
中分子为正四面体结构;R基态原子的核外有6个单电子;Q的基态原子M层电子全充满,N层只有一个电子。请回答下列问题:
(1)Q元素在周期表中的位置是______ 。
(2) 价层的轨道表示式是
价层的轨道表示式是______ 。
(3)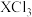 与
与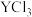 的键角大小为:
的键角大小为: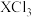
______  (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
(4)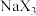 可用于安全气囊的产气药剂,
可用于安全气囊的产气药剂, 离子中中心原子的杂化方式为
离子中中心原子的杂化方式为______ 杂化。
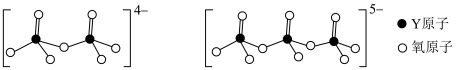
(5)如下图所示Y可形成多种含氧酸根:______ (用n代表Y原子数)。
(6)已知R元素形成的配合物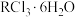 中心原子
中心原子 配位数为6,向含
配位数为6,向含 的溶液中滴加
的溶液中滴加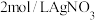 溶液,反应完全后消耗
溶液,反应完全后消耗 溶液
溶液 ,则该配离子的化学式为
,则该配离子的化学式为______ 。
(7)已知 晶体结构单元如下图所示,离H最近且等距的H的个数为
晶体结构单元如下图所示,离H最近且等距的H的个数为______ 。
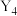 中分子为正四面体结构;R基态原子的核外有6个单电子;Q的基态原子M层电子全充满,N层只有一个电子。请回答下列问题:
中分子为正四面体结构;R基态原子的核外有6个单电子;Q的基态原子M层电子全充满,N层只有一个电子。请回答下列问题:(1)Q元素在周期表中的位置是
(2)
 价层的轨道表示式是
价层的轨道表示式是(3)
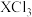 与
与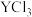 的键角大小为:
的键角大小为: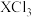
 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。(4)
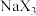 可用于安全气囊的产气药剂,
可用于安全气囊的产气药剂, 离子中中心原子的杂化方式为
离子中中心原子的杂化方式为(5)如下图所示Y可形成多种含氧酸根:
(6)已知R元素形成的配合物
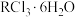 中心原子
中心原子 配位数为6,向含
配位数为6,向含 的溶液中滴加
的溶液中滴加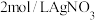 溶液,反应完全后消耗
溶液,反应完全后消耗 溶液
溶液 ,则该配离子的化学式为
,则该配离子的化学式为(7)已知
 晶体结构单元如下图所示,离H最近且等距的H的个数为
晶体结构单元如下图所示,离H最近且等距的H的个数为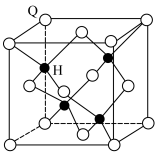
您最近一年使用:0次
名校
解题方法
6 . 向盛有少量蒸馏水的试管里滴加2滴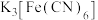 溶液,然后再滴加2滴硫氰化钾溶液。
溶液,然后再滴加2滴硫氰化钾溶液。
下列说法正确的是
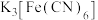 溶液,然后再滴加2滴硫氰化钾溶液。
溶液,然后再滴加2滴硫氰化钾溶液。下列说法正确的是
| A.溶液颜色由黄色变为红色 |
B. 中由 中由 提供孤电子对, 提供孤电子对, 提供空轨道 提供空轨道 |
C. 和 和 与 与 的配位能力: 的配位能力: |
D. 中含 中含 键的物质的量为 键的物质的量为 |
您最近一年使用:0次
2024-02-16更新
|
260次组卷
|
2卷引用:重庆市南开中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
7 . 光气(COCl2)是一种重要的有机中间体,其制备原理为: 。下列叙述正确的是
。下列叙述正确的是
 。下列叙述正确的是
。下列叙述正确的是| A.CHCl3是含有极性共价键的非极性分子 | B.H2O2中氧原子的杂化方式为sp2杂化 |
| C.COCl2的VSEPR模型为三角锥形 | D.HCl的沸点是同族氢化物中最低的 |
您最近一年使用:0次
2024-02-16更新
|
224次组卷
|
2卷引用:重庆市南开中学2023-2024学年高二上学期期末考试化学试题
8 . 下列说法不正确的是
| A.2p和3p轨道形状均为哑铃形 |
| B.分于晶体中,分子间作用力越大,对应的物质越稳定 |
| C.冠醚利用不同大小的空穴适配不同大小的碱金属离子进行“分子识别” |
| D.测定某一固体是否是晶体可用X射线衍射仪进行实验 |
您最近一年使用:0次
2024-02-16更新
|
201次组卷
|
2卷引用:重庆市南开中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
9 . 关于第Ⅳ 族的元素——碳(
族的元素——碳( )、硅(
)、硅( )、锗(
)、锗( )、锡(
)、锡( )和铅(
)和铅( ),它们可形成许多结构各异的物质。回答下列问题:
),它们可形成许多结构各异的物质。回答下列问题:
(1)基态 原子的价电子轨道表示式为
原子的价电子轨道表示式为______ ,有______ 种不同运动状态的电子。
(2) 中
中 原子的杂化类型是
原子的杂化类型是______ , 的空间结构是
的空间结构是______ 。
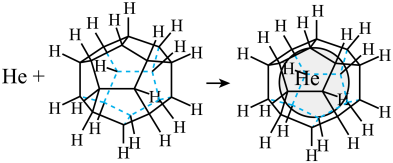
(3)1999年,科学家成功地将一个 原子“装入”了一个
原子“装入”了一个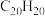 的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为
的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为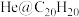 )。则
)。则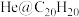 中,
中, 与
与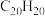 之间的作用力为
之间的作用力为______ 。
(4)第Ⅳ 族的金属元素可形成
族的金属元素可形成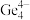 、
、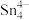 和
和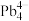 等阴离子,根据等电子体原理判断,
等阴离子,根据等电子体原理判断,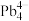 中的键角为
中的键角为______ 。
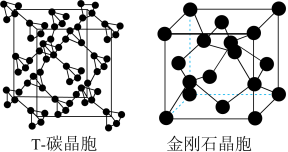
(5)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成 碳,
碳, 碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,
碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,
碳的密度约为金刚石的一半 , 碳晶体的晶胞、金刚石的晶胞如图所示。则
碳晶体的晶胞、金刚石的晶胞如图所示。则 碳晶胞的棱长是金刚石晶胞棱长的
碳晶胞的棱长是金刚石晶胞棱长的______ 倍。
(6) 与碱金属形成的盐具有特别的意义,他们能在低温时转变为超导材料。
与碱金属形成的盐具有特别的意义,他们能在低温时转变为超导材料。 与
与 形成的一种超导材料的晶胞如图所示,图中白球表示
形成的一种超导材料的晶胞如图所示,图中白球表示 ,黑球表示钾原子。
,黑球表示钾原子。
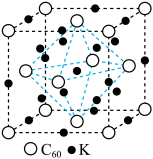
①该材料的化学式是____________ 。
②已知晶胞边长为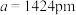 ,则该超导材料的理论密度为
,则该超导材料的理论密度为
____________  (写出表达式)。
(写出表达式)。
 族的元素——碳(
族的元素——碳( )、硅(
)、硅( )、锗(
)、锗( )、锡(
)、锡( )和铅(
)和铅( ),它们可形成许多结构各异的物质。回答下列问题:
),它们可形成许多结构各异的物质。回答下列问题:(1)基态
 原子的价电子轨道表示式为
原子的价电子轨道表示式为(2)
 中
中 原子的杂化类型是
原子的杂化类型是 的空间结构是
的空间结构是(3)1999年,科学家成功地将一个
 原子“装入”了一个
原子“装入”了一个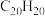 的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为
的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为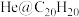 )。则
)。则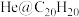 中,
中, 与
与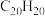 之间的作用力为
之间的作用力为
(4)第Ⅳ
 族的金属元素可形成
族的金属元素可形成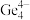 、
、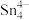 和
和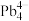 等阴离子,根据等电子体原理判断,
等阴离子,根据等电子体原理判断,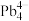 中的键角为
中的键角为(5)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成
 碳,
碳, 碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,
碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,
 碳晶体的晶胞、金刚石的晶胞如图所示。则
碳晶体的晶胞、金刚石的晶胞如图所示。则 碳晶胞的棱长是金刚石晶胞棱长的
碳晶胞的棱长是金刚石晶胞棱长的
(6)
 与碱金属形成的盐具有特别的意义,他们能在低温时转变为超导材料。
与碱金属形成的盐具有特别的意义,他们能在低温时转变为超导材料。 与
与 形成的一种超导材料的晶胞如图所示,图中白球表示
形成的一种超导材料的晶胞如图所示,图中白球表示 ,黑球表示钾原子。
,黑球表示钾原子。
①该材料的化学式是
②已知晶胞边长为
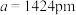 ,则该超导材料的理论密度为
,则该超导材料的理论密度为
 (写出表达式)。
(写出表达式)。
您最近一年使用:0次
2024-02-14更新
|
241次组卷
|
2卷引用:重庆市西南大学附中2023-2024学年高二上学期期末考试化学试题
名校
解题方法
10 . 下列事实中,不能能用勒夏特列原理解释的是
| A.实验室可用浓氨水和氢氧化钠固体快速制取氨气 |
| B.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 |
C.对于2HI(g)  H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
| D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
您最近一年使用:0次



