1 . 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是
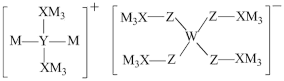
A.氢化物沸点: | B.原子半径: |
C.第一电离能: | D.阴、阳离子中均有配位键 |
您最近一年使用:0次
2021-09-13更新
|
12058次组卷
|
34卷引用:重庆市万州第二高级中学2021-2022学年高二下学期期末考试化学试题
重庆市万州第二高级中学2021-2022学年高二下学期期末考试化学试题山东省菏泽市单县第二中学2021-2022学年高二下学期慧光班段考化学试题2021年新高考辽宁化学高考真题湖北省华中师范大学第一附属中学2021-2022学年高二上学期期中检测化学试题2021年辽宁高考化学试题变式题11-19辽宁省朝阳市建平县实验中学2021-2022学年高二下学期第一次月考化学试题福建省厦门集美中学2021-2022学年高二下学期第一次月考化学试题浙江省宁波市六校2021-2022学年高二下学期期中联考化学试题(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷06题 元素周期表元素周期律-备战2022年高考化学临考题号押题(新高考通版)天津市第一中学2022届高三下学期5月月考化学试题(已下线)专题06 物质结构元素周期律-三年(2020-2022)高考真题分项汇编福建省福州第一中学2021-2022学年高二下学期期中考试化学试题(已下线)专题讲座(五) “位-构-性”综合推断题的解题方法(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第29讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)题型78 基于物质结构考查元素周期律北京市平谷区2022-2023学年高三下学期质量监控(零模)化学试题山西省太原市第五中学2022-2023学年高二下学期3月月考化学试题(已下线)专题07 元素周期表与元素周期律河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题黑龙江省富锦市第一中学2022-2023学年高二下学期第二次考试化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二下学期期中考试化学试题(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖北武汉市硚口区2023-2024学年高三起点质量检测化学试题吉林省长春市新解放学校2022-2023学年高二下学期4月月考化学试题辽宁省六校协作体2023-2024学年高三上学期11月期中考试化学试题(已下线)题型01 元素位-构-性推断-2024年高考化学答题技巧与模板构建天津市第四中学2023-2024学年高三上学期第二次月考化学试卷湖南省永州市第一中学2023-2024学年高二下学期开学考试化学试题(已下线)选择题6-10福建省泉州市泉港区第一中学2023-2024学年高二下学期3月月考化学试题(已下线)选择题6-10
名校
解题方法
2 . 化合物G是合成新型免疫调节剂来那度胺的重要中间体,其合成路线如下:
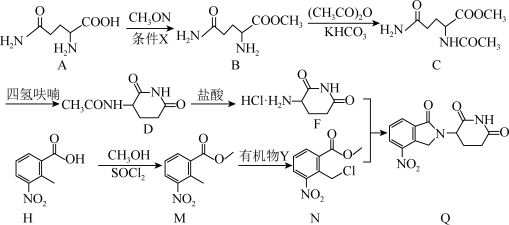
已知:有机物Y为N−氯代丁二酰亚胺
(1)A分子中碳原子的杂化方式为_______ 。
(2)A→B反应的条件X是_______ 。
(3)D、F相对分子质量接近,F熔点高于D的原因是_______ 。
(4)M的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式_______ 。
①能发生银镜反应和水解反应,且含苯环。
②分子中有4种不同化学环境的氢原子,其个数比为3∶2∶2∶1。
(5)已知:RCH2Br RCH2CN
RCH2CN
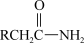 ,写出以甲苯、苯甲酸和CH3CH2OH为原料制备
,写出以甲苯、苯甲酸和CH3CH2OH为原料制备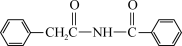 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)_______ 。

已知:有机物Y为N−氯代丁二酰亚胺
(1)A分子中碳原子的杂化方式为
(2)A→B反应的条件X是
(3)D、F相对分子质量接近,F熔点高于D的原因是
(4)M的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式
①能发生银镜反应和水解反应,且含苯环。
②分子中有4种不同化学环境的氢原子,其个数比为3∶2∶2∶1。
(5)已知:RCH2Br
 RCH2CN
RCH2CN
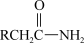 ,写出以甲苯、苯甲酸和CH3CH2OH为原料制备
,写出以甲苯、苯甲酸和CH3CH2OH为原料制备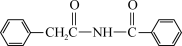 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
您最近一年使用:0次
2021-09-08更新
|
155次组卷
|
2卷引用:重庆市缙云教育联盟2022-2023学年高二下学期6月期末考试化学试题
名校
3 . 我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1). 太阳能电池板主要材料为单晶硅或多晶硅。
①基态硅原子的价电子排布式为___________ ,核外电子占据的最高能层符号为___________ 。
②硅和卤素单质反应可以得到SiX4,SiX4的熔沸点如下表所示:
0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是___________ (填化学式),沸点依次升高的原因是___________ ,SiX4分子的空间构型是___________ 。
(2). 1molCO2分子中存在___________ 个 键,写出与它互为等电子体的一种阴离子:
键,写出与它互为等电子体的一种阴离子:___________ 。
(3). 由Cu、O构成的一种化合物常作为反应的催化剂,其晶胞结构如下图所示,该物质的化学式为___________ ;若相邻的Cu原子和O原子间的距离为acm,设阿伏加德罗常数的数值为NA,则该晶体的密度为___________ g·cm-3(用含a、NA的代数式表示)。
(1). 太阳能电池板主要材料为单晶硅或多晶硅。
①基态硅原子的价电子排布式为
②硅和卤素单质反应可以得到SiX4,SiX4的熔沸点如下表所示:
| SiF4 | SiCl4 | SiBr4 | SiI4 | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
(2). 1molCO2分子中存在
 键,写出与它互为等电子体的一种阴离子:
键,写出与它互为等电子体的一种阴离子:(3). 由Cu、O构成的一种化合物常作为反应的催化剂,其晶胞结构如下图所示,该物质的化学式为

您最近一年使用:0次
2021-08-04更新
|
612次组卷
|
4卷引用:重庆南开中学2020-2021学年高二下学期期末考试化学试题
重庆南开中学2020-2021学年高二下学期期末考试化学试题天津市第三十二中学2021-2022学年高二下学期期末质量检测化学试题(已下线)综合01 物质结构与性质压轴80题-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)四川省绵阳南山中学2021-2022学年高二下学期开学考试理综化学试题
名校
解题方法
4 . 中科院化学所李玉良院士的团队首次利用六炔基苯在铜片的催化作用下发生偶联反应,成功地合成了新型可导电全碳纳米结构材料——石墨炔。下列说法错误的是


| A.六炔基苯的分子式为C18H6 |
| B.由六炔基苯合成石墨炔的反应属于加聚反应 |
| C.石墨炔中碳原子的杂化类型有sp杂化和sp2杂化 |
| D.石墨炔中每个碳原子均有p轨道相互平行且相互重叠,p轨道电子可在整个碳原子平面内运动,所以石墨炔具有导电性 |
您最近一年使用:0次
名校
解题方法
5 . NA代表阿伏加德罗常数的值。下列说法错误的是
A.0.5 mol配合物 [TiCl(H2O)5]Cl2中含有的 键数目为8NA 键数目为8NA |
| B.1 mol乙酸乙酯在酸性条件下水解,生成乙醇分子的数目为NA |
| C.28 g乙烯与环丙烷(C3H6) 的混合气体中含有的C-H键数目为4NA |
D.1 mol雄黄(As4S4,结构为 )含有的As-As键数目为2NA )含有的As-As键数目为2NA |
您最近一年使用:0次
6 . 配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法正确的是
| A.配离子为[Fe(CN)5(NO)]2-,中心离子为Fe2+,配位数为6 |
| B.向该配合物的溶液中滴加NaOH溶液,有红褐色沉淀产生 |
| C.该物质存在金属键 |
| D.该配合物为离子化合物,易电离,1mol配合物电离得到的离子数为3NA |
您最近一年使用:0次
2021-06-28更新
|
166次组卷
|
2卷引用:重庆市万州第二高级中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
7 . 下列有关化学用语表述或性质比较正确的是
A.基态氧原子核外价电子排布轨道表示式 |
| B.磷化铜(Cu3P2)用于制造磷青铜,电负性:Cu<P |
C.用原子轨道描述氢分子中化学键的形成: |
D.在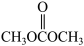 分子中, C 原子和O 原子均为 sp3杂化 分子中, C 原子和O 原子均为 sp3杂化 |
您最近一年使用:0次
2021-04-05更新
|
795次组卷
|
7卷引用:重庆市万州第二高级中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
8 . 我国已经形成对全球稀土产业链的统治力,在稀土开采技术方面,我国遥遥领先,无论是美国的芒廷帕斯还是澳大利亚的稀土矿山,均为在我国技术的参与下才实现产出。我国科学家最早研究的是稀土—钴化合物的结构。请回答下列问题:
(1)钴原子的价层电子排布图为_________ ,其 层上共有
层上共有______ 个不同运动状态的电子。
(2)酞菁钴结构如图所示。
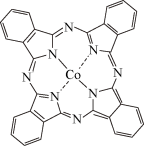
①酞菁钴中氮原子的杂化类型是________ 。
②酞菁钴中所含元素原子的第一电离能由大到小的顺序是_________ 。
③酞菁钴中三种非金属元素原子的电负性由小到大的顺序为________ 。
④酞菁钴中 、
、 原子分别与
原子分别与 原子可形成
原子可形成 和
和 ,
, 的沸点高于
的沸点高于 ,其原因是
,其原因是________ 。
(3)稀土钴系 永磁合金的六方晶胞结构如右图所示【晶体结构可看成如图(a)、(b)两种原子层交替堆积排列而成图(c)】。已知同一原子层的
永磁合金的六方晶胞结构如右图所示【晶体结构可看成如图(a)、(b)两种原子层交替堆积排列而成图(c)】。已知同一原子层的 的最近距离为
的最近距离为 ,不同原子层间
,不同原子层间 的最近距离为
的最近距离为 。
。

① 永磁合金的化学式为
永磁合金的化学式为_________ 。
②已知阿伏加 德罗常数的值为 ,则该合金的密度
,则该合金的密度 为
为________  (相对原子质量
(相对原子质量 ,
,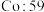 )。
)。
(1)钴原子的价层电子排布图为
 层上共有
层上共有(2)酞菁钴结构如图所示。

①酞菁钴中氮原子的杂化类型是
②酞菁钴中所含元素原子的第一电离能由大到小的顺序是
③酞菁钴中三种非金属元素原子的电负性由小到大的顺序为
④酞菁钴中
 、
、 原子分别与
原子分别与 原子可形成
原子可形成 和
和 ,
, 的沸点高于
的沸点高于 ,其原因是
,其原因是(3)稀土钴系
 永磁合金的六方晶胞结构如右图所示【晶体结构可看成如图(a)、(b)两种原子层交替堆积排列而成图(c)】。已知同一原子层的
永磁合金的六方晶胞结构如右图所示【晶体结构可看成如图(a)、(b)两种原子层交替堆积排列而成图(c)】。已知同一原子层的 的最近距离为
的最近距离为 ,不同原子层间
,不同原子层间 的最近距离为
的最近距离为 。
。
①
 永磁合金的化学式为
永磁合金的化学式为②已知阿伏加 德罗常数的值为
 ,则该合金的密度
,则该合金的密度 为
为 (相对原子质量
(相对原子质量 ,
,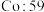 )。
)。
您最近一年使用:0次
名校
解题方法
9 . 中国较早时期就有炼铜、炼锌技术的记录,铜、锌元素也是人体必需的微量元素之一。回答下列问题:
(1)基态Cu原子核外的最高能层符号是______ ,基态Zn原子的价电子排布式为______ 。
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,非金属元素的电负性由大到小排序为_____ 。
(3)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是______ 。
(4)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O═[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子的杂化类型是___ 。
②与H2O分子互为等电子体的阴离子为_____ 。(只答一种)
③[Zn(CN)4]2-中Zn2+与碳原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为____ 。
(5)金属锌晶体的晶胞如图所示,若锌原子的半径为r nm,则金属锌晶体的空间利用率是______ (用含r、π的代数式表示)。

(1)基态Cu原子核外的最高能层符号是
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,非金属元素的电负性由大到小排序为
(3)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是
(4)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O═[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子的杂化类型是
②与H2O分子互为等电子体的阴离子为
③[Zn(CN)4]2-中Zn2+与碳原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
(5)金属锌晶体的晶胞如图所示,若锌原子的半径为r nm,则金属锌晶体的空间利用率是

您最近一年使用:0次
解题方法
10 . 我国化学家合成的铬的化合物,通过烷基铝和[ph3C]+[B(C6F5)4]-活化后,对乙烯聚合表现出较好的催化活性。合成铭的化合物过程中一步反应如下,该反应涉及H、C、N、O、Cl、Cr等多种元素。
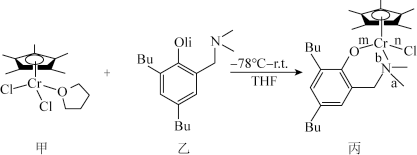
回答下列问题:
(1)下列状态的氯中,电离最外层一个电子所需能量最大的是_____________ (填标号)。
A. B.
B.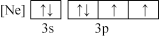
C. D.
D.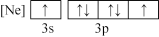
(2)化合物乙中碳原子采取的杂化方式为______ ,化合物丙中a、b、n、m处的化学键是配位键的是______ (填字母)处。
(3)Cr3+具有较强的稳定性,Cr3+的核外电子排布式为______ ;已知没有未成对d电子的过渡金属离子形成的水合离子是无色的,Ti4+、V3+、Ni2+三种离子的水合离子为无颜色的是______ (填离子符号)。
(4)ClO3-的键角小于ClO4-的键角,原因是______ 。
(5)根据结构与性质的关系解释,HNO2的酸性比HNO3弱的原因:______ 。
(6)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。其中重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y、z轴的投影图如图所示,晶体中的H2O配位数为_____ 晶胞边长为a pm,则重冰的密度为____ g·cm-3(写出数学表达式,NA为阿伏加 德罗常数)。
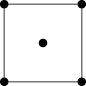

回答下列问题:
(1)下列状态的氯中,电离最外层一个电子所需能量最大的是
A.
 B.
B.
C.
 D.
D.
(2)化合物乙中碳原子采取的杂化方式为
(3)Cr3+具有较强的稳定性,Cr3+的核外电子排布式为
(4)ClO3-的键角小于ClO4-的键角,原因是
(5)根据结构与性质的关系解释,HNO2的酸性比HNO3弱的原因:
(6)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。其中重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y、z轴的投影图如图所示,晶体中的H2O配位数为

您最近一年使用:0次
2020-06-22更新
|
270次组卷
|
2卷引用:重庆市缙云教育联盟2020-2021学年高一下学期期末质量检测化学试题



