1 . 法国一家公司研发出一种比锂电池成本更低、寿命更长、充电速度更快的钠离子电池,该电池的负极材料为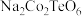 (制备原料为
(制备原料为 、
、 和
和 ),电解液为
),电解液为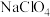 的碳酸丙烯酯溶液。回答下列问题:
的碳酸丙烯酯溶液。回答下列问题:
(1)基态Na原子中,核外电子占据的原子轨道总数为_______ ,Te属于元素周期表中_______ 区元素,其基态原子的价电子排布式为_______ 。
(2) 的空间结构为
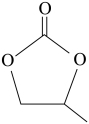
的空间结构为_______ ,碳酸丙烯酯的结构简式如图所示,其中碳原子的杂化轨道类型为_______ ,1mol碳酸丙烯酯中 键的数目为
键的数目为_______ 。
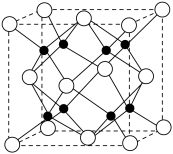
(3)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为_______ ,该晶胞的密度为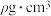 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Na与O之间的最短距离为
,则Na与O之间的最短距离为_______ cm(用含有 、
、 的代数式表示)。
的代数式表示)。
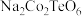 (制备原料为
(制备原料为 、
、 和
和 ),电解液为
),电解液为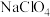 的碳酸丙烯酯溶液。回答下列问题:
的碳酸丙烯酯溶液。回答下列问题:(1)基态Na原子中,核外电子占据的原子轨道总数为
(2)
 的空间结构为
的空间结构为 键的数目为
键的数目为
(3)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Na与O之间的最短距离为
,则Na与O之间的最短距离为 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
2 . 顺铂的结构简式为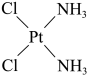 ,具有抗癌作用;反铂的结构简式为
,具有抗癌作用;反铂的结构简式为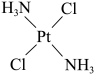 ,无抗癌作用;碳铂的结构简式为
,无抗癌作用;碳铂的结构简式为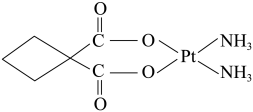 。顺铂进入人体后,一个氧原子缓慢被水分子取代,形成
。顺铂进入人体后,一个氧原子缓慢被水分子取代,形成 。请回答下列问题:
。请回答下列问题:
(1)下列说法正确的是_______(填序号)。
(2)根据碳铂的结构简式推断,1mol1,1—环丁二羧酸中含有 键的数目为
键的数目为_______ 。
(3)顺铂和反铂的物理性质有很大差异,其中只有_______ 易溶于水,原因是_______ 。
(4)乙烯酮分子中碳原子的杂化类型为_______ ;乙烯酮在一定条件下可聚合成双乙烯酮(结构简式为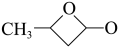 ),双乙烯酮分子中含有的
),双乙烯酮分子中含有的 键和
键和 键的数目之比为
键的数目之比为_______ 。
(5)由于氢键的存在,乙酸分子间也可形成二聚体(含八元环),该二聚体的结构为_______ 。
 ,具有抗癌作用;反铂的结构简式为
,具有抗癌作用;反铂的结构简式为 ,无抗癌作用;碳铂的结构简式为
,无抗癌作用;碳铂的结构简式为 。顺铂进入人体后,一个氧原子缓慢被水分子取代,形成
。顺铂进入人体后,一个氧原子缓慢被水分子取代,形成 。请回答下列问题:
。请回答下列问题:(1)下列说法正确的是_______(填序号)。
| A.碳铂分子中有一个手性碳原子 |
| B.反铂属于极性分子 |
| C.碳铂的中心原子铂的配位数为4 |
D. 中 中 的H原子与Pt形成配位键 的H原子与Pt形成配位键 |
 键的数目为
键的数目为(3)顺铂和反铂的物理性质有很大差异,其中只有
(4)乙烯酮分子中碳原子的杂化类型为
 ),双乙烯酮分子中含有的
),双乙烯酮分子中含有的 键和
键和 键的数目之比为
键的数目之比为(5)由于氢键的存在,乙酸分子间也可形成二聚体(含八元环),该二聚体的结构为
您最近一年使用:0次
3 . 对下列事实的解释不正确的是
| 选项 | 事实 | 解释 |
| A | 在水中,HCl的溶解度比 的溶解度大 的溶解度大 | 根据相似相溶原理,氯化氢为极性分子,易溶于极性的水中,而碘单质为非极性分子,不易溶于水 |
| B | 氯化钠的晶体中, 可以吸引不同方向的6个 可以吸引不同方向的6个 | 离子键具有饱和性和方向性 |
| C |  溶液中滴加过量氨水,先出现蓝色沉淀后沉淀溶解变为深蓝色溶液 溶液中滴加过量氨水,先出现蓝色沉淀后沉淀溶解变为深蓝色溶液 |  与 与 形成的配位键更稳定 形成的配位键更稳定 |
| D | 铜金属具有良好的导电性 | 铜金属中有“自由电子” |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 下列各组微粒,中心原子均采用sp2杂化方式的
A.NH3,PCl3,CO ,CO2 ,CO2 | B.SO3,NO ,COCl2,BF3 ,COCl2,BF3 |
C.SO ,ClO ,ClO ,PO ,PO ,BF3 ,BF3 | D.BeCl2,NCl3,NO ,ClO ,ClO |
您最近一年使用:0次
2022-05-06更新
|
228次组卷
|
2卷引用:重庆市万州第二高级中学2021-2022学年高二下学期期末考试化学试题
名校
5 . I.离子液体是一种由离子构成的很有研究价值的溶剂,研究显示最常见的离子液体主要由如图1所示正离子和负离子构成,图1中正离子有令人惊奇的稳定性。
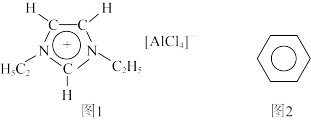
(1)下列关于离子液体的说法正确的是_______ 。
A.该化合物中不存在非极性键和氢键
B.图中负离子的空间结构为正四面体形
C.图中正离子中碳原子的杂化方式为sp2、sp3
(2)分子中的大π键可用符号 表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数(图2为苯分子的结构简式,苯分子中的大π键可表示为
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数(图2为苯分子的结构简式,苯分子中的大π键可表示为 ),则图1正离子中的大π键表示为
),则图1正离子中的大π键表示为_______ 。
II.研究元素周期表右上角区域元素,有利于研发新型绿色农药,如:
(3)基态S原子核外电子排布式为_______ 。
(4)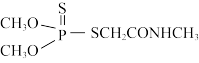 中所含元素H、O、P、S的电负性从大到小的顺序为
中所含元素H、O、P、S的电负性从大到小的顺序为_______ ; 的沸点是
的沸点是 ,
, 的沸点是
的沸点是 ,
, 的沸点远高于
的沸点远高于 的沸点的原因是
的沸点的原因是_______ 。
(5)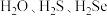 中最稳定的是
中最稳定的是_______ (填化学式,下同),还原性最强的是_______ 。
(6)已知酸性: .推测酸性:
.推测酸性:
_______ (填“>”或“<”) 。3-氯-2-丁氨酸的结构简式为
。3-氯-2-丁氨酸的结构简式为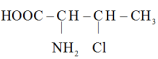 ,该有机物1个分子中含有
,该有机物1个分子中含有_______ 个手性碳原子。

(1)下列关于离子液体的说法正确的是
A.该化合物中不存在非极性键和氢键
B.图中负离子的空间结构为正四面体形
C.图中正离子中碳原子的杂化方式为sp2、sp3
(2)分子中的大π键可用符号
 表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数(图2为苯分子的结构简式,苯分子中的大π键可表示为
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数(图2为苯分子的结构简式,苯分子中的大π键可表示为 ),则图1正离子中的大π键表示为
),则图1正离子中的大π键表示为II.研究元素周期表右上角区域元素,有利于研发新型绿色农药,如:
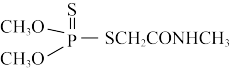
(3)基态S原子核外电子排布式为
(4)
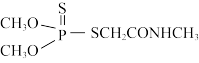 中所含元素H、O、P、S的电负性从大到小的顺序为
中所含元素H、O、P、S的电负性从大到小的顺序为 的沸点是
的沸点是 ,
, 的沸点是
的沸点是 ,
, 的沸点远高于
的沸点远高于 的沸点的原因是
的沸点的原因是(5)
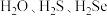 中最稳定的是
中最稳定的是(6)已知酸性:
 .推测酸性:
.推测酸性:
 。3-氯-2-丁氨酸的结构简式为
。3-氯-2-丁氨酸的结构简式为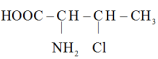 ,该有机物1个分子中含有
,该有机物1个分子中含有
您最近一年使用:0次
名校
6 . 周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,A、B、D、E、F、G、W、Q各代表一种化学元素。请用元素符号及其物质回答下列问题.
(1)W位于周期表_______ 区;基态Q原子核外简化电子排布式为_______ ;
(2)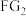 中心原子杂化轨道类型:
中心原子杂化轨道类型:_______ ;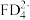 的
的 模型名称:
模型名称:_______ ;
(3)E、F、G三元素第一电离能从大到小的顺序是_______ ;
(4)化合物AD与 溶液反应的离子方程式为
溶液反应的离子方程式为_______ ;
(5)有机物甲由B、氢、D三种元素的原子按个数比为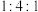 组成,可通过电解法由
组成,可通过电解法由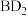 制取,用稀硫酸作电解质溶液,写出生成有机物甲的电极反应式:
制取,用稀硫酸作电解质溶液,写出生成有机物甲的电极反应式:_______ ,有机物甲也可作为燃料电池的原料,写出该燃料电池在碱性条件下的负极反应式:_______ 。
| A | B | D | |||||||||||||||
| E | F | G | |||||||||||||||
| W | Q |
(2)
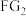 中心原子杂化轨道类型:
中心原子杂化轨道类型: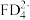 的
的 模型名称:
模型名称:(3)E、F、G三元素第一电离能从大到小的顺序是
(4)化合物AD与
 溶液反应的离子方程式为
溶液反应的离子方程式为(5)有机物甲由B、氢、D三种元素的原子按个数比为
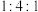 组成,可通过电解法由
组成,可通过电解法由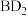 制取,用稀硫酸作电解质溶液,写出生成有机物甲的电极反应式:
制取,用稀硫酸作电解质溶液,写出生成有机物甲的电极反应式:
您最近一年使用:0次
名校
7 . 我国科学家发现了一类由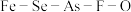 组成的磁性超导材料。下列说法不正确的是
组成的磁性超导材料。下列说法不正确的是
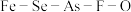 组成的磁性超导材料。下列说法不正确的是
组成的磁性超导材料。下列说法不正确的是A. 变成 变成 时失去 时失去 轨道电子 轨道电子 |
B.基态 原子核外有2个未成对电子 原子核外有2个未成对电子 |
C.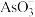 的空间结构为平面三角形 的空间结构为平面三角形 |
| D.基态F原子的核外电子有9种空间运动状态 |
您最近一年使用:0次
名校
8 . 下列说法正确的是
A.CO2分子中σ键和π键的数目之比为 |
| B.SO2和CS2均为V形分子 |
C.NCl3分子中的键角为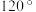 |
D.SiF4和 的中心原子均为sp3杂化 的中心原子均为sp3杂化 |
您最近一年使用:0次
2022-04-04更新
|
668次组卷
|
7卷引用:重庆市西南大学附属中学校2021--2022学年高二上学期期末考试化学试题
名校
解题方法
9 . 铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态价电子排布式为_______ ;Cu2O和Cu2S都是离子晶体,两种晶体熔点较高的是_______ ,原因是_______ 。
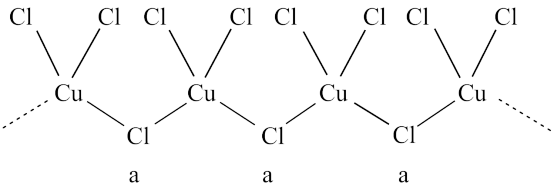
(2)氯和钾与不同价态的铜(+1、+2)可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为_______ ;已知其中一种化合物的化学式为KCuCl3,另一种可能的化学式为_______ 。
(3)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是_______ ,反应的化学反应程式为_______ 。
(4)铜镍合金的立方晶胞结构如下图所示:
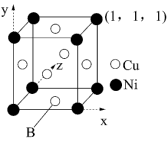
①原子B的分数坐标为_______ ;
②若该晶体密度为dg·cm-3,以NA表示阿伏加德罗常数,则铜镍原子间最短距离为_______ pm。
(1)铜原子基态价电子排布式为
(2)氯和钾与不同价态的铜(+1、+2)可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为

(3)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是
(4)铜镍合金的立方晶胞结构如下图所示:

①原子B的分数坐标为
②若该晶体密度为dg·cm-3,以NA表示阿伏加德罗常数,则铜镍原子间最短距离为
您最近一年使用:0次
10 . 钒、钨、锌在工业上用途广泛。
(1)基态钒(V)元素在周期表中的位置为_______ ,其最高化合价为_______ ,与其同周期且未成对电子数相同的元素符号为_______ ;
(2)钒能形成多种配合物。钒的两种配合物X、Y化学式均为V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来),所用试剂及所得现象如表所示:
则X的配离子为_______ ,Y的配体为_______ 。
(3)NaxWO3是一类色彩丰富的非整比化合物,其晶体结构如图2所示,若Na+无空缺,化学式为NaWO3,完全空缺则为WO3,每填入1个Na+,相应有1个W6+还原为W5+。NaxWO3的颜色与x值的对应关系如图1所示,已知NaxWO3晶体中n(W6+):n(W5+)=2:3,则其颜色为_______ 色。

(4)如图3是金属钨晶体中的一个晶胞的结构模型(原子间实际是相互接触的)。其中心的原子位于立方体的体心。实验测得金属钨的半径为rcm,假定金属钨为等直径的刚性球,请回答以下各题:

①每一个晶胞中分摊到_______ 个钨原子。
②计算晶胞的空间利用率_______ (写出表达式,不计算具体数值)。
(1)基态钒(V)元素在周期表中的位置为
(2)钒能形成多种配合物。钒的两种配合物X、Y化学式均为V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来),所用试剂及所得现象如表所示:
| 原溶液 | X溶液 | X溶液 | Y溶液 | Y溶液 |
| 所加试剂 | BaCl2溶液 | AgNO3溶液 | BaCl2溶液 | AgNO3溶液 |
| 现象 | 白色沉淀 | 无明显变化 | 无明显变化 | 白色沉淀 |
则X的配离子为
(3)NaxWO3是一类色彩丰富的非整比化合物,其晶体结构如图2所示,若Na+无空缺,化学式为NaWO3,完全空缺则为WO3,每填入1个Na+,相应有1个W6+还原为W5+。NaxWO3的颜色与x值的对应关系如图1所示,已知NaxWO3晶体中n(W6+):n(W5+)=2:3,则其颜色为

(4)如图3是金属钨晶体中的一个晶胞的结构模型(原子间实际是相互接触的)。其中心的原子位于立方体的体心。实验测得金属钨的半径为rcm,假定金属钨为等直径的刚性球,请回答以下各题:

①每一个晶胞中分摊到
②计算晶胞的空间利用率
您最近一年使用:0次



