1 .  由于核外有空的d轨道,可与一些配体形成配位数为6的配离子。某同学将淡紫色的
由于核外有空的d轨道,可与一些配体形成配位数为6的配离子。某同学将淡紫色的 晶体溶于水后再依次加KSCN和NaF,发现溶液出现下列变化:
晶体溶于水后再依次加KSCN和NaF,发现溶液出现下列变化:
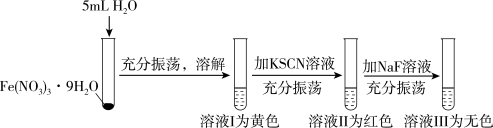
已知: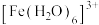 为浅紫色,
为浅紫色,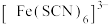 为红色,
为红色,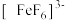 为无色。
为无色。
下列说法错误的是
 由于核外有空的d轨道,可与一些配体形成配位数为6的配离子。某同学将淡紫色的
由于核外有空的d轨道,可与一些配体形成配位数为6的配离子。某同学将淡紫色的 晶体溶于水后再依次加KSCN和NaF,发现溶液出现下列变化:
晶体溶于水后再依次加KSCN和NaF,发现溶液出现下列变化:
已知:
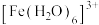 为浅紫色,
为浅紫色,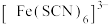 为红色,
为红色,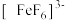 为无色。
为无色。下列说法错误的是
A. 晶体溶于水后溶液不是浅紫色而是黄色,是因为 晶体溶于水后溶液不是浅紫色而是黄色,是因为 水解生成 水解生成 所致 所致 |
B. 与 与 形成配位键时,S原子提供孤电子对 形成配位键时,S原子提供孤电子对 |
C.溶液Ⅱ加NaF后溶液由红色变为无色,说明 与 与 配位键强度不及 配位键强度不及 与 与 配位键强度 配位键强度 |
| D.焰色试验中可用无锈铁丝替代铂丝,说明铁灼烧时无焰色且不会产生发射光谱 |
您最近一年使用:0次
2022-12-09更新
|
978次组卷
|
3卷引用:重庆市万州第二高级中学2022-2023学年高三上学期1月质量检测化学试题
名校
解题方法
2 . 秦始皇帝陵博物院首次在兵马俑的彩绘中发现了古人人工合成的“中国蓝”“中国紫”颜料。人们对这些颜料的研究发现,其成分主要是钡和铜的硅酸盐(BaCuSixOy)。
回答下列问题:
(1)基态铜原子的电子排布式为____ 。“中国蓝”的发色中心是以Cu2+为中心的配位化合物,形成该配位键,Cu2+提供____ ,若“中国蓝”的化学组成中x:y=1:3,则其化学式为____ 。
(2)“中国蓝”“中国紫”中存在SiO 四面体结构,其中Si原子采取的杂化类型为
四面体结构,其中Si原子采取的杂化类型为___ 。与SiO 不同,CO
不同,CO 的立体构型为
的立体构型为____ 。
(3)C和Si同主族,但CO2与SiO2的熔沸点差异很大,这是因为CO2是____ 晶体,而SiO2是___ 晶体。
(4)MgO的熔沸点____ BaO(填“>”“<”“=”),原因是____ 。
(5)立方CuO晶胞结构如图所示。晶胞参数为a pm,NA代表阿伏加德罗常数的值。则两个距离最近Cu2+之间的距离为____ pm(用代数式表示),其晶体密度为____ (用代数式表示)。

回答下列问题:
(1)基态铜原子的电子排布式为
(2)“中国蓝”“中国紫”中存在SiO
 四面体结构,其中Si原子采取的杂化类型为
四面体结构,其中Si原子采取的杂化类型为 不同,CO
不同,CO 的立体构型为
的立体构型为(3)C和Si同主族,但CO2与SiO2的熔沸点差异很大,这是因为CO2是
(4)MgO的熔沸点
(5)立方CuO晶胞结构如图所示。晶胞参数为a pm,NA代表阿伏加德罗常数的值。则两个距离最近Cu2+之间的距离为

您最近一年使用:0次
2022-11-13更新
|
195次组卷
|
3卷引用:重庆市缙云教育联盟2022-2023学年高二上学期期末联考化学试题
名校
解题方法
3 . 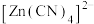 在水溶液中与HCHO发生如下反应:
在水溶液中与HCHO发生如下反应: 。下列说法正确的是
。下列说法正确的是
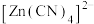 在水溶液中与HCHO发生如下反应:
在水溶液中与HCHO发生如下反应: 。下列说法正确的是
。下列说法正确的是| A.HCHO的分子构型是是三角锥形 |
B.基态 的电子排布式为 的电子排布式为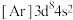 |
C.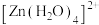 中与 中与 形成配位键的原子是H 形成配位键的原子是H |
D.1mol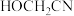 中所含 中所含 键的数目是6mol 键的数目是6mol |
您最近一年使用:0次
2022-10-07更新
|
539次组卷
|
3卷引用:重庆市万州第二高级中学2022-2023学年高三上学期1月质量检测化学试题
解题方法
4 . 硼元素及其化合物具有各异的结构与性质。氮化硼(BN)晶体有多种相结构。六方相氮化硼(I)与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼(II)是超硬材料,有优异的耐磨性。它们的晶体结构如下图所示。
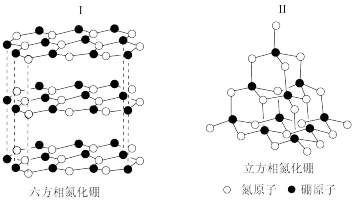
(1)基态硼原子的电子排布式为_______ ,同周期中第一电离能小于硼的元素有_______ 种。
(2)关于这两种晶体的说法,正确的是_______ (填序号)。
a.I中存在分子间作用力 b.II含有σ键和π键,所以硬度大
c.I与II结构中B:B−N的值相同 d.两种晶体中的B−N键均为共价键
(3)I中硼原子的杂化轨道类型为_______ ,判断其是否导电并说明原因_______ 。
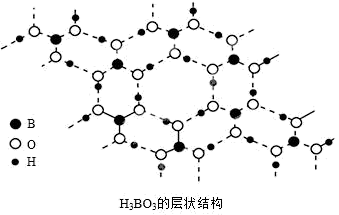
(4)常温常压下硼酸( )晶体结构为层状,其二维平面结构如图所示。1mol
)晶体结构为层状,其二维平面结构如图所示。1mol 晶体中含有
晶体中含有_______ mol氢键。
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图所示。回答下列问题:
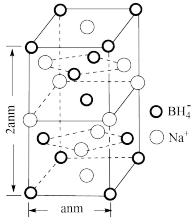
① 分子中的O−B−O的键角
分子中的O−B−O的键角_______ (填“大于”“等于”或“小于”) 中的H−B−H的键角,判断依据是
中的H−B−H的键角,判断依据是_______ 。
②晶胞参数如图所示,已知晶胞密度为 ,则阿伏加德罗常数可以表示为
,则阿伏加德罗常数可以表示为_________ ,(已知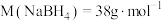 ,列出计算式即可);若硼氢化钠晶胞上下底心处的
,列出计算式即可);若硼氢化钠晶胞上下底心处的 被
被 取代,得到的晶体的化学式为
取代,得到的晶体的化学式为_______ 。

(1)基态硼原子的电子排布式为
(2)关于这两种晶体的说法,正确的是
a.I中存在分子间作用力 b.II含有σ键和π键,所以硬度大
c.I与II结构中B:B−N的值相同 d.两种晶体中的B−N键均为共价键
(3)I中硼原子的杂化轨道类型为
(4)常温常压下硼酸(
 )晶体结构为层状,其二维平面结构如图所示。1mol
)晶体结构为层状,其二维平面结构如图所示。1mol 晶体中含有
晶体中含有
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图所示。回答下列问题:

①
 分子中的O−B−O的键角
分子中的O−B−O的键角 中的H−B−H的键角,判断依据是
中的H−B−H的键角,判断依据是②晶胞参数如图所示,已知晶胞密度为
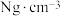 ,则阿伏加德罗常数可以表示为
,则阿伏加德罗常数可以表示为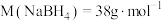 ,列出计算式即可);若硼氢化钠晶胞上下底心处的
,列出计算式即可);若硼氢化钠晶胞上下底心处的 被
被 取代,得到的晶体的化学式为
取代,得到的晶体的化学式为
您最近一年使用:0次
名校
5 . 已知 在溶液中与
在溶液中与 或
或 等可形成配位数为4的配离子。某同学通过实验研究铜盐溶液颜色的变化。下列说法不正确的是
等可形成配位数为4的配离子。某同学通过实验研究铜盐溶液颜色的变化。下列说法不正确的是
 在溶液中与
在溶液中与 或
或 等可形成配位数为4的配离子。某同学通过实验研究铜盐溶液颜色的变化。下列说法不正确的是
等可形成配位数为4的配离子。某同学通过实验研究铜盐溶液颜色的变化。下列说法不正确的是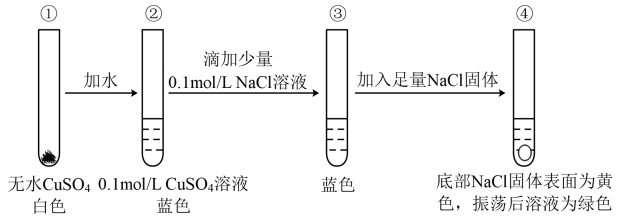
A.溶液②中形成了 , , 中有12molσ键 中有12molσ键 |
B.由④可知, 与 与 可能会结合产生黄色物质 可能会结合产生黄色物质 |
C.由②③④推测,溶液中存在: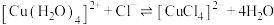 |
| D.若取少量④中溶液进行稀释,溶液依然为绿色 |
您最近一年使用:0次
2022-09-09更新
|
424次组卷
|
7卷引用:重庆市主城区七校2021-2022学年高二下学期期末联考化学试题
重庆市主城区七校2021-2022学年高二下学期期末联考化学试题天津市和平区2022-2023学年高二下学期期末质量调查化学试题(已下线)专题01 物质的结构与性质-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)四川省绵阳市江油中学2022-2023学年高二上学期10月月考化学试题四川省内江市威远中学校2022-2023学年高二上学期第二次月考(期中考试)化学试题四川省绵阳中学2022-2023学年高二上学期12月线上测试化学试题河北省石家庄市第二中学2023-2024学年高二下学期3月月考化学试题
解题方法
6 . 类推是一种常用的思维方法,但类推得出的结论需经过实践的检验才能确定其正确与否。下列几种类推结论正确的是
| A.晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子 |
| B.醋酸不能发生银镜反应,则蚁酸也不能发生银镜反应 |
| C.CO2为非极性分子,则SiO2也为非极性分子 |
D.从 、 、 为正四面体结构,则 为正四面体结构,则 、 、 也为正四面体结构 也为正四面体结构 |
您最近一年使用:0次
2022-09-09更新
|
196次组卷
|
3卷引用:重庆市主城区七校2021-2022学年高二下学期期末联考化学试题
名校
解题方法
7 . 用图示的方法能够直观形象地传授化学知识,下列图示不正确的是
 | 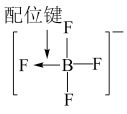 | 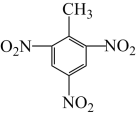 | 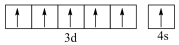 |
| A.铁原子的结构示意图 | B. 的结构式 的结构式 | C.TNT的结构简式 | D.铬原子的价层电子轨道表示式 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-09更新
|
234次组卷
|
2卷引用:重庆市主城区七校2021-2022学年高二下学期期末联考化学试题
8 . 物质世界丰富多彩,物质结构千变万化。回答下列问题:
(1)已知 熔沸点较低,常温下呈液态,易溶于有机溶剂,则
熔沸点较低,常温下呈液态,易溶于有机溶剂,则 晶体为
晶体为_______ (填晶体类型), 中含有
中含有_______  键。
键。
(2)某配合物化学式为 ,取1mol该物质溶解在水中并加热,无刺激性气味气体产生,再向其中加入过量
,取1mol该物质溶解在水中并加热,无刺激性气味气体产生,再向其中加入过量 溶液,产生2mol白色沉淀,则其中Co的化合价为
溶液,产生2mol白色沉淀,则其中Co的化合价为_______ 价,将该配合物溶于水中形成的阳离子化学式为_______ 。
(3)下图表示多硼酸根的一种无限长的链式结构,其化学式可表示为_______ 。
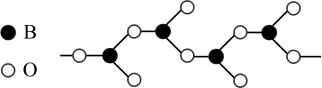
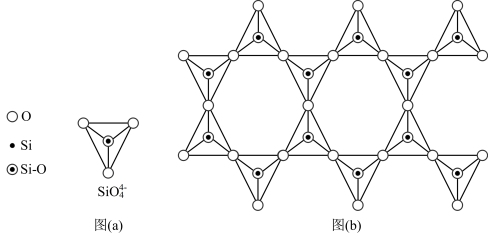
(4)天然硅酸盐组成复杂阴离子的基本结构单元是Si—O四面体,如图(a),通过共用顶角氧离子可形成链状、网状等结构,图(b)为一种无限长双链的多硅酸根,其中Si与O的原子数之比为_______ 。
(5)硫和锌可以制备得ZnS晶体,其晶胞结构如图甲所示,晶胞中 和
和 的投影位置如图乙所示。
的投影位置如图乙所示。
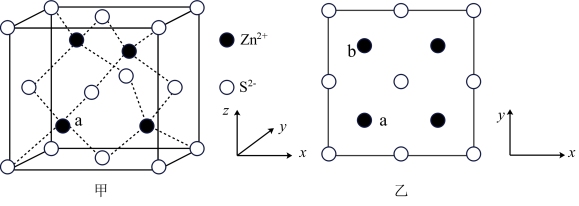
①Zn2+的电子排布式为_______ ,每个Zn2+周围距离最近的 有
有_______ 个。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子分数坐标。例如,a位置的 的坐标为(
的坐标为( ,
, ,
, ),则b位置的
),则b位置的 在图甲中对应的坐标为
在图甲中对应的坐标为_______ 。
③若a、b位置 的空间距离为a pm(核间距),设阿伏加德罗常数的值为
的空间距离为a pm(核间距),设阿伏加德罗常数的值为 ,则ZnS晶体的密度为
,则ZnS晶体的密度为_______  (列出计算表达式)。
(列出计算表达式)。
(1)已知
 熔沸点较低,常温下呈液态,易溶于有机溶剂,则
熔沸点较低,常温下呈液态,易溶于有机溶剂,则 晶体为
晶体为 中含有
中含有 键。
键。(2)某配合物化学式为
 ,取1mol该物质溶解在水中并加热,无刺激性气味气体产生,再向其中加入过量
,取1mol该物质溶解在水中并加热,无刺激性气味气体产生,再向其中加入过量 溶液,产生2mol白色沉淀,则其中Co的化合价为
溶液,产生2mol白色沉淀,则其中Co的化合价为(3)下图表示多硼酸根的一种无限长的链式结构,其化学式可表示为

(4)天然硅酸盐组成复杂阴离子的基本结构单元是Si—O四面体,如图(a),通过共用顶角氧离子可形成链状、网状等结构,图(b)为一种无限长双链的多硅酸根,其中Si与O的原子数之比为

(5)硫和锌可以制备得ZnS晶体,其晶胞结构如图甲所示,晶胞中
 和
和 的投影位置如图乙所示。
的投影位置如图乙所示。
①Zn2+的电子排布式为
 有
有②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子分数坐标。例如,a位置的
 的坐标为(
的坐标为( ,
, ,
, ),则b位置的
),则b位置的 在图甲中对应的坐标为
在图甲中对应的坐标为③若a、b位置
 的空间距离为a pm(核间距),设阿伏加德罗常数的值为
的空间距离为a pm(核间距),设阿伏加德罗常数的值为 ,则ZnS晶体的密度为
,则ZnS晶体的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
名校
解题方法
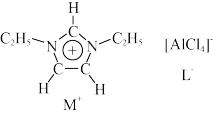
9 . 离子液体是一种由离子构成的很有研究价值的溶剂。某离子液体由如图所示正离子 和负离子
和负离子 构成,已知
构成,已知 中的五元环为平面形结构,该离子有较强的稳定性。
中的五元环为平面形结构,该离子有较强的稳定性。
(1)基态N原子中共有_______ 种运动状态不同的电子,其中占据最高能级的电子云轮廓图为_______ 形。原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为_______ 。
(2) 中的各种元素的电负性由小到大的顺序为
中的各种元素的电负性由小到大的顺序为_______ , 中碳原子的杂化方式为
中碳原子的杂化方式为_______ 。
(3)负离子 的空间构型为
的空间构型为_______ 形,基态氯原子的价层电子轨道表示式为_______ 。
(4)分子中的大 键可用符号
键可用符号 表示,其中m代表形成大
表示,其中m代表形成大 键的原子数,n代表形成大
键的原子数,n代表形成大 键的电子数。如苯(
键的电子数。如苯( )中的大
)中的大 键可表示为
键可表示为 ,则
,则 中的大
中的大 键可表示为
键可表示为_______ 。
(5)碳原子与氮原子还可形成六元环状化合物吡啶(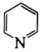 ),其分子中也含有与苯类似的
),其分子中也含有与苯类似的 大
大 键,则吡啶中N原子的孤电子对占据的轨道为
键,则吡啶中N原子的孤电子对占据的轨道为_______ (填标号)。
A.2s轨道 B.2p轨道 C.sp杂化轨道 D. 杂化轨道
杂化轨道
吡啶在水中的溶解度远大于苯,主要原因是①_______ ,②_______ 。
 和负离子
和负离子 构成,已知
构成,已知 中的五元环为平面形结构,该离子有较强的稳定性。
中的五元环为平面形结构,该离子有较强的稳定性。
(1)基态N原子中共有
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为(2)
 中的各种元素的电负性由小到大的顺序为
中的各种元素的电负性由小到大的顺序为 中碳原子的杂化方式为
中碳原子的杂化方式为(3)负离子
 的空间构型为
的空间构型为(4)分子中的大
 键可用符号
键可用符号 表示,其中m代表形成大
表示,其中m代表形成大 键的原子数,n代表形成大
键的原子数,n代表形成大 键的电子数。如苯(
键的电子数。如苯( )中的大
)中的大 键可表示为
键可表示为 ,则
,则 中的大
中的大 键可表示为
键可表示为(5)碳原子与氮原子还可形成六元环状化合物吡啶(
 ),其分子中也含有与苯类似的
),其分子中也含有与苯类似的 大
大 键,则吡啶中N原子的孤电子对占据的轨道为
键,则吡啶中N原子的孤电子对占据的轨道为A.2s轨道 B.2p轨道 C.sp杂化轨道 D.
 杂化轨道
杂化轨道吡啶在水中的溶解度远大于苯,主要原因是①
您最近一年使用:0次
名校
解题方法
10 . 已知 在一定温度下会发生二聚甚至多聚,如下图所示,下列说法中不正确的是
在一定温度下会发生二聚甚至多聚,如下图所示,下列说法中不正确的是
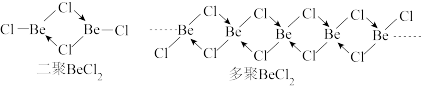
 在一定温度下会发生二聚甚至多聚,如下图所示,下列说法中不正确的是
在一定温度下会发生二聚甚至多聚,如下图所示,下列说法中不正确的是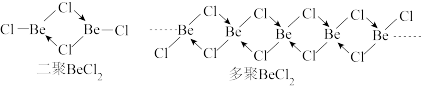
A. 单体(未聚合时)为直线型,中心原子为sp杂化 单体(未聚合时)为直线型,中心原子为sp杂化 |
B. 二聚时中心原子为 二聚时中心原子为 杂化,所有原子在同一平面 杂化,所有原子在同一平面 |
C. 多聚时Be周围的Cl呈正四面体,中心Be原子为 多聚时Be周围的Cl呈正四面体,中心Be原子为 杂化 杂化 |
| D.高温时候更容易呈现二聚或者多聚,低温时候为未聚合的单体 |
您最近一年使用:0次



