名校
解题方法
1 . 周期表前四周期的元素a、b、c、d、e原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,其次外层所有轨道均是全满状态。回答下列问题:
(1)b、c、d的简单离子半径最大的是___________ (填离子符号),e的晶胞结构中e配位数为___________ 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的电子式为___________ ;分子中既含有极性共价键、又含有非极性共价键的化合物是___________ (填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是___________ (任写一种);酸根呈三角锥结构的酸是___________ (填化学式)。
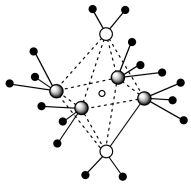
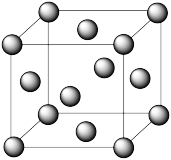
(4)e和c形成的一种离子化合物的晶体结构如图所示,则e离子的电荷为___________ 。

(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构。该化合物中,阴离子为___________ ,阳离子中存在的化学键类型有___________ 。
(1)b、c、d的简单离子半径最大的是
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的电子式为
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是
(4)e和c形成的一种离子化合物的晶体结构如图所示,则e离子的电荷为

(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构。该化合物中,阴离子为

您最近一年使用:0次
名校
解题方法
2 . 砷化铝(AlAs)常用作光谱分析试剂和制备电子组件的原料,是一种新型半导体材料。回答下列问题:
(1)基态As原子的核外价电子排布图为_______ ;第一电离能I1(As)_______ I1(Se) (填“大于”或“小于”),其原因是_______ 。
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为_______ ;分子中As、S原子的杂化轨道类型分别为_______ 、_______ 。
(3)AlF3的熔点约为1 040 ℃,AlCl3的熔点为194 ℃,其晶体类型分别是_______ 、_______ 。
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。

已知AlAs的立方晶胞如图2所示,其中As的配位数为_______ ;该晶体密度为ρ g·cm-3,设NA为阿伏加德罗常数的值,晶胞参数为_______ pm。

(1)基态As原子的核外价电子排布图为
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为
(3)AlF3的熔点约为1 040 ℃,AlCl3的熔点为194 ℃,其晶体类型分别是
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。

已知AlAs的立方晶胞如图2所示,其中As的配位数为

您最近一年使用:0次
名校
解题方法
3 . LiFePO4、LiPF6、LiAsF6、LiCl等常用于锂离子聚合物电池。请回答:
(1)PO 的立体构型是
的立体构型是_____ ,Fe2+的价层电子轨道表示式是_____ 。
(2)题干中所给四种物质所含的非金属元素中,电负性最大的是_____ ,基态原子第一电离能最小的是_____ 。
(3)抗坏血酸( )常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是
)常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是_____ 。
(4)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。

①从化学键角度看,Li+迁移过程发生_____ (填“物理”或“化学”)变化。
②相同条件,Li+在_____ (选填“LiPF6”或“LiAsF6”)中迁移较快。
③图乙中X的杂化方式最可能是_____ (填字母编号)。
a.sp3 b.sp3d c.sp3d2 d.sp3d3
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl•3H2O属于正交晶系(长方体形),晶胞参数为0.75nm、1.0nm、0.56nm,如图1为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。

图1
①据此推断该晶胞中氯原子数目为_____ 。
②图中A、B两原子核间距离为_____ nm(只列计算式)。
(6)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10,失去1个电子需要的能量由大到小排序是_____ (填字母)。
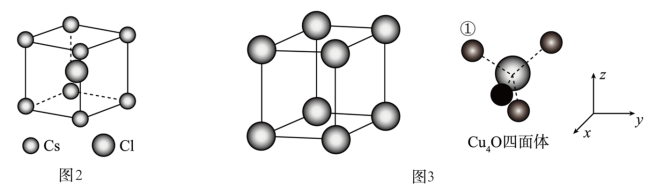
(7)Cu2O晶体结构与CsCl(图2)相似,只是利用Cu4O占据CsCl晶体中Cl的位置,而Cs位置由O原子占据,如图3所示,每个Cu2O晶胞中有_____ 个“Cu2O”;Cu2O晶胞中Cu的配位数是_____ ;若①处Cu原子坐标为( ,
, ,
, ),则Cu2O晶胞中Cu4O四面体中O原子坐标为
),则Cu2O晶胞中Cu4O四面体中O原子坐标为_____ 。
(1)PO
 的立体构型是
的立体构型是(2)题干中所给四种物质所含的非金属元素中,电负性最大的是
(3)抗坏血酸(
 )常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是
)常被用作碳包覆的碳源,以增强电极导电性,其易溶于水的原因是(4)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。

①从化学键角度看,Li+迁移过程发生
②相同条件,Li+在
③图乙中X的杂化方式最可能是
a.sp3 b.sp3d c.sp3d2 d.sp3d3
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl•3H2O属于正交晶系(长方体形),晶胞参数为0.75nm、1.0nm、0.56nm,如图1为沿z轴投影的晶胞中所有氯原子的分布图和原子分数坐标。

图1
①据此推断该晶胞中氯原子数目为
②图中A、B两原子核间距离为
(6)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10,失去1个电子需要的能量由大到小排序是
| A.④②①③ | B.④②③① | C.①②④③ | D.①④③② |
 ,
, ,
, ),则Cu2O晶胞中Cu4O四面体中O原子坐标为
),则Cu2O晶胞中Cu4O四面体中O原子坐标为
您最近一年使用:0次
名校
解题方法
4 . 碳氮硫共脱除工艺可以协同除去工业废水中的S2-、NO 和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
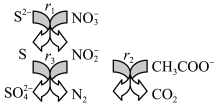
 和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
和CH3COO-,过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
| A.N2和CO2都是非极性分子 |
B.NO 和NO 和NO 的空间构型相同 的空间构型相同 |
C.NO 中存在离域π键 中存在离域π键 |
| D.冰醋酸中CH3COOH分子间存在范德华力和氢键 |
您最近一年使用:0次
2023-01-15更新
|
579次组卷
|
4卷引用:山东省潍坊市2022-2023学年高三上学期期末考试化学试题
5 . 锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等三十多种对人体有益的微量元素。
(1)基态Ge原子的电子排布式为_______ 。
(2) 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是_______ 分子(填“极性”或“非性极”)。
(3) 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为_______ (用元素符号表示), 中N的杂化方式为
中N的杂化方式为_______ 。
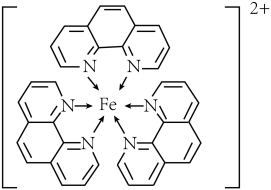
(4)如图所示的化合物,中心离子的配位数为_______ 。
(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:_______ 。
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为( ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为_______ ;已知晶胞边长为a pm,阿伏加德罗常数的值为 ,该晶胞密度
,该晶胞密度 为
为_______  (只列出计算式)。
(只列出计算式)。

(1)基态Ge原子的电子排布式为
(2)
 常温下为无色液体,沸点42.1℃,熔点
常温下为无色液体,沸点42.1℃,熔点 ℃,难溶于水,易溶于有机溶剂。推测
℃,难溶于水,易溶于有机溶剂。推测 是
是(3)
 可与
可与 形成配离子
形成配离子 ,该配离子中各元素的第一电离能由小到大的顺序为
,该配离子中各元素的第一电离能由小到大的顺序为 中N的杂化方式为
中N的杂化方式为(4)如图所示的化合物,中心离子的配位数为

(5)已知MgO熔点为2852℃,CaO熔点为2572℃,氧化镁熔点较氧化钙高,请做出合理解释:
(6)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为(
 ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为 ,该晶胞密度
,该晶胞密度 为
为 (只列出计算式)。
(只列出计算式)。
您最近一年使用:0次
解题方法
6 . 回答下列问题
(1)选择题(题目给出的四个选项中,有两个 选项是符合题目要求的)下列关于晶体的说法中,不正确 的是_____
(2)黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时发生反应:2CuFeS2 + O2 = Cu2S + 2FeS + SO2。
①Fe在周期表中的位置为_______ ;Fe、S、O原子的第一电离能由大到小的顺序是_______ 。
②Cu元素的基态原子的电子排布式为_______ ,有_______ 个未成对电子。
③SO2分子的立体构型为_______ ,SO2可氧化生成SO3,SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是_______ 。

④已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS的原因_______ 。
⑤Cu的晶胞如图所示,晶体密度为ρ g·cm-3,晶胞中等距最近的Cu原子有_______ 个,晶胞的边长为_______ (用含ρ和NA的式子表示)。
(1)选择题(题目给出的四个选项中,有
| A.MgO的晶格能远比NaCl大,这是因为前者粒子所带的电荷多,粒子半径小 |
| B.第一电离能:Cl>S>P>Si |
| C.金属原子在二维平面里放置得到非密置层和密置层两种方式,配位数分别为4和6 |
| D.共价键可决定分子晶体的熔、沸点 |
①Fe在周期表中的位置为
②Cu元素的基态原子的电子排布式为
③SO2分子的立体构型为

④已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS的原因

⑤Cu的晶胞如图所示,晶体密度为ρ g·cm-3,晶胞中等距最近的Cu原子有
您最近一年使用:0次
12-13高二上·四川遂宁·期中
名校
解题方法
7 . 下列说法错误的是
A.从CH4、 、 、 为正四面体结构,可推测PH 为正四面体结构,可推测PH 、 、 也为正四面体结构 也为正四面体结构 |
| B.1mol金刚石晶体中,平均含有2molC-C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
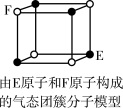
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
您最近一年使用:0次
2022-10-31更新
|
245次组卷
|
8卷引用:2012-2013学年四川省遂宁二中高二上学期期中考试化学试卷
解题方法
8 . 镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
(1)科学家常利用___________ ,区分晶体硅和无定形硅。
(2)硒常用作光敏材料,根据元素周期律,原子半径Ga___________ As(填“>”或“<”,后同)。第一电离能Ga___________ As。与硒同周期的p区元素中第一电离能大于硒的元素有___________ 种; 的空间构型是
的空间构型是___________ 。
(3)GaN、GaP、GaAs都是很好的半导体材料,熔点如表所示,分析其变化原因:___________ 。
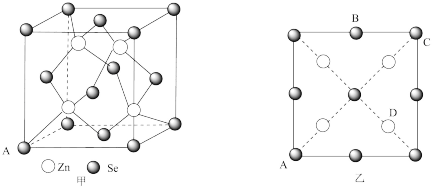
(4)硒化锌( )也是一种重要的半导体材料,其晶胞结构图甲所示,该晶胞中硒原子的配位数是
)也是一种重要的半导体材料,其晶胞结构图甲所示,该晶胞中硒原子的配位数是___________ ;已知晶胞边长为 ,乙图为甲图的俯视图,A点坐标为
,乙图为甲图的俯视图,A点坐标为 ,B点坐标为
,B点坐标为 ,则D点坐标
,则D点坐标___________ ;若该晶胞密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为___________  (只列出计算式)。
(只列出计算式)。
(1)科学家常利用
(2)硒常用作光敏材料,根据元素周期律,原子半径Ga
 的空间构型是
的空间构型是(3)GaN、GaP、GaAs都是很好的半导体材料,熔点如表所示,分析其变化原因:
| 物质 |  |  | 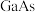 |
| 熔点 |  |  | 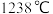 |
 )也是一种重要的半导体材料,其晶胞结构图甲所示,该晶胞中硒原子的配位数是
)也是一种重要的半导体材料,其晶胞结构图甲所示,该晶胞中硒原子的配位数是 ,乙图为甲图的俯视图,A点坐标为
,乙图为甲图的俯视图,A点坐标为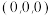 ,B点坐标为
,B点坐标为 ,则D点坐标
,则D点坐标 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为 (只列出计算式)。
(只列出计算式)。
您最近一年使用:0次
解题方法
9 . X、Y、Z、W、M、N、R是原子序数依次增大的前四周期元素,基态M原子的电子填充了3个能级,其中有2个未成对电子,N的最高正价与最低负价的代数和为6,基态R2+的d轨道半充满。由上述元素中的五种组成的某多孔储氢材料前驱体结构如图所示。

回答下列问题:
(1)基态Y原子的价电子排布图为_______ ,其中电子占据最高能级的电子云轮廓图为_______ 形;第一电离能介于Y和M之间的同周期元素有_______ 种。
(2)键角比较:
_______  (填“>”或“<”),理由是
(填“>”或“<”),理由是_______ 。
(3) R2+能形成配离子为八面体的配合物RNm∙nWX3,在该配合物中, 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量 溶液反应可生成71.75g白色沉淀,则该配离子的化学式为
溶液反应可生成71.75g白色沉淀,则该配离子的化学式为_______ ;该配合物中心原子的价层电子对数为_______ ;下列对该配合物中心原子杂化方式推断合理的是_______ (填标号)。
a. b.
b. c.
c. d.
d.

回答下列问题:
(1)基态Y原子的价电子排布图为
(2)键角比较:

 (填“>”或“<”),理由是
(填“>”或“<”),理由是(3) R2+能形成配离子为八面体的配合物RNm∙nWX3,在该配合物中,
 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量 溶液反应可生成71.75g白色沉淀,则该配离子的化学式为
溶液反应可生成71.75g白色沉淀,则该配离子的化学式为a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
2022-09-05更新
|
383次组卷
|
2卷引用:山东省临沂市2022-2023学年高三上学期开学摸底考试化学试题
解题方法
10 . 碱式碳酸铜[2CuCO3·Cu(OH)2]可用于制造烟火等。在较低温度下,将Cu(NO3)2饱和溶液倒入一定浓度的Na2CO3溶液中,即有碱式碳酸铜生成。
(1)Cu2+基态核外电子排布式为___________ 。
(2)Cu2+在溶液中实际上是以水合离子[Cu(H2O)4]2+的形式存在的。1 mol[Cu(H2O)4]2+中含有σ键的数目为___________ 。
(3)CO 中C原子轨道杂化类型为
中C原子轨道杂化类型为___________ ;与CO2互为等电子体的一种阴离子为___________ (填化学式)。
(4)NO 的空间构型为
的空间构型为___________ (用文字描述)。
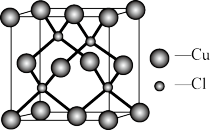
(5)Cu的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是___________ 。
(1)Cu2+基态核外电子排布式为
(2)Cu2+在溶液中实际上是以水合离子[Cu(H2O)4]2+的形式存在的。1 mol[Cu(H2O)4]2+中含有σ键的数目为
(3)CO
 中C原子轨道杂化类型为
中C原子轨道杂化类型为(4)NO
 的空间构型为
的空间构型为(5)Cu的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是

您最近一年使用:0次



