名校
1 . 研究表明:H2O2具有立体结构,两个氢原子像在一本半展开的书的两页纸上,两页纸面的夹角为94°,氧原子在书的夹缝上,O—H键与O—O键之间的夹角为97°。下列说法不正确的是
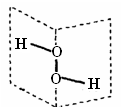

| A.H2O2分子中既含极性键,又含非极性键 |
| B.H2O2为极性分子 |
| C.H2O2分子中的两个O原子均是sp3杂化 |
| D.H2O2分子中既有σ键,又有π键 |
您最近一年使用:0次
2018-04-28更新
|
434次组卷
|
5卷引用:山东师范大学附属中学2017-2018学年高二下学期期中考试(理)化学试题
名校
2 . X、Y、Z、W是元素周期表中前36号元素,且原子序数依次增大。其相关信息如下表:
(1)元素X最高价氧化物分子的空间构型是__________________ ,是_________ (填“极性”或“非极性”)分子。
(2)Y的最简单氢化物的沸点比Z的最简单氢化物的沸点高,原因是____________________________________
(3)基态Z原子中,电子占据的最高电子层符号为_________ ,该电子层具有的原子轨道数为________________
(4)元素W位于元素周期表的第________ 族。
| 元素编号 | 元素性质或原子结构 |
| X | X原子的最外层电子数是其内层电子总数的2倍 |
| Y | Y的基态原子价电子排布式为nsnnpn+2 |
| Z | 最外层中只有两对成对电子 |
| W | 前四周期基态原子中,W元素的未成对电子数最多 |
(1)元素X最高价氧化物分子的空间构型是
(2)Y的最简单氢化物的沸点比Z的最简单氢化物的沸点高,原因是
(3)基态Z原子中,电子占据的最高电子层符号为
(4)元素W位于元素周期表的第
您最近一年使用:0次
2018-04-28更新
|
192次组卷
|
2卷引用:山东师范大学附属中学2017-2018学年高二下学期期中考试(理)化学试题
3 . 对CF2Cl2(商品名称为氟利昂-12)的叙述正确的是( )
| A.有两种同分异构体 | B.是非极性分子 |
| C.只有一种结构 | D.有四种同分异构体 |
您最近一年使用:0次
名校
4 . 观察下列模型并结合有关信息,判断下列说法不正确的是( )
| HCN | S8 | SF6 | B12结构单元 | |
| 结构模型 示意图 |
|
|
|
|
| 备注 | — | 易溶于CS2 | — | 熔点1 873 K |
| A.HCN的结构式为H—C≡N,分子中含有2个σ键和2个π键 |
| B.固态硫S8属于原子晶体 |
| C.SF6是由极性键构成的非极性分子 |
| D.单质硼属原子晶体,结构单元中含有30个B—B键 |
您最近一年使用:0次
2018-02-12更新
|
349次组卷
|
7卷引用:山东省济南外国语学校2019-2020学年高二下学期3月份“空中课堂”阶段性测试化学试题
名校
5 . PH3是一种无色剧毒气体,其分子结构和NH3相似,下列对PH3和NH3的有关叙述错误的是( )
| A.PH3沸点低于NH3沸点,因为P—H键键能低 |
| B.PH3分子是极性分子 |
| C.PH3分子呈三角锥形 |
D.在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3•H2O分子,则NH3•H2O的结构式为 |
您最近一年使用:0次
2017-11-13更新
|
194次组卷
|
2卷引用:山东省菏泽市单县二中2021-2022学年高二下学期开学考试 化学试题
名校
6 . 膦(PH3)在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含之。它的分子是三角锥形。以下关于PH3的叙述中,正确的是( )
| A.PH3是非极性分子 |
| B.PH3分子中有未成键的电子对 |
| C.PH3中的P-H键的极性比NH3中N-H键的极性弱 |
| D.PH3分子中的P-H键是非极性键 |
您最近一年使用:0次
2017-04-24更新
|
180次组卷
|
2卷引用:山东省济南外国语学校2019-2020学年高二下学期3月份“空中课堂”阶段性测试化学试题
解题方法
7 . 根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素价电子排布式_____________________ 。
(2)外围电子排布式为3d54s2的原子,其原子结构示意图为____________ ,其最高正价为________ ;其在元素周期表中的位置为___________________ 。
(3)下列分子中是否有手性原子:_________ (填“有”或“无”,若有请在图中碳原子下方用“*”标出)

(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)________________ 。
(5)试比较下列含氧酸的酸性强弱(填“>”“<”或“=”):
HClO3________ HClO4; H3PO4________ H3PO3。
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素价电子排布式
(2)外围电子排布式为3d54s2的原子,其原子结构示意图为
(3)下列分子中是否有手性原子:

(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)
(5)试比较下列含氧酸的酸性强弱(填“>”“<”或“=”):
HClO3
您最近一年使用:0次
8 . 下列含有极性键的非极性分子是
①CCl4 ②NH3 ③CH4 ④CO2 ⑤N2 ⑥H2O ⑦HF
①CCl4 ②NH3 ③CH4 ④CO2 ⑤N2 ⑥H2O ⑦HF
| A.②③④⑤ | B.①③④⑤ | C.①③④ | D.以上均不对 |
您最近一年使用:0次
9 . 有如下几种物质:
A.金刚石 B.MgF2 C.NH4Cl D.NaNO3 E.干冰 F.固体碘
选取适当物质填写下列空白。
(1)熔化时不需破坏化学键的是_______ ,熔化时只需破坏共价键的是_____ ,熔点最高的是________ ,熔点最低的是________ 。
(2)晶体中既存在离子键又存在共价键的是_______ ,只存在离子键的是_____ 。
(3)由极性键构成的非极性分子有________ 。
(4)可溶于CCl4的有________ 。
A.金刚石 B.MgF2 C.NH4Cl D.NaNO3 E.干冰 F.固体碘
选取适当物质填写下列空白。
(1)熔化时不需破坏化学键的是
(2)晶体中既存在离子键又存在共价键的是
(3)由极性键构成的非极性分子有
(4)可溶于CCl4的有
您最近一年使用:0次
2016-12-09更新
|
293次组卷
|
2卷引用:2013-2014山东省即墨市高二下学期期中考试化学试卷
10 . 【化学——选修3:物质结构与性质】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)与N3-含有相同电子数的三原子分子的空间构型是________ 。
(2)Cu具有良好的导电、导热和延展性,请解释Cu具有导电性的原因_________ 。
(3)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是____ ,乙醛分子中H—C—O的键角_______ 乙醇分子中的H—C—O的键角(填“大于”、“等于”或“小于”)。
(4)Cu+的核外电子排布式为______ ,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O__ 。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式________ 。
(6)Cu3N的晶胞结构如图,N3-的配位数为______ ,Cu+半径为a pm,N3-半径为b pm,Cu3N的密度______ g/cm3。(阿伏加德罗为常数用NA表示)

(1)与N3-含有相同电子数的三原子分子的空间构型是
(2)Cu具有良好的导电、导热和延展性,请解释Cu具有导电性的原因
(3)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是
(4)Cu+的核外电子排布式为
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式
(6)Cu3N的晶胞结构如图,N3-的配位数为

您最近一年使用:0次