解题方法
1 . 研究元素周期表右上角区域元素,有利于研发新型绿色农药,如 等。
等。
 和
和 的混合气体经光解作用可生成一种新分子
的混合气体经光解作用可生成一种新分子
①
 中S
中S 键。
键。②下列分子中属于非极性分子的是
a. b.
b. c.
c. d.
d.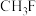 e.
e.
 、
、 中沸点较高的是
中沸点较高的是(3)下列物质变化,只与范德华力有关的是
A.干冰熔化 B.乙酸汽化 C.乙醇与HCHO混溶
D. 溶于水 E.碘溶于四氯化碳
溶于水 E.碘溶于四氯化碳
 。推测酸性:
。推测酸性:
 。
。(5)最近我国某科研团队用磷化钴纳米片催化合成氧化偶氯、偶氯、胺类芳香化合物,反应原理为
 。
。P与N属于同主族元素,但是 不能稳定存在的原因
不能稳定存在的原因
您最近一年使用:0次
2 . 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种短周期元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列叙述正确的是
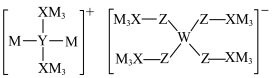
A. 的沸点低于 的沸点低于 的沸点,因为 的沸点,因为 的相对质量较小 的相对质量较小 |
| B.Y的氧化物对应的水化物一定是强酸 |
| C.第一电离能:Z>Y>X>W |
| D.简单氢化物的沸点:Z>Y>X |
您最近一年使用:0次
3 . 氮和硒(Se)都是重要元素,在医药、催化、材料等领域有广泛应用,回答下列问题:
(1)乙烷硒啉是一种抗癌新药,其结构式如图:___________ ,价层有___________ 种不同能量的电子
②比较 、
、 、
、 三种氢化物:沸点由高到低依次为
三种氢化物:沸点由高到低依次为___________ ,稳定性由强到弱依次为___________ 。
③比较键角大小:气态 分子
分子___________ 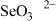 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是
___________ 。
(2)① 是有机合成中常用的还原剂,其阴离子
是有机合成中常用的还原剂,其阴离子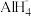 空间结构为
空间结构为___________ , 中存在的化学键
中存在的化学键___________ (填标号)。
A.离子键 B. 键 C.极性键 D.氢键
键 C.极性键 D.氢键
② 中阴离子的空间结构为
中阴离子的空间结构为___________ ;
(1)乙烷硒啉是一种抗癌新药,其结构式如图:
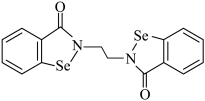
②比较
 、
、 、
、 三种氢化物:沸点由高到低依次为
三种氢化物:沸点由高到低依次为③比较键角大小:气态
 分子
分子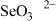 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是(2)①
 是有机合成中常用的还原剂,其阴离子
是有机合成中常用的还原剂,其阴离子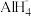 空间结构为
空间结构为 中存在的化学键
中存在的化学键A.离子键 B.
 键 C.极性键 D.氢键
键 C.极性键 D.氢键②
 中阴离子的空间结构为
中阴离子的空间结构为③1mol 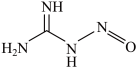 中含
中含 键
键
您最近一年使用:0次
解题方法
4 . 下列说法正确的是
| A.水很稳定是因为水中含有大量的氢键 |
| B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高 |
C. 和 和 空间结构不同,价层电子对数也不同 空间结构不同,价层电子对数也不同 |
| D.氨气极易溶于水,原因之一是氨分子与水分子之间形成了氢键。 |
您最近一年使用:0次
解题方法
5 . 硒是人体必需的微量元素之一,外围电子排布式为 。下列说法错误的是
。下列说法错误的是
 。下列说法错误的是
。下列说法错误的是A.沸点: | B.稳定性: |
| C.电负性:Se<Br | D.分子极性: |
您最近一年使用:0次
6 . 磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(SARS-CoV-2)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。_____ 。
(2)C、N、O三种元素电负性从大到小的顺序为_____ ;第一电离能I1(P)_____ I1(Cl)(填“>”或“<”)。
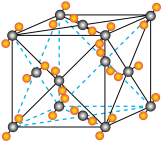
(3)钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点为( ,0,
,0, ),则C点的原子坐标参数为
),则C点的原子坐标参数为_____ 。_____ (用化学式表示)。_____ 。

(2)C、N、O三种元素电负性从大到小的顺序为
(3)钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点为(
 ,0,
,0, ),则C点的原子坐标参数为
),则C点的原子坐标参数为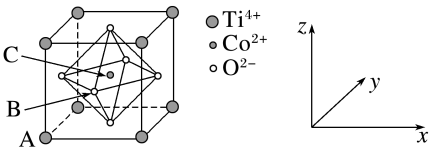

您最近一年使用:0次
解题方法
7 . 青蒿素 是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。 提取,效果更好。
提取,效果更好。
①乙醚沸点低于乙醇,原因是_____ 。
②用乙醚提取效果更好,原因是_____ 。
(2)确定结构
①青蒿素分子中含有_____ 个不对称碳原子。
②能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是_____ 。
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效:一定条件下,用 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。_____ 。
②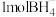 中有
中有_____  σ键,
σ键, 的空间结构为
的空间结构为_____ 。
③比较水溶性:双氢青蒿素_____ (填“ ”)青蒿素。
”)青蒿素。
 是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
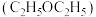 提取,效果更好。
提取,效果更好。①乙醚沸点低于乙醇,原因是
②用乙醚提取效果更好,原因是
(2)确定结构
①青蒿素分子中含有
②能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效:一定条件下,用
 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。
②
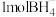 中有
中有 σ键,
σ键, 的空间结构为
的空间结构为③比较水溶性:双氢青蒿素
 ”)青蒿素。
”)青蒿素。
您最近一年使用:0次
8 . 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是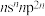 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
(1)请用元素符号完成下列空白:
①A、B、C三种元素的电负性由大到小顺序为:___________ 。
②B、C、D、E 4种元素的第一电离能由大到小顺序为:___________ 。
(2)下面是A~F元素中某种元素的部分电离能,由此可判断该元素是___________ 。
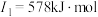
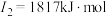
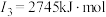
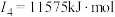
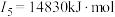
(3)F在周期表中的位置___________ ,位于周期表的___________ 区。
(4)BA3是一种很好的配体,BA3的沸点___________ (填“>”“=”或“<”)AsA3。
(5)B原子核外有___________ 种不同运动状态的电子;基态B原子中,能量最高的电子所占据的原子轨道的形状为___________ ;F原子核外电子占据的最高能层的符号是___________ 。
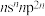 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。(1)请用元素符号完成下列空白:
①A、B、C三种元素的电负性由大到小顺序为:
②B、C、D、E 4种元素的第一电离能由大到小顺序为:
(2)下面是A~F元素中某种元素的部分电离能,由此可判断该元素是
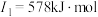
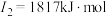
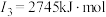
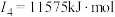
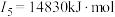
(3)F在周期表中的位置
(4)BA3是一种很好的配体,BA3的沸点
(5)B原子核外有
您最近一年使用:0次
名校
9 . “类比”是化学学习的重要方法。下列由客观事实类比所得结论正确的是
| 选项 | 客观事实 | 类比结论 |
| A |  的沸点高于 的沸点高于 |  的沸点高于 的沸点高于 |
| B | 电解熔融 制备镁 制备镁 | 电解熔融 制备铝 制备铝 |
| C |  通入 通入 溶液中无沉淀生成 溶液中无沉淀生成 |  通入 通入 溶液中无沉淀生成 溶液中无沉淀生成 |
| D | 加热 溶液,低温蒸发至干,最终产物为 溶液,低温蒸发至干,最终产物为 | 加热 溶液,低温然发至干,最终产物为 溶液,低温然发至干,最终产物为 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10 . 下列物质发生变化时,所克服的粒子间的主要作用力属同种类型的是
A.液态 与液态 与液态 分别受热变为气体 分别受热变为气体 | B.氯化铵与苯分别受热变为气体 |
| C.氯化钠与氯化氢分别溶解在水中 | D.冰融化与水蒸发 |
您最近一年使用:0次



