解题方法
1 . 下列叙述正确的是
| A.BeCl2分子中两个Be—Cl键间的夹角为180°,是由极性键构成的非极性分子 |
| B.H2O是一种非常稳定的化合物,这是由于氢键所致 |
| C.CH4和H2O的VSEPR模型分别为正四面体和V形 |
D. 和 和 的空间结构均为三角锥形 的空间结构均为三角锥形 |
您最近一年使用:0次
名校
2 . 短周期元素X、Y、Z、M原子序数依次增大,Z的最简单氢化物与最高正价的氧化物的水化物能发生反应生成盐,M的最高正价与最低负价绝对值之差为4,它们组成的一种分子结构如图。下列说法正确的是
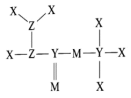
| A.非金属性:X>Y>Z |
| B.原子半径:Y>Z>M |
| C.Y、Z、M的最简单氢化物的沸点:Z>M>Y |
| D.X、Y、Z、M在化合物中均为8电子稳定结构 |
您最近一年使用:0次
3 . 下列说法正确的是
A. 的空间结构与其VSEPR模型相同 的空间结构与其VSEPR模型相同 |
B.氢键 中的三原子均在一条直线上 中的三原子均在一条直线上 |
| C.基态O原子核外电子的运动状态有8种 |
| D.第一电离能和电负性的大小可分别作为判断元素金属性和非金属性强弱的依据 |
您最近一年使用:0次
4 . 下列有关物质结构与性质的说法正确的是
| A.C=C键的键能比C—C键的大,所以碳碳双键的化学性质比碳碳单键稳定 |
| B.某基态原子的价层电子排布为4d25s2,该原子N层上有3个空轨道 |
| C.雪花是天空中的水汽经凝华而来的一种晶体,其六角形形状与氢键的方向性有关 |
| D.碘易溶于浓碘化钾溶液,甲烷难溶于水都可用“相似相溶”原理解释 |
您最近一年使用:0次
2024-04-13更新
|
290次组卷
|
2卷引用:河北省2024届高三下学期3月大数据应用调研联合测评(六)化学试题
5 . 镍(Ni)是一种制造合金和催化剂的重要金属。如:镍钴合金是一种永磁材料;镍还可作反应CH3CHO+H2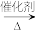 CH3CH2OH的催化剂。
CH3CH2OH的催化剂。
(1)基态Ni原子中,核外电子占据最高能层符号是___________ ,未成对电子数为___________ 。
(2)1molCH3CHO中含有的σ键的数目为___________ ,碳原子的杂化类型为___________ 。
(3)乙醛的沸点___________ (填“高于”或“低于”)乙醇的沸点,原因为___________ 。
(4)某含镍配合物(NH4)2[Ni(OCN)4],其配离子中σ键与π键的个数比为___________ ,OCN-中元素N、O、C的第一电离能由大到小为___________ , 的空间构型为
的空间构型为___________ 。
(5)金属镍的原子堆积方式为面心立方堆积(如图所示),已知:已知镍的相对原子质量为59,阿伏加德罗常数为NA,金属镍的密度为ρg/cm3,则金属镍晶体中距离最近的镍原子间的距离为___________ pm(填表达式)。
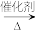 CH3CH2OH的催化剂。
CH3CH2OH的催化剂。(1)基态Ni原子中,核外电子占据最高能层符号是
(2)1molCH3CHO中含有的σ键的数目为
(3)乙醛的沸点
(4)某含镍配合物(NH4)2[Ni(OCN)4],其配离子中σ键与π键的个数比为
 的空间构型为
的空间构型为(5)金属镍的原子堆积方式为面心立方堆积(如图所示),已知:已知镍的相对原子质量为59,阿伏加德罗常数为NA,金属镍的密度为ρg/cm3,则金属镍晶体中距离最近的镍原子间的距离为

您最近一年使用:0次
名校
6 . 马来酸的结构简式为 ,富马酸的结构简式为
,富马酸的结构简式为 。下列说法错误的是
。下列说法错误的是
 ,富马酸的结构简式为
,富马酸的结构简式为 。下列说法错误的是
。下列说法错误的是| A.二者互为顺反异构体 |
B.1mol马来酸可与3mol 发生加成反应 发生加成反应 |
| C.马来酸在水中的溶解度大于富马酸 |
| D.马来酸的稳定性弱于富马酸 |
您最近一年使用:0次
2024-04-09更新
|
179次组卷
|
3卷引用:河北省沧州市泊头市八县联考2023-2024学年高三下学期3月月考化学试题
名校
7 . 饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,反应的离子方程式为
,反应的离子方程式为 。设
。设 为阿伏加德罗常数的值,下列说法
为阿伏加德罗常数的值,下列说法错误 的是
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,反应的离子方程式为
,反应的离子方程式为 。设
。设 为阿伏加德罗常数的值,下列说法
为阿伏加德罗常数的值,下列说法A.消耗 ,反应转移的电子数为 ,反应转移的电子数为 |
B.消耗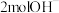 时,溶液中增加的 时,溶液中增加的 数目为 数目为 |
C.标准状况下,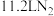 中含 中含 键数目为 键数目为 |
D. 液态水中含有的氢键数目少于 液态水中含有的氢键数目少于 |
您最近一年使用:0次
2024-04-08更新
|
312次组卷
|
3卷引用:河北省沧州市沧县中学2023-2024学年高三下学期3月月考化学试题
名校
8 . 化合物M是一种新型超分子晶体材料,以CH3COCH3为溶剂,由X、Y、HCIO4反应制得(如图)。下列叙述正确的是
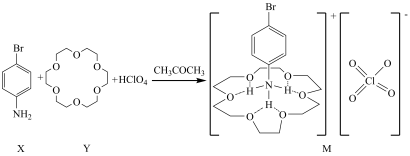
| A.M所含三种元素H、N、O形成的化合物均能抑制水的电离 |
| B.Y分子中所有原子可能共平面 |
| C.M中阳离子通过形成氢键体现了超分子的自组装 |
| D.M中碳、氮、氯原子的轨道杂化类型均为sp3 |
您最近一年使用:0次
2024-04-05更新
|
587次组卷
|
3卷引用:河北省2024届高三下学期3月大数据应用调研联合测评(六)化学试题
解题方法
9 . 根据所学知识,回答下列问题:A、B、C代表三种元素,D是由A、B两种元素组成的物质。
(1)基态A原子核外只有一种运动状态的电子,基态B原子的最外层电子排布式为 ,则
,则
___________ 。
(2)C的单质在常温、常压下是气体,基态C原子的M层上有1个未成对的p电子,C的气态氢化物和氟化氢相比,稳定性较强的是___________ ,其原因是___________ ;沸点较高的是___________ ,其原因是___________ 。(填写化学式,并从微粒间作用力的角度分析原因)
(3)D是由短周期元素构成的中性四核粒子,有14个电子,分子中仅含共价键,其结构式为___________ ;D分子内所含 键与
键与 键的数目之比为
键的数目之比为___________ ; 键与
键与 键的强度大小关系为
键的强度大小关系为 键
键___________ (填“>”“<”或“=”) 键,原因是
键,原因是___________ 。
(4)根据元素核外电子排布可以推知元素的性质。
①被誉为“21世纪金属”的钛(Ti),其基态原子价层电子轨道表示式为___________ 。
②日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素基态原子的价层电子排布式为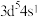 ,该元素的名称是
,该元素的名称是___________ 。
(1)基态A原子核外只有一种运动状态的电子,基态B原子的最外层电子排布式为
 ,则
,则
(2)C的单质在常温、常压下是气体,基态C原子的M层上有1个未成对的p电子,C的气态氢化物和氟化氢相比,稳定性较强的是
(3)D是由短周期元素构成的中性四核粒子,有14个电子,分子中仅含共价键,其结构式为
 键与
键与 键的数目之比为
键的数目之比为 键与
键与 键的强度大小关系为
键的强度大小关系为 键
键 键,原因是
键,原因是(4)根据元素核外电子排布可以推知元素的性质。
①被誉为“21世纪金属”的钛(Ti),其基态原子价层电子轨道表示式为
②日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素基态原子的价层电子排布式为
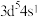 ,该元素的名称是
,该元素的名称是
您最近一年使用:0次
名校
解题方法
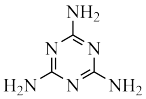
10 . Ⅰ.8−羟基喹啉( )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(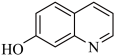 )、6−羟基喹啉(
)、6−羟基喹啉(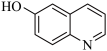 )的熔点的原因是
)的熔点的原因是___________ 。
(2) 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是___________ 。
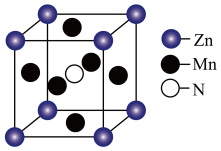
(3)某种含 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为___________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ. 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。

(4)与 距离最近且相等的
距离最近且相等的 有
有___________ 个,与 距离最近且相等的F-有
距离最近且相等的F-有___________ 个。
(5) 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
___________  。(
。( )
)
(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。
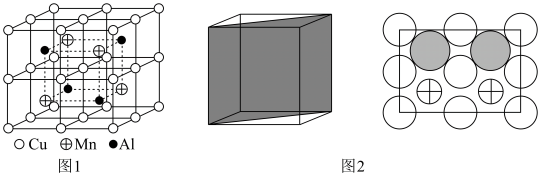
将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是___________ 。
 )被广泛用作
)被广泛用作 等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:
等金属离子的络合剂和萃取剂,也是重要的医药中间体。回答下列问题:(1)8−羟基喹啉的熔点明显低于7−羟基喹啉(
 )、6−羟基喹啉(
)、6−羟基喹啉( )的熔点的原因是
)的熔点的原因是(2)
 不能形成类似
不能形成类似 分子中的
分子中的 键,原因是
键,原因是(3)某种含
 特殊材料的晶胞结构如图所示,若该晶体的密度为
特殊材料的晶胞结构如图所示,若该晶体的密度为 ,则晶体中相邻N之间的最短距离为
,则晶体中相邻N之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
Ⅱ.
 等氟化物可以做光导纤维材料,一定条件下,某
等氟化物可以做光导纤维材料,一定条件下,某 的晶体结构如下图。
的晶体结构如下图。
(4)与
 距离最近且相等的
距离最近且相等的 有
有 距离最近且相等的F-有
距离最近且相等的F-有(5)
 表示阿伏加德罗常数的值。
表示阿伏加德罗常数的值。 晶胞为正方体,边长为
晶胞为正方体,边长为 ,则晶体的摩尔体积
,则晶体的摩尔体积
 。(
。( )
)(6)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。

将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是___________。(填字母序号)
A.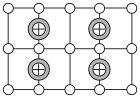 | B.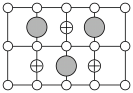 |
C. | D.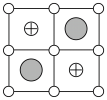 |
(7)一种类石墨的聚合物g﹣C3N4可由三聚氰胺制得。三聚氰胺分子不溶于冷水,溶于热水,主要原因是

您最近一年使用:0次



