名校
解题方法
1 . 下列说法不正确的是
A.乳酸分子(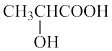 )是手性分子 )是手性分子 |
| B.水蒸气、液态水和冰中均存在氢键 |
C.硫难溶于水,微溶于酒精,易溶于 ,说明分子极性: ,说明分子极性: |
D.酸性: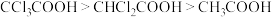 是因为Cl原子电负性大,使得羟基O-H键极性增强,易电离出 是因为Cl原子电负性大,使得羟基O-H键极性增强,易电离出 |
您最近一年使用:0次
2 . 回答下列问题:
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气(COCl2):2CHCl3+O2→2HCl+2COCl2,光气(COCl2)分子的立体构型是_______ 形。
(2)某有机物的结构简式为 。该有机物分子是
。该有机物分子是_______ (填“极性”或“非极性”)分子,该有机物分子中采取sp3杂化的原子对应元素的电负性由大到小的顺序为_______ 。
(3)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为_______ ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因_______
(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3.HN3的酸性和醋酸相近,可微弱电离出H+和N 。
。
①叠氮酸根能与许多金属离子等形成配合物,如[Co(N3)(NH3)5]SO4,根据价层电子对互斥理论判断SO 的空间构型为
的空间构型为_______ 。
②下列有关说法正确的是_______ (填序号)。
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.肼(N2H4)的沸点高达113.5℃,说明肼分子间可形成氢键
(1)麻醉剂的发现和使用是人类医学史上一项了不起的成就。一种常用麻醉剂氯仿常因保存不慎而被氧化,产生剧毒光气(COCl2):2CHCl3+O2→2HCl+2COCl2,光气(COCl2)分子的立体构型是
(2)某有机物的结构简式为
 。该有机物分子是
。该有机物分子是(3)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为
(4)叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3.HN3的酸性和醋酸相近,可微弱电离出H+和N
 。
。①叠氮酸根能与许多金属离子等形成配合物,如[Co(N3)(NH3)5]SO4,根据价层电子对互斥理论判断SO
 的空间构型为
的空间构型为②下列有关说法正确的是
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.肼(N2H4)的沸点高达113.5℃,说明肼分子间可形成氢键
您最近一年使用:0次
23-24高二下·全国·课后作业
名校
3 . 下列对分子性质的解释中,正确的是
| A.NH3极易溶于水而CH4难溶于水只是因为NH3是极性分子,CH4是非极性分子 |
B.乳酸(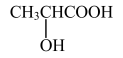 )具有光学活性,因为其分子中含有一个手性碳原子 )具有光学活性,因为其分子中含有一个手性碳原子 |
| C.水很稳定(1000℃以上才会部分分解)是因为水分子间存在大量的氢键 |
| D.PH3分子与NH3分子的构型关系完全相同 |
您最近一年使用:0次
2024-03-05更新
|
619次组卷
|
4卷引用:新疆阿克苏市实验中学2022-2023学年高二下学期第二次月考化学试题
4 . 某化合物的分子式为AB2,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知AB2分子的键角为1.3.3°。下列推断不正确的是
| A.AB2分子的立体构型为V形 |
| B.A-B键为极性共价键,AB2分子为非极性分子 |
| C.AB2与H2O相比,AB2的熔点、沸点比H2O的低 |
| D.AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键 |
您最近一年使用:0次
2024-03-05更新
|
58次组卷
|
2卷引用:新疆阿克苏市实验中学2022-2023学年高二下学期第二次月考化学试题
名校
5 . 类比法是一种学习化学的重要方法。下列“类比”中不合理的是
A. 与HCl反应生成 与HCl反应生成 ,则 ,则 也可与HCl反应生成 也可与HCl反应生成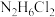 |
B. 溶液显碱性,则 溶液显碱性,则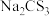 溶液显碱性 溶液显碱性 |
C.酸性: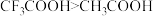 ,则碱性: ,则碱性: |
D. 沸点比 沸点比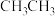 高,则苯酚的沸点比苯高 高,则苯酚的沸点比苯高 |
您最近一年使用:0次
名校
6 . 不同空腔尺寸的葫芦 可以通过形成超分子从气体或溶液中识别不同分子并选择性吸附,对位取代的苯的衍生物恰好可以进入葫芦[6]脲(结构如图所示)的空腔。下列说法正确的是
可以通过形成超分子从气体或溶液中识别不同分子并选择性吸附,对位取代的苯的衍生物恰好可以进入葫芦[6]脲(结构如图所示)的空腔。下列说法正确的是

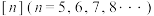 可以通过形成超分子从气体或溶液中识别不同分子并选择性吸附,对位取代的苯的衍生物恰好可以进入葫芦[6]脲(结构如图所示)的空腔。下列说法正确的是
可以通过形成超分子从气体或溶液中识别不同分子并选择性吸附,对位取代的苯的衍生物恰好可以进入葫芦[6]脲(结构如图所示)的空腔。下列说法正确的是
| A.葫芦脲可以吸附进入空腔的所有分子 |
| B.可装入对甲基苯甲酸体现了超分子的“分子识别”功能 |
| C.葫芦[6]脲形成的超分子中存在氢键 |
| D.超分子是分子聚集体,不包括离子 |
您最近一年使用:0次
名校
7 . 一种高效电解质的结构如图所示,W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,X与Q同族,Y和Z的原子序数之和与Q相等。下列说法正确的是
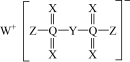
| A.氧化物对应的水化物的酸性 Q<Y | B.气态氢化物的稳定性:Q<X<Y<Z |
| C.简单氢化物的沸点:X>Z>Y | D.W单质在空气中燃烧的产物是W2O2 |
您最近一年使用:0次
2023-08-26更新
|
196次组卷
|
3卷引用:新疆石河子第一中学2023-2024学年高三上学期第二次月考化学试题
名校
解题方法
8 . 新能源汽车使用的电池是磷酸亚铁锂(LiFePO4)电池,工业上用FeCl3、NH4H2PO4、LiCl及苯胺( )为原料制磷酸亚铁锂材料。请回答下列问题。
)为原料制磷酸亚铁锂材料。请回答下列问题。
(1)Fe元素在周期表中的位置___________ ,属于___________ 区。
(2)比较离子半径大小:Li+___________H-(填“>”、“<”或“=”)。
(3)四种状态的Li原子轨道表示式如下所示,其能量大小关系为___________ (用字母表示)。
A. B.
B. 
C. D.
D. 
(4)苯胺( )与甲苯(
)与甲苯( )的相对分子质量相近,但熔沸点苯胺
)的相对分子质量相近,但熔沸点苯胺___________ 甲苯(填“>”、“<”或“=”),原因是___________ 。
(5)磷酸铁锂电池的负极材料为Li原子嵌入两层石墨层中间形成的晶体,其晶胞结构如图甲所示,放电时,负极反应式为___________ 。在甲晶胞中,石墨层中最近的两个碳原子间的距离是apm,石墨层与层间的距离是bpm,则负极材料的密度为___________ g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数的值)。

 )为原料制磷酸亚铁锂材料。请回答下列问题。
)为原料制磷酸亚铁锂材料。请回答下列问题。(1)Fe元素在周期表中的位置
(2)比较离子半径大小:Li+___________H-(填“>”、“<”或“=”)。
(3)四种状态的Li原子轨道表示式如下所示,其能量大小关系为
A.
 B.
B. 
C.
 D.
D. 
(4)苯胺(
 )与甲苯(
)与甲苯( )的相对分子质量相近,但熔沸点苯胺
)的相对分子质量相近,但熔沸点苯胺(5)磷酸铁锂电池的负极材料为Li原子嵌入两层石墨层中间形成的晶体,其晶胞结构如图甲所示,放电时,负极反应式为

您最近一年使用:0次
2023-08-16更新
|
441次组卷
|
3卷引用:新疆乌鲁木齐市第二十三中学2023-2024学年高三下学期2月月考化学试题
真题
名校
9 . 中科院院士研究发现,纤维素可在低温下溶于NaOH溶液,恢复至室温后不稳定,加入尿素可得到室温下稳定的溶液,为纤维素绿色再生利用提供了新的解决方案。下列说法错误的是
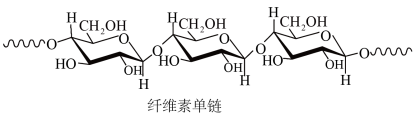
| A.纤维素是自然界分布广泛的一种多糖 |
| B.纤维素难溶于水的主要原因是其链间有多个氢键 |
C.NaOH提供 破坏纤维素链之间的氢键 破坏纤维素链之间的氢键 |
| D.低温降低了纤维素在NaOH溶液中的溶解性 |
您最近一年使用:0次
2023-06-14更新
|
8201次组卷
|
19卷引用:新疆阿克苏市第四高级中学2023-2024学年高三上学期第二次月考化学试卷
新疆阿克苏市第四高级中学2023-2024学年高三上学期第二次月考化学试卷广东省中山大学附属中学2023-2024学年高三上学期8月阶段性检测化学试题山西省大同市第一中学校2023-2024学年高三上学期10月月考化学试题广东省揭阳市普宁市第二中学2023-2024学年高三上学期9月月考化学试题2023年高考湖北卷化学真题(已下线)专题06 物质结构与性质(已下线)T7-物质结构与性质(已下线)专题06 物质结构与性质(已下线)专题06 物质结构与性质(已下线)考点巩固卷11 有机化学基础(二)(3大考点50题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)专题10 有机物结构与性质-2023年高考化学真题题源解密(新高考专用)6.1.1糖类 课前(已下线)专题06 有机物的结构与性质-2023年高考化学真题题源解密(全国通用)(已下线)考点37 营养物质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)安徽六校教育研究会2024届高三上学期入学素质测试化学试题(已下线)第36讲生物大分子和合成高分子(已下线)考点4 生物大分子和合成高分子(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)2024届河南省郑州市宇华实验学校高三一模化学试题(已下线)4.1 糖类课堂例题
名校
10 . 回答下列问题:
(1)下列分子中若有手性原子,请用“*”标出其手性碳原子_____________ 。
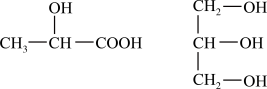
(2)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4_______ H2SO3;HClO3_______ HClO4;
(3)根据价层电子对互斥理论判断下列问题:H2S分子的VSEPR构型为____________ ,立体构型为_________________ 。
(4)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于___________________ ;H2O比H2S更稳定,这是由于________________________ 。
(1)下列分子中若有手性原子,请用“*”标出其手性碳原子
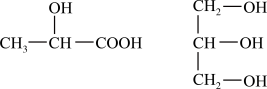
(2)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
(3)根据价层电子对互斥理论判断下列问题:H2S分子的VSEPR构型为
(4)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
您最近一年使用:0次
2023-04-20更新
|
209次组卷
|
2卷引用:新疆阿克苏市实验中学2022-2023学年高二下学期第三次月考化学试题



