1 . 钒、钨、锌在工业上用途广泛。
(1)基态钒(V)元素在周期表中的位置为_______ ,其最高化合价为_______ ,与其同周期且未成对电子数相同的元素符号为_______ ;
(2)钒能形成多种配合物。钒的两种配合物X、Y化学式均为V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来),所用试剂及所得现象如表所示:
则X的配离子为_______ ,Y的配体为_______ 。
(3)NaxWO3是一类色彩丰富的非整比化合物,其晶体结构如图2所示,若Na+无空缺,化学式为NaWO3,完全空缺则为WO3,每填入1个Na+,相应有1个W6+还原为W5+。NaxWO3的颜色与x值的对应关系如图1所示,已知NaxWO3晶体中n(W6+):n(W5+)=2:3,则其颜色为_______ 色。

(4)如图3是金属钨晶体中的一个晶胞的结构模型(原子间实际是相互接触的)。其中心的原子位于立方体的体心。实验测得金属钨的半径为rcm,假定金属钨为等直径的刚性球,请回答以下各题:

①每一个晶胞中分摊到_______ 个钨原子。
②计算晶胞的空间利用率_______ (写出表达式,不计算具体数值)。
(1)基态钒(V)元素在周期表中的位置为
(2)钒能形成多种配合物。钒的两种配合物X、Y化学式均为V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来),所用试剂及所得现象如表所示:
| 原溶液 | X溶液 | X溶液 | Y溶液 | Y溶液 |
| 所加试剂 | BaCl2溶液 | AgNO3溶液 | BaCl2溶液 | AgNO3溶液 |
| 现象 | 白色沉淀 | 无明显变化 | 无明显变化 | 白色沉淀 |
则X的配离子为
(3)NaxWO3是一类色彩丰富的非整比化合物,其晶体结构如图2所示,若Na+无空缺,化学式为NaWO3,完全空缺则为WO3,每填入1个Na+,相应有1个W6+还原为W5+。NaxWO3的颜色与x值的对应关系如图1所示,已知NaxWO3晶体中n(W6+):n(W5+)=2:3,则其颜色为

(4)如图3是金属钨晶体中的一个晶胞的结构模型(原子间实际是相互接触的)。其中心的原子位于立方体的体心。实验测得金属钨的半径为rcm,假定金属钨为等直径的刚性球,请回答以下各题:

①每一个晶胞中分摊到
②计算晶胞的空间利用率
您最近一年使用:0次
2 . I.次磷酸( )是一种精细化工产品。
)是一种精细化工产品。
(1) 溶液中的含磷微粒只有
溶液中的含磷微粒只有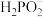 和
和 ,则该溶液呈
,则该溶液呈_______ 性(填“酸”“碱”或“中”)。
(2)25℃时, 溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入
溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入 溶液中水的体积
溶液中水的体积_______ (填“大于”“小于”或“等于”)加入盐酸中水的体积。
II.
(3)硅元素可形成多种晶体。
①硅与氯、溴结合能形成 、
、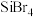 ,沸点较高的是
,沸点较高的是_______ 。
②晶体Si和晶体SiC结构相似,熔点较低的是_______ 。
(4)某化合物具有超导性,其晶胞结构如图所示,则该化合物的化学式为_______ ,1个Mg与_______ 个Ni等距离且最近。

III.为了达到碳中和,研发二氧化碳、烃类等物质的利用技术已成为科研热点。
(5)



则

_______ (用 、
、 表示)。
表示)。
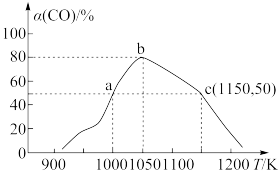
(6)已知反应:
 。将1molCO和2mol
。将1molCO和2mol 充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
①试求温度为1000K条件下,反应开始至2min时,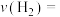
_______ 。
②已知c点时容器内的压强为p,则在1150K温度下该反应的压强平衡常数 为
为_______ ( 是用各气体物质的分压替代浓度来计算的平衡常数)。
是用各气体物质的分压替代浓度来计算的平衡常数)。
 )是一种精细化工产品。
)是一种精细化工产品。(1)
 溶液中的含磷微粒只有
溶液中的含磷微粒只有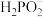 和
和 ,则该溶液呈
,则该溶液呈(2)25℃时,
 溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入
溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入 溶液中水的体积
溶液中水的体积II.
(3)硅元素可形成多种晶体。
①硅与氯、溴结合能形成
 、
、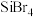 ,沸点较高的是
,沸点较高的是②晶体Si和晶体SiC结构相似,熔点较低的是
(4)某化合物具有超导性,其晶胞结构如图所示,则该化合物的化学式为

III.为了达到碳中和,研发二氧化碳、烃类等物质的利用技术已成为科研热点。
(5)




则


 、
、 表示)。
表示)。(6)已知反应:

 。将1molCO和2mol
。将1molCO和2mol 充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
①试求温度为1000K条件下,反应开始至2min时,
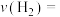
②已知c点时容器内的压强为p,则在1150K温度下该反应的压强平衡常数
 为
为 是用各气体物质的分压替代浓度来计算的平衡常数)。
是用各气体物质的分压替代浓度来计算的平衡常数)。
您最近一年使用:0次
名校
解题方法
3 .  及其化合物在生产生活方面都有重要的用途.回答下列问题:
及其化合物在生产生活方面都有重要的用途.回答下列问题:
(1)基态铁原子的核外电子排布式为:______ , 比
比 更稳定的原因是:
更稳定的原因是:______ 。
(2) 中铁元素的配位数是
中铁元素的配位数是______ ,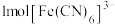 中含有的
中含有的 键的数目为
键的数目为______ , 中C原子的杂化方式为
中C原子的杂化方式为______ 。
(3)铁和氨在 可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:______ 。
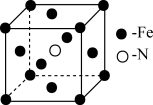
(4)血红素铁用作铁强化剂,其吸收率比一般铁剂高3倍,图中画出 与N原子间的化学键(若是配位键,需要用箭头加以表示)
与N原子间的化学键(若是配位键,需要用箭头加以表示)______ 。

 及其化合物在生产生活方面都有重要的用途.回答下列问题:
及其化合物在生产生活方面都有重要的用途.回答下列问题:(1)基态铁原子的核外电子排布式为:
 比
比 更稳定的原因是:
更稳定的原因是:(2)
 中铁元素的配位数是
中铁元素的配位数是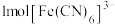 中含有的
中含有的 键的数目为
键的数目为 中C原子的杂化方式为
中C原子的杂化方式为(3)铁和氨在
 可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
(4)血红素铁用作铁强化剂,其吸收率比一般铁剂高3倍,图中画出
 与N原子间的化学键(若是配位键,需要用箭头加以表示)
与N原子间的化学键(若是配位键,需要用箭头加以表示)
您最近一年使用:0次
4 . 某工业废渣的主要成分为NiO、CuO、 、ZnO,一种综合回收利用的工艺流程如图所示:
、ZnO,一种综合回收利用的工艺流程如图所示:

回答下列问题:
(1)写出浸渣主要成分的一种用途:_______ 。
(2)浸取液含有的配离子有 、
、 、
、 ,
, 的中心离子为
的中心离子为_______ ,配位数为_______ ; 能作配体的原因是
能作配体的原因是_______ 。
(3)“还原”得到Cu时发生反应的氧化剂和还原剂的物质的量之比为_______ ;该反应温度不宜过高,原因是_______ 。
(4)“沉锌镍”后得到的滤液中可循环利用的物质有_______ (填化学式)。
(5)“脱锌”时反应的化学方程式为_______ 。
(6)NiO为绿色固体,常用作搪瓷的着色剂,其晶胞结构如图所示:

①测定晶体结构最常用的方法是_______ (填选项字母)。
A.核磁共振氢谱 B.红外光谱 C.X射线衍射实验 D.称重法
②若晶胞中 之间的最短距离为a nm,阿伏加德罗常数的值为
之间的最短距离为a nm,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_______  (用含
(用含 、a的代数式表示)。
、a的代数式表示)。
 、ZnO,一种综合回收利用的工艺流程如图所示:
、ZnO,一种综合回收利用的工艺流程如图所示:
回答下列问题:
(1)写出浸渣主要成分的一种用途:
(2)浸取液含有的配离子有
 、
、 、
、 ,
, 的中心离子为
的中心离子为 能作配体的原因是
能作配体的原因是(3)“还原”得到Cu时发生反应的氧化剂和还原剂的物质的量之比为
(4)“沉锌镍”后得到的滤液中可循环利用的物质有
(5)“脱锌”时反应的化学方程式为
(6)NiO为绿色固体,常用作搪瓷的着色剂,其晶胞结构如图所示:

①测定晶体结构最常用的方法是
A.核磁共振氢谱 B.红外光谱 C.X射线衍射实验 D.称重法
②若晶胞中
 之间的最短距离为a nm,阿伏加德罗常数的值为
之间的最短距离为a nm,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为 (用含
(用含 、a的代数式表示)。
、a的代数式表示)。
您最近一年使用:0次
解题方法
5 . 科幻电影《阿凡达》中外星人流的是蓝色的血液,其实血液的颜色主要是由血蛋白中含有的金属元素决定的,如含铁元素的为常见红色血液、含铜元素的为蓝色血液、含钒元素的为绿色血液等,铜、铁、钒在科学研究和工农业生产中有许多用途。回答下列问题:
(1)基态V的核外电子排布式为_______ 。
(2) 溶液常用作农业杀菌剂,溶液中存在
溶液常用作农业杀菌剂,溶液中存在 。该离子中存在的化学键有
。该离子中存在的化学键有_______ (填字母)。
A.共价键 B.离子键 C.氢键 D.范德华力 E.配位键
(3) 与氨基吡啶形成的配合物(结构如图1)是很好的磁性材料。该配合物分子中碳与氧原子间形成的
与氨基吡啶形成的配合物(结构如图1)是很好的磁性材料。该配合物分子中碳与氧原子间形成的 键和π键的个数比为
键和π键的个数比为_______ ,其中C原子的杂化轨道类型为_______ 。

(4)铜的氧化物、氮化物都广泛应用于光信息存储和高速集成电路领域。
①Cu、O、N的电负性由大到小的顺序为_______ 。
②已知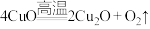 ,从铜离子的价层电子结构角度分析,高温下能转化生成
,从铜离子的价层电子结构角度分析,高温下能转化生成 的主要原因是
的主要原因是_______ 。
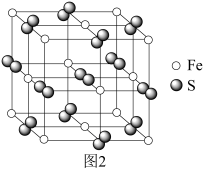
(5)铁与硫能形成多种化合物,某种化合物的晶胞结构如图2所示。该化合物的化学式是_______ ;若该晶胞边长为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为_______  。
。
(1)基态V的核外电子排布式为
(2)
 溶液常用作农业杀菌剂,溶液中存在
溶液常用作农业杀菌剂,溶液中存在 。该离子中存在的化学键有
。该离子中存在的化学键有A.共价键 B.离子键 C.氢键 D.范德华力 E.配位键
(3)
 与氨基吡啶形成的配合物(结构如图1)是很好的磁性材料。该配合物分子中碳与氧原子间形成的
与氨基吡啶形成的配合物(结构如图1)是很好的磁性材料。该配合物分子中碳与氧原子间形成的 键和π键的个数比为
键和π键的个数比为
(4)铜的氧化物、氮化物都广泛应用于光信息存储和高速集成电路领域。
①Cu、O、N的电负性由大到小的顺序为
②已知
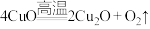 ,从铜离子的价层电子结构角度分析,高温下能转化生成
,从铜离子的价层电子结构角度分析,高温下能转化生成 的主要原因是
的主要原因是(5)铁与硫能形成多种化合物,某种化合物的晶胞结构如图2所示。该化合物的化学式是
 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。
。
您最近一年使用:0次
6 . ZnGeP2是非线性晶体材料,在激光技术方面有广泛的用途。回答下列问题:
(1)基态Ge原子的价电子排布式为_______ 。
(2)O、P、K、Zn按电负性由大到小的顺序排列为______ 。
(3)H2O、PH3、KH按熔点由高到低的顺序排列为______ ,熔点差异的原因是_______ 。
(4)以Zn为顶点的ZnGeP2晶胞结构如图所示。
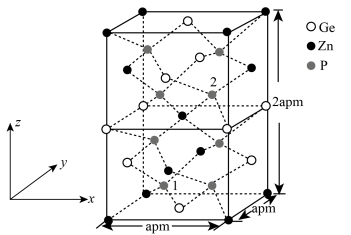
①Zn原子的配位数为________ 。
②以Ge为顶点的晶胞中,Zn原子位于______ (填写正确的字母)。
A.面心 B.棱心 C.面心和棱心
③已知晶胞中1号原子的分数坐标为( ,
, ,
, ),则2号原子的分数坐标为
),则2号原子的分数坐标为______ 。
④该晶体的密度为______ g•cm-3。
(1)基态Ge原子的价电子排布式为
(2)O、P、K、Zn按电负性由大到小的顺序排列为
(3)H2O、PH3、KH按熔点由高到低的顺序排列为
(4)以Zn为顶点的ZnGeP2晶胞结构如图所示。

①Zn原子的配位数为
②以Ge为顶点的晶胞中,Zn原子位于
A.面心 B.棱心 C.面心和棱心
③已知晶胞中1号原子的分数坐标为(
 ,
, ,
, ),则2号原子的分数坐标为
),则2号原子的分数坐标为④该晶体的密度为
您最近一年使用:0次
名校
解题方法
7 . ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_____ ;

原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为_____ ;
Se原子序数为_____ ,其核外M层电子的排布式为_____ ;
 离子的立体构型为
离子的立体构型为_____ ;
ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0pm,密度为_____ g·cm-3(列式并计算)。
(2)
(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是

原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
Se原子序数为
 离子的立体构型为
离子的立体构型为ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0pm,密度为
(2)

您最近一年使用:0次
8 . 铌是汽车和飞机制造业特别重要的材料,具有良好的耐腐蚀、冷热加工等性能,以高钛渣(含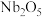 、
、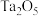 、
、 、CaO)为原料制取单质的流程如图甲所示:
、CaO)为原料制取单质的流程如图甲所示:


已知:①MIBK为甲基异丁基酮;②钽铌液中含有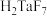 、
、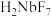 均为弱酸;③
均为弱酸;③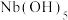 难溶于水。
难溶于水。
(1)酸溶时,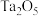 发生的反应的离子方程式为
发生的反应的离子方程式为_______ 。
(2)酸溶时,HF的浓度对铌、钽的浸出率的影响如图丙所示,则HF的最佳浓度为_______  。
。
(3)沉铌时,发生的反应的化学方程式为_______ 。
(4)电解制备铌的原理如图乙所示,阴极发生的电极反应为_______ 。
(5)铌(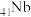 )和镍合金的用途非常广泛,Nb、Ni互化物的晶胞结构如图所示:
)和镍合金的用途非常广泛,Nb、Ni互化物的晶胞结构如图所示:

①铌元素位于周期表中的位置是_______ 。
②图中Nb原子与Ni原子的最短距离为_______ nm。
③Nb、Ni互化物晶体的密度为_______ 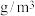 (列出计算式)。
(列出计算式)。
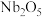 、
、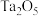 、
、 、CaO)为原料制取单质的流程如图甲所示:
、CaO)为原料制取单质的流程如图甲所示:

已知:①MIBK为甲基异丁基酮;②钽铌液中含有
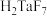 、
、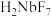 均为弱酸;③
均为弱酸;③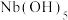 难溶于水。
难溶于水。(1)酸溶时,
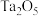 发生的反应的离子方程式为
发生的反应的离子方程式为(2)酸溶时,HF的浓度对铌、钽的浸出率的影响如图丙所示,则HF的最佳浓度为
 。
。(3)沉铌时,发生的反应的化学方程式为
(4)电解制备铌的原理如图乙所示,阴极发生的电极反应为
(5)铌(
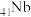 )和镍合金的用途非常广泛,Nb、Ni互化物的晶胞结构如图所示:
)和镍合金的用途非常广泛,Nb、Ni互化物的晶胞结构如图所示:
①铌元素位于周期表中的位置是
②图中Nb原子与Ni原子的最短距离为
③Nb、Ni互化物晶体的密度为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解题方法
9 . 氧族元素包括氧、硫、硒等,这些元素的单质及其化合物在工农业生产和科学研究中具有广泛的用途。回答下列问题:
(1)下列属于氧原子激发态的轨道表示式的有___________ (填字母,下同),其中失去最外层上一个电子所需能量最低的是___________ 。
a. b.
b.
c.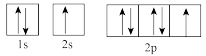 d.
d.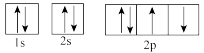
(2)科学研究表明,过硫化氢(也叫二硫化氢)加入烯烃中可制备硫醇,其熔沸点及制备方法如下表所示:
①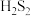 的结构为
的结构为 ,其中2个S原子的
,其中2个S原子的___________ 杂化轨道形成S—S___________ (填“ ”或“
”或“ ”)共价键。
”)共价键。
② 分子结构中H—O—O键角为
分子结构中H—O—O键角为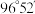 ,则
,则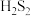 分子结构中H—S—S键角
分子结构中H—S—S键角___________ (填“=”“>”或“<”)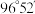 。
。
③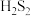 的熔沸点比
的熔沸点比 的熔沸点低的原因是
的熔沸点低的原因是___________ 。
(3)在能源逐渐匮乏的形势下,超导材料显得尤为重要。Li、Fe、Se三种元素组成的某新型超导材料的晶胞结构如图所示:
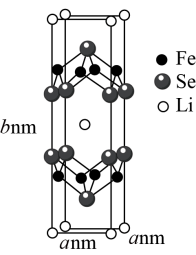
1个晶胞中的Se原子数为___________ 。晶胞的部分参数如图所示,且晶胞棱边夹角均为90°,晶体密度为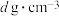 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为___________ (列式表示)。
(1)下列属于氧原子激发态的轨道表示式的有
a.
 b.
b.
c.
 d.
d.
(2)科学研究表明,过硫化氢(也叫二硫化氢)加入烯烃中可制备硫醇,其熔沸点及制备方法如下表所示:
| 物质 | 熔点/℃ | 沸点/℃ | 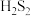 制备方法 制备方法 |
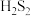 | -90.0 | 71.0 | 加热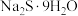 至熔融,再把硫溶入其中,得多硫化钠溶液。在263K下,将该溶液注入稀硫酸中,得多硫化氢混合物,分离、干燥、真空蒸馏,即得 至熔融,再把硫溶入其中,得多硫化钠溶液。在263K下,将该溶液注入稀硫酸中,得多硫化氢混合物,分离、干燥、真空蒸馏,即得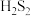 |
 | -0.4 | 150.0 |
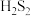 的结构为
的结构为 ,其中2个S原子的
,其中2个S原子的 ”或“
”或“ ”)共价键。
”)共价键。②
 分子结构中H—O—O键角为
分子结构中H—O—O键角为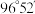 ,则
,则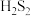 分子结构中H—S—S键角
分子结构中H—S—S键角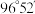 。
。③
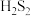 的熔沸点比
的熔沸点比 的熔沸点低的原因是
的熔沸点低的原因是(3)在能源逐渐匮乏的形势下,超导材料显得尤为重要。Li、Fe、Se三种元素组成的某新型超导材料的晶胞结构如图所示:

1个晶胞中的Se原子数为
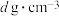 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
解题方法
10 . 钛是一种稀有金属,具有密度小、强度高、耐腐蚀等特点,钛和钛的化合物在航天、化工、建筑、日常生活中都有着广泛的用途。已知:阿伏加德罗常数的值为NA。
(1)基态钛原子价电子排布式为_______ ;与钛同周期的元素中,基态原子的未成对电子数与钛相同的还有_______ 种。
(2)钛的一种常见化合物是[Ti(H2O)6]Cl3,1mol该物质中含有σ键的数目为_______ ,配体H2O的VSEPR模型名称是_______ ,其沸点高于H2S,原因是_______ 。
(3)TO2与光气(COCl2)、氯化亚砜(SOCl2)等反应可以制得TiCl4,用于制造虹彩剂、烟雾、颜料等。
①氯化亚砜中心原子的杂化方式为_______ 杂化;
②光气是_______ 分子(填“极性”或“非极性”)。
(4)铁与钛同周期,某离子型铁氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为_______ 。已知该晶体的晶胞参数为a pm,阿伏加德罗常数的值为NA,则该晶体的密度d=_______  (用含a和NA的代数式表示)。
(用含a和NA的代数式表示)。

(1)基态钛原子价电子排布式为
(2)钛的一种常见化合物是[Ti(H2O)6]Cl3,1mol该物质中含有σ键的数目为
(3)TO2与光气(COCl2)、氯化亚砜(SOCl2)等反应可以制得TiCl4,用于制造虹彩剂、烟雾、颜料等。
①氯化亚砜中心原子的杂化方式为
②光气是
(4)铁与钛同周期,某离子型铁氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为
 (用含a和NA的代数式表示)。
(用含a和NA的代数式表示)。
您最近一年使用:0次



