解题方法
1 . 回答下列问题
(1)选择题(题目给出的四个选项中,有两个 选项是符合题目要求的)下列关于晶体的说法中,不正确 的是_____
(2)黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时发生反应:2CuFeS2 + O2 = Cu2S + 2FeS + SO2。
①Fe在周期表中的位置为_______ ;Fe、S、O原子的第一电离能由大到小的顺序是_______ 。
②Cu元素的基态原子的电子排布式为_______ ,有_______ 个未成对电子。
③SO2分子的立体构型为_______ ,SO2可氧化生成SO3,SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是_______ 。

④已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS的原因_______ 。
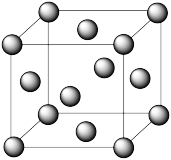
⑤Cu的晶胞如图所示,晶体密度为ρ g·cm-3,晶胞中等距最近的Cu原子有_______ 个,晶胞的边长为_______ (用含ρ和NA的式子表示)。
(1)选择题(题目给出的四个选项中,有
| A.MgO的晶格能远比NaCl大,这是因为前者粒子所带的电荷多,粒子半径小 |
| B.第一电离能:Cl>S>P>Si |
| C.金属原子在二维平面里放置得到非密置层和密置层两种方式,配位数分别为4和6 |
| D.共价键可决定分子晶体的熔、沸点 |
①Fe在周期表中的位置为
②Cu元素的基态原子的电子排布式为
③SO2分子的立体构型为

④已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS的原因

⑤Cu的晶胞如图所示,晶体密度为ρ g·cm-3,晶胞中等距最近的Cu原子有
您最近一年使用:0次
名校
解题方法
2 . 普鲁士蓝的部分或全部铁离子可以被其他过渡金属离子取代形成类普鲁士蓝化合物,其具有独特的空心微纳米结构可以增大电极和电解质的接触面积,为电化学反应提供更多的活性位点,可应用于析氢、析氧反应,超级电容器和金属离子电池等。某种普鲁士蓝面心立方体结构如图所示,晶格常数为11.02nm。回答下列问题:
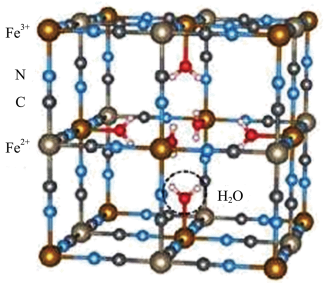
(1)写出Fe2+的核外电子排式为___________ 。
(2)写出一个与氰根离子(CN-)互为等电子体的分子的化学式___________ 。
(3)该晶体中与Fe3+形成配位键的配位原子有___________ (填元素名称);第一电离能最大的原子为___________ (填元素符号)。
(4)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的Fe原子,其自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的Fe原子,其自旋磁量子数的代数和为___________ 。
(5)该普鲁士蓝晶体密度为___________ g·cm-3(写出未经化简的表达式)。
(6)普鲁士蓝晶体中少部分铁原子被钴或镍原子取代可形成类普鲁士蓝,其晶体结构基本不变,但性能更加优良。下列有关替代原子说法错误的是
a.都处于副族,结构相似 b.常见化合价为+2或+3
c.均属于d区元素 d.替代离子与原离子的离子半径相近
(7)常用K3[Fe(CN)6]制备类普鲁士蓝化合物。在0.1mol·L-1 K3[Fe(CN)6]溶液中滴加几滴0.1mol·L-1 KSCN溶液,是否有血红色溶液生成,请通过计算说明。___________ (写出分析过程)
(已知:Fe3++6SCN-=Fe(SCN)
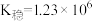 ;Fe3++6CN-=Fe(CN)
;Fe3++6CN-=Fe(CN)
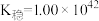 )。
)。

(1)写出Fe2+的核外电子排式为
(2)写出一个与氰根离子(CN-)互为等电子体的分子的化学式
(3)该晶体中与Fe3+形成配位键的配位原子有
(4)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的Fe原子,其自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的Fe原子,其自旋磁量子数的代数和为(5)该普鲁士蓝晶体密度为
(6)普鲁士蓝晶体中少部分铁原子被钴或镍原子取代可形成类普鲁士蓝,其晶体结构基本不变,但性能更加优良。下列有关替代原子说法错误的是
a.都处于副族,结构相似 b.常见化合价为+2或+3
c.均属于d区元素 d.替代离子与原离子的离子半径相近
(7)常用K3[Fe(CN)6]制备类普鲁士蓝化合物。在0.1mol·L-1 K3[Fe(CN)6]溶液中滴加几滴0.1mol·L-1 KSCN溶液,是否有血红色溶液生成,请通过计算说明。
(已知:Fe3++6SCN-=Fe(SCN)

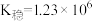 ;Fe3++6CN-=Fe(CN)
;Fe3++6CN-=Fe(CN)
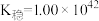 )。
)。
您最近一年使用:0次
解题方法
3 . A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A元素单质的电子式为________ ;B元素单质的一种空间网状结构的晶体,熔点>3550 ℃,该单质的晶体类型属于________________ ;基态D原子共有__________ 种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是__________ ,该分子与D2+、H2O以2∶1∶2的配比结合形成的配离子是_______ (填化学式),此配离子中的两种配体的不同之处为_____________ (填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数
③中心原子的化学键类型 ④VSEPR模型
(3)1 mol BC-中含有的π键数目为________ ;写出与BC-互为等电子体的分子和离子各一种________ 、_________ (填化学式)。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原因是___________________________ 。
(5)D3C具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3-半径分别为a pm、b pm,D+和C3-都是紧密接触的刚性小球,则C3-的配位数为________ ,晶体的密度为_____ g·cm-3。

(1)A元素单质的电子式为
(2)A与C形成的最简单分子的中心原子杂化方式是
①中心原子的价层电子对数 ②中心原子的孤电子对的对数
③中心原子的化学键类型 ④VSEPR模型
(3)1 mol BC-中含有的π键数目为
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原因是
(5)D3C具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3-半径分别为a pm、b pm,D+和C3-都是紧密接触的刚性小球,则C3-的配位数为

您最近一年使用:0次
名校
4 . 下图中①~⑨是元素周期表中的前四周期相应的元素,请从中选择合适的元素回答问题:
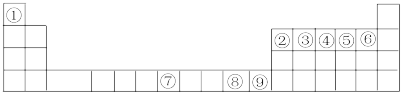
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的________ 区。元素⑨的价电子排布式为___________ 。
(2)②、⑥两元素形成的化合物的立体构型为________ ,其中心原子的杂化轨道类型为____________ 。
(3)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于_______ 晶体(填晶体类型)。元素⑦的未成对电子数为_____ 个。
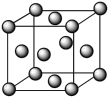
(4)元素⑧的二价阳离子与过量的④的氢化物的水化物反应的离子方程式为_____ 。元素⑧的单质的晶胞结构如图:已知晶胞的棱长为a cm,NA为阿伏加 德罗常数,则该晶体的密度为______ g/cm3(用a、NA表示)。

(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的
(2)②、⑥两元素形成的化合物的立体构型为
(3)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于
(4)元素⑧的二价阳离子与过量的④的氢化物的水化物反应的离子方程式为

您最近一年使用:0次



