1 . 在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是____________ (填标号)。
A. B.
B.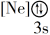 C.
C. D.
D.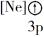
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是__________ 、__________ 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是__________ ,其中与乙二胺形成的化合物稳定性相对较高的是__________ (填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
解释表中氧化物之间熔点差异的原因__________ 。
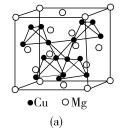
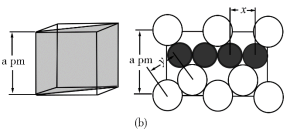
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=__________ pm,Mg原子之间最短距离y=__________ pm。设阿伏加 德罗常数的值为NA,则MgCu2的密度是__________ g·cm−3(列出计算表达式)。
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是
A.
 B.
B.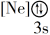 C.
C. D.
D.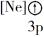
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是
(3)一些氧化物的熔点如下表所示:
| 氧化物 | Li2O | MgO | P4O6 | SO2 |
| 熔点/°C | 1570 | 2800 | 23.8 | −75.5 |
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=


您最近一年使用:0次
2019-06-09更新
|
15881次组卷
|
13卷引用:吉林省延边市第二中学2020届高三入学考试化学试题
吉林省延边市第二中学2020届高三入学考试化学试题2019年全国统一考试化学试题(新课标Ⅰ)(已下线)专题6.4 物质结构与性质(选考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题2020年全国卷Ⅰ理综化学高考真题变式题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题20 结构与性质(已下线)T35-物质结构与性质
名校
2 .  是离子晶体,其晶胞如下图1所示(已知氟化钙晶胞参数为a pm,
是离子晶体,其晶胞如下图1所示(已知氟化钙晶胞参数为a pm, 表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节
表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节 浊液的pH,测得在不同pH条件下,体系中
浊液的pH,测得在不同pH条件下,体系中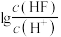 与
与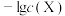 (X为
(X为 或
或 )的关系如图2所示。下列说法错误的是。
)的关系如图2所示。下列说法错误的是。
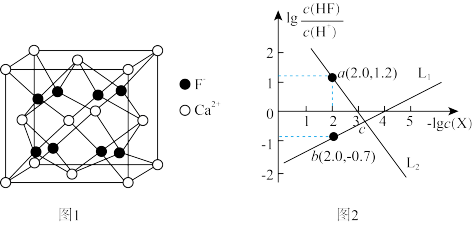
 是离子晶体,其晶胞如下图1所示(已知氟化钙晶胞参数为a pm,
是离子晶体,其晶胞如下图1所示(已知氟化钙晶胞参数为a pm, 表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节
表示阿伏加德罗常数的值),难溶于水、可溶于酸。常温下,用盐酸调节 浊液的pH,测得在不同pH条件下,体系中
浊液的pH,测得在不同pH条件下,体系中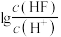 与
与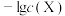 (X为
(X为 或
或 )的关系如图2所示。下列说法错误的是。
)的关系如图2所示。下列说法错误的是。
A.每个氟化钙晶胞中含有 的数目为4个 的数目为4个 |
B.氟化钙的晶体密度为 |
C. 表示 表示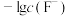 与 与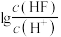 的变化曲线 的变化曲线 |
D.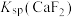 的数量级为 的数量级为 |
您最近一年使用:0次
2022-12-16更新
|
939次组卷
|
8卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
3 . 碳和硫的化合物种类繁多,应用广泛。例如CS2是一种优良的溶剂,也是用于制造黏胶纤维、玻璃的重要原材料。回答下列问题。
I.CCl4曾广泛用作溶剂、灭火剂。
(1)基态氯原子价层电子的空间运动状态有___________ 种。基态碳原子的价电子排布是否可以表示为 ,
,___________ (填“是”或“否”),原因为___________ 。
(2)CCl4在500℃以上时可以与水反应,产生有毒的光气(COCl2)。SiCl4常温遇水水解作用很激烈,产生浑浊和气体。造成两者水解差异的因素有___________ (填标号)。
a.Si的原子半径更大 b.Si-Cl键的键能更大
c.Si-Cl键的极性更大 d.Si有更多的价层轨道
光气分子中Cl-C-Cl的键角___________ (填“大于”、“小于”或“等于”)甲醛分子中H-C-H的键角,原因为___________ 。
Ⅱ.硫代硫酸盐可用于矿石提取银、鞣制皮革等。
(3)硫代硫酸根( )中心原子的杂化方式为
)中心原子的杂化方式为___________ 。硫代硫酸盐用于矿石提取银时形成 ,该配合物中提供孤电子对的原子为
,该配合物中提供孤电子对的原子为___________ (填标号),原因为___________ 。
a.端基硫原子 b.中心硫原子 c.氧原子
(4)某硫代硫酸盐的晶胞结构如图。Mn+的n=___________ 。原子b的分数坐标为(0,0,0),则原子a的分数坐标为___________ 。
I.CCl4曾广泛用作溶剂、灭火剂。
(1)基态氯原子价层电子的空间运动状态有
 ,
,(2)CCl4在500℃以上时可以与水反应,产生有毒的光气(COCl2)。SiCl4常温遇水水解作用很激烈,产生浑浊和气体。造成两者水解差异的因素有
a.Si的原子半径更大 b.Si-Cl键的键能更大
c.Si-Cl键的极性更大 d.Si有更多的价层轨道
光气分子中Cl-C-Cl的键角
Ⅱ.硫代硫酸盐可用于矿石提取银、鞣制皮革等。
(3)硫代硫酸根(
 )中心原子的杂化方式为
)中心原子的杂化方式为 ,该配合物中提供孤电子对的原子为
,该配合物中提供孤电子对的原子为a.端基硫原子 b.中心硫原子 c.氧原子
(4)某硫代硫酸盐的晶胞结构如图。Mn+的n=

您最近一年使用:0次
2024-02-02更新
|
469次组卷
|
4卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三下学期开学化学试题
20-21高三上·江苏南通·阶段练习
名校
4 . 钴的一种化合物的晶胞结构如图所示,下列说法正确的是


| A.元素钛在元素周期表中的位置为第四周期V B族 |
| B.Co2+的基态核外电子排布式为1s2 2s2 2p63s2 3p63d54s2 |
| C.与Co2+距离最近的Ti4+有4个 |
| D.该化合物的化学式为CoTiO3 |
您最近一年使用:0次
2022-05-27更新
|
735次组卷
|
21卷引用:吉林省长春市第二实验中学2021-2022学年高二下学期开学考试化学试题
吉林省长春市第二实验中学2021-2022学年高二下学期开学考试化学试题(已下线)江苏省如皋市2021届高三上学期第三次月考化学试题江苏省江阴市第一中学2021届高三12月份阶段性检测化学试题江苏省南京市第十三中学2021届高三上学期教学质量调研(三)化学试题福建省泉州科技中学2020-2021学年高二下学期第一次月考化学试题山东省济宁市兖州区2020-2021学年高二下学期期中考试化学试题湖南省衡阳市田家炳实验中学2021-2022学年高二下学期3月质量检测化学试题重庆市实验中学校2021-2022学年高二下学期第一次月考化学试题云南省昆明市第一中学2021-2022学年高二下学期期中考试化学试题北京市第二十二中学 2021-2022 学年高二下学期期中考试化学试题黑龙江省大庆市大庆中学2021-2022学年高二下学期期中考试化学试题广东省江门市鹤山区鹤华中学2021-2022学年高二下学期期中考试化学试题专题3 微粒间作用力与物质性质 第二单元 离子键 离子晶体山西省临汾市尧都区山西师范大学实验中学2021-2022学年高二下学期第一次月考化学考试试题湖北省武汉市钢城第四中学2021-2022学年高二下学期期中考试化学试题黑龙江省佳木斯市第八中学2021-2022学年高二下学期期中考试化学试题四川省广安市邻水县二中 2022-2023学年高三上学期9月考化学试题天津市第四十七中学2022-2023学年高三上学期期中考试化学试题3.2.1离子键 离子晶体 课后内蒙古呼伦贝尔市海拉尔第二中学2023-2024学年高二上学期期末考试化学试题(已下线)热点06 物质的聚集状态与晶体的常识
名校
解题方法
5 . 硼、碳、氮、磷、硫等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___________ (填字母)。
A. B.
B.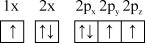
C.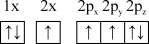 D.
D.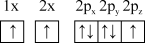
(2)氢、硼、碳、硫四元素的电负性由大到小的顺序为___________
(3)(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为___________ 。其σ键分别为___________ 型σ键。
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为___________

(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是___________
(6)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性 (晶体结构如图)。
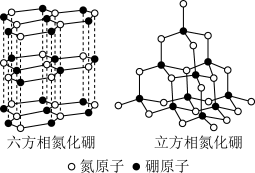
①关于这两种晶体的说法,不正确的是___________ (填字母)。
a.两种晶体均为分子晶体
b.两种晶体中的B﹣N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软
d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体其结构与石墨相似却不导电,原因是___________
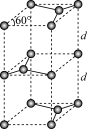
(7)石墨的晶胞结构如图所示。已知石墨的密度为ρg·cm-3,C-C键的键长为r cm,NA为阿伏加德罗常数的值,则石墨晶体的层间距d=___________ cm。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是
A.
 B.
B.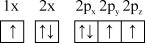
C.
 D.
D.
(2)氢、硼、碳、硫四元素的电负性由大到小的顺序为
(3)(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为

(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是
| 碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 金属阳离子半径/pm | 66 | 99 | 112 | 135 |

①关于这两种晶体的说法,不正确的是
a.两种晶体均为分子晶体
b.两种晶体中的B﹣N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软
d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体其结构与石墨相似却不导电,原因是
(7)石墨的晶胞结构如图所示。已知石墨的密度为ρg·cm-3,C-C键的键长为r cm,NA为阿伏加德罗常数的值,则石墨晶体的层间距d=

您最近一年使用:0次
2021-05-24更新
|
321次组卷
|
2卷引用:吉林省长春外国语学校2022届高三上学期期初考试化学试题
名校
6 . 研究表明新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”。回答下列问题:
(1)铜晶胞中,铜原子位于立方体的顶点和面心,铜原子的配位数为___________
(2)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),其中非金属元素电负性由大到小的顺序是___________ ,SO 的空间构型为
的空间构型为___________ 。
(3)氨缩脲(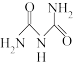 )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为___________ ,σ 键与π键的数目之比为___________ 。
(4)已知CuCl的晶胞结构如图所示:晶胞中C、D两原子核间距为290pm,阿伏加德罗常数的值为NA,则该晶体密度为___________ g·cm-3(列出计算式即可)。
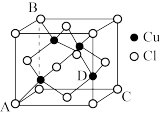
(1)铜晶胞中,铜原子位于立方体的顶点和面心,铜原子的配位数为
(2)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4(碱式硫酸铜),其中非金属元素电负性由大到小的顺序是
 的空间构型为
的空间构型为(3)氨缩脲(
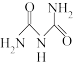 )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为(4)已知CuCl的晶胞结构如图所示:晶胞中C、D两原子核间距为290pm,阿伏加德罗常数的值为NA,则该晶体密度为

您最近一年使用:0次
名校
解题方法
7 . 材料是人类文明进步的阶梯,第ⅢA、ⅣA、ⅤA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)基态Ge原子的核外电子有__ 种不同的空间运动状态。
(2)P、S、Cl的第一电离能由大到小的顺序为__ 。
(3)M与Ga位于同周期,M3+的一种配合物组成为[M(NH3)5(H2O)]Cl3。
①下列有关NH3、H2O的说法正确的是__ (填字母)。
a.分子空间构型相同
b.中心原子杂化类型相同
c.键角大小相同
②1mol[M(NH3)5(H2O)]3+含__ 个σ键。
③配合物T与[M(NH3)5(H2O)]Cl3组成元素的种类和数目相同,中心离子的配位数相同。1molT溶于水,加入足量AgNO3溶液可生成2molAgCl。则T的化学式为___ 。
(4)如图甲为硼酸晶体的片层结构,其中硼的杂化方式为__ 。H3BO3在热水中比冷水中溶解度显著增大的主要原因是__ 。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图乙所示,该晶胞中B原子相连构成几何体的空间构型为__ (填“立方体”或“正四面体”或“正八面体”)。已知该晶体的密度为ρg·cm-3,NA是阿伏加 德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为__ pm(列式即可)。

(1)基态Ge原子的核外电子有
(2)P、S、Cl的第一电离能由大到小的顺序为
(3)M与Ga位于同周期,M3+的一种配合物组成为[M(NH3)5(H2O)]Cl3。
①下列有关NH3、H2O的说法正确的是
a.分子空间构型相同
b.中心原子杂化类型相同
c.键角大小相同
②1mol[M(NH3)5(H2O)]3+含
③配合物T与[M(NH3)5(H2O)]Cl3组成元素的种类和数目相同,中心离子的配位数相同。1molT溶于水,加入足量AgNO3溶液可生成2molAgCl。则T的化学式为
(4)如图甲为硼酸晶体的片层结构,其中硼的杂化方式为
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图乙所示,该晶胞中B原子相连构成几何体的空间构型为

您最近一年使用:0次
2020-06-12更新
|
187次组卷
|
2卷引用:吉林省延边第二中学2022-2023学年高三上学期开学调研考试化学试题
8 . 碳是地球上组成生命的最基本的元素之一。根据要求回答下列问题:
(1)碳原子的价电子排布图:________________ ,核外有______ 种不同运动状态的电子。
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。

①嘌呤中所有元素的电负性由大到小的顺序______________________ 。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因_________________________________ 。
③吡啶结构中N 原子的杂化方式___________ 。
④分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为
)。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为______________ 。
(3)碳可形成CO、CO2、H2CO3等多种无机化合物。
①在反应CO 转化成CO2 的过程中,下列说法正确的是__________ 。
A.每个分子中孤对电子数不变 B.分子极性变化
C.原子间成键方式改变 D.分子的熔沸点变大
②干冰和冰是两种常见的分子晶体,晶体中的空间利用率:干冰_______ 冰。(填“>”、 “<”或“=”)
③H2CO3与H3PO4均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因___________ 。
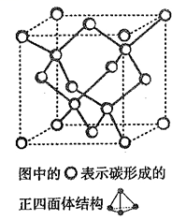
(4)在2017 年,中外科学家团队共同合成了碳的一种新型同素异形体: T- 碳。T- 碳的结构是:将立方金刚石中的每个碳原子用一个由4 个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构,如下图。已知T- 碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T- 碳的密度的表达式为______________ g/cm3。
(1)碳原子的价电子排布图:
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。

①嘌呤中所有元素的电负性由大到小的顺序
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因
③吡啶结构中N 原子的杂化方式
④分子中的大π键可以用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为
)。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为(3)碳可形成CO、CO2、H2CO3等多种无机化合物。
①在反应CO 转化成CO2 的过程中,下列说法正确的是
A.每个分子中孤对电子数不变 B.分子极性变化
C.原子间成键方式改变 D.分子的熔沸点变大
②干冰和冰是两种常见的分子晶体,晶体中的空间利用率:干冰
③H2CO3与H3PO4均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因
(4)在2017 年,中外科学家团队共同合成了碳的一种新型同素异形体: T- 碳。T- 碳的结构是:将立方金刚石中的每个碳原子用一个由4 个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构,如下图。已知T- 碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T- 碳的密度的表达式为

您最近一年使用:0次
9 . 铜、锌为ds区元素,它们的单质及化合物在工业生产中具有重要的用途。回答下列问题:
(1)基态锌原子占据最高能级的电子云轮廓图为______ 形,基态铜原子的价层电子排布图为______ ,与铜同周期且与铜具有相同未成对电子数目的元素有______ (填元素符号)。
(2)铜的第二电离能______ (填“>”“<”或=”)锌的第二电离能,其主要原因是______ 。
(3)某含铜(Ⅱ)配合物的结构式如图:
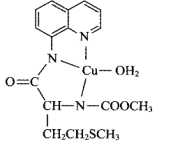
 该配合物中含有
该配合物中含有______  配位键,N原子的杂化方式为
配位键,N原子的杂化方式为______ ,N、O、S中原子半径最大的是______ , 键的共价键类型为
键的共价键类型为 键,则
键,则 键的共价键类型为
键的共价键类型为______ 。
(4)锌单质的晶胞采用六方最密堆积,其晶胞结构如图所示:
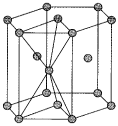
若距离最近的两个Zn原子的核间距为anm,阿伏加德罗常数的值为 ,则Zn晶体的密度为
,则Zn晶体的密度为______  。
。
(1)基态锌原子占据最高能级的电子云轮廓图为
(2)铜的第二电离能
(3)某含铜(Ⅱ)配合物的结构式如图:

 该配合物中含有
该配合物中含有 配位键,N原子的杂化方式为
配位键,N原子的杂化方式为 键的共价键类型为
键的共价键类型为 键,则
键,则 键的共价键类型为
键的共价键类型为(4)锌单质的晶胞采用六方最密堆积,其晶胞结构如图所示:

若距离最近的两个Zn原子的核间距为anm,阿伏加德罗常数的值为
 ,则Zn晶体的密度为
,则Zn晶体的密度为 。
。
您最近一年使用:0次
10 . 钠、镁、铝、铜及其化合物在生活中具有重要作用。回答下列问题:
(1)基态Cu+的价层轨道表示式为___________ 。
(2)Na、Mg、Al的第一电离能由大到小的顺序为___________ (填元素符号)。
(3)铝离子电池一般采用离子液体作为电解质,某含铝离子液体的结构如图:
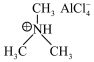
该化合物中阴离子的空间构型为___________ ;传统的有机溶剂大多易挥发,而离子液体相对难挥发,原因是___________ 。
(4)几种氧化物的化学键中离子键成分的百分数和氧化物的熔点如下表:
离子键成分的百分数:MgO高于Al2O3,其原因是___________ ;熔点:MgO高于Na2O,从结构的角度解释其原因是___________ 。
(5)NaCl的晶胞如图所示。NaCl的密度为ρ g/cm3,在NaCl晶体里Na+和Cl-的最短距离为apm,则阿伏加德罗常数的值为___________ (用含a、ρ的表达式表示)。
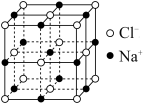
(1)基态Cu+的价层轨道表示式为
(2)Na、Mg、Al的第一电离能由大到小的顺序为
(3)铝离子电池一般采用离子液体作为电解质,某含铝离子液体的结构如图:

该化合物中阴离子的空间构型为
(4)几种氧化物的化学键中离子键成分的百分数和氧化物的熔点如下表:
| 氧化物 | Na2O | MgO | Al2O3 |
| 离子键的百分数/% | 62 | 50 | 41 |
| 熔点/℃ | 1132 | 2852 | 2054 |
(5)NaCl的晶胞如图所示。NaCl的密度为ρ g/cm3,在NaCl晶体里Na+和Cl-的最短距离为apm,则阿伏加德罗常数的值为

您最近一年使用:0次



