1 . 有关晶体的结构如图所示,下列说法不正确的是
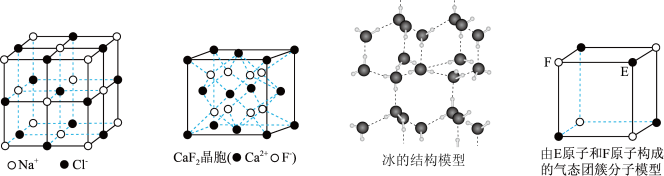
| A.在NaCl晶体中,距Cl-最近的Na+形成正八面体 |
| B.在CaF2晶体中,每个晶胞平均含有4个Ca2+ |
| C.冰晶体中每个水分子与另外四个水分子形成四面体结构 |
| D.该气态团簇分子的分子式为EF |
您最近一年使用:0次
2024-03-01更新
|
1082次组卷
|
6卷引用:浙江省台州市书生中学2023-2024学年高二下学期起始考化学试卷
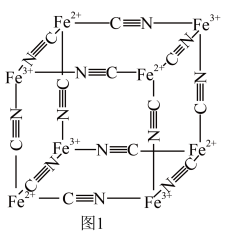
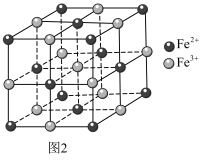
2 . 普鲁士蓝的化学式为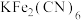 ,其结构如图1(可能位于中心的
,其结构如图1(可能位于中心的 未标出)或图2(
未标出)或图2( 、
、 未标出)所示。
未标出)所示。
请回答:
(1)基态Fe价电子轨道表示式为_______ 。
(2)已知铁的电离能数据如下:
则,铁的第四电离能( )大于第三电离能(
)大于第三电离能( )的可能原因是:
)的可能原因是:_______ 。
(3)关于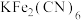 晶体下列说法不正确的是_______(填序号)。
晶体下列说法不正确的是_______(填序号)。
(4)可溶性氰化物(如KCN)有剧毒,但普鲁士蓝却无毒,请从结构角度解释普鲁士蓝无毒的原因是_______ 。
(5)图2晶胞中 的个数为
的个数为_______ ,设普鲁士蓝的最简式的式量为Mr,晶体密度为 ,则相邻
,则相邻 之间的最短距离为
之间的最短距离为_______ nm。(列出计算式, 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
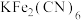 ,其结构如图1(可能位于中心的
,其结构如图1(可能位于中心的 未标出)或图2(
未标出)或图2( 、
、 未标出)所示。
未标出)所示。
请回答:
(1)基态Fe价电子轨道表示式为
(2)已知铁的电离能数据如下:
电离能/( ) ) |  |  |  |  | …… |
| Fe | 759 | 1561 | 2597 | 5290 | …… |
 )大于第三电离能(
)大于第三电离能( )的可能原因是:
)的可能原因是:(3)关于
 晶体下列说法不正确的是_______(填序号)。
晶体下列说法不正确的是_______(填序号)。| A.存在的化学键有σ键、π键、配位键、离子键等 |
B.Fe、N、C的电负性由大到小的顺序: |
C.晶体中 的键能>KCN中 的键能>KCN中 的键能 的键能 |
D.晶胞中 、 、 原子均参与形成配位键,其配位数之比为6:6 原子均参与形成配位键,其配位数之比为6:6 |
(5)图2晶胞中
 的个数为
的个数为 ,则相邻
,则相邻 之间的最短距离为
之间的最短距离为 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
您最近一年使用:0次
2023-05-06更新
|
711次组卷
|
4卷引用:浙江省名校协作体2023-2024学年高三上学期开学适应性考试化学试题
浙江省名校协作体2023-2024学年高三上学期开学适应性考试化学试题浙江省温州市2023届高三下学期5月第三次模拟适应性考试化学试题(已下线)【2023】【高三下】【模拟考】【温州三模】【高中化学】【李鼎收集】(已下线)专题04 物质结构与性质(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)
名校
解题方法
3 . 电池在人类生产生活中具有十分重要的作用,单晶硅和铜、锗、镓等的化合物常作为制备太阳能电池的原料。回答下列问题:
(1)基态镓原子的价层电子排布图是___________ 。
(2)四氯化硅属于___________ 晶体,硅原子的杂化方式是___________ 。
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是___________ 。
(4)比较键角∠HNH:H2N−NH2中的−NH2___________ H2N−NH 中的−NH
中的−NH (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由___________ 。
(5)下图为铜的某种氯化物晶胞示意图,试回答下列问题___________ 。原子坐标参数可表示晶胞内部各原子的相对位置,图中各原子标参数分别为A(0,0,0);B(0,1,1);C(1,1,0);则D原子的坐标参数为___________ 。
②晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体的密度___________ g/cm3(列出计算式即可)。
(1)基态镓原子的价层电子排布图是
(2)四氯化硅属于
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(4)比较键角∠HNH:H2N−NH2中的−NH2
 中的−NH
中的−NH (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由(5)下图为铜的某种氯化物晶胞示意图,试回答下列问题
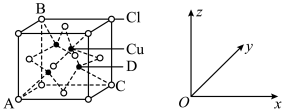
②晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体的密度
您最近一年使用:0次
2024-03-01更新
|
543次组卷
|
2卷引用:浙江省台州市书生中学2023-2024学年高二下学期起始考化学试卷
名校
解题方法
4 . 有关晶体的结构如图所示,下列说法中不正确的是


| A.在金刚石晶体中,碳原子与碳碳键个数之比为1:2 |
| B.该气态团簇分子的分子式为EF或FE |
| C.在NaCl晶体中,距Na+最近的Cl-形成正八面体形 |
| D.在CaF2晶体中,每个晶胞平均占有4个Ca2+ |
您最近一年使用:0次
2022-07-10更新
|
652次组卷
|
6卷引用:浙江省舟山市普陀中学2023届高三返校考试化学试题
名校
解题方法
5 . 化学,让生活更美好。回答下列问题:
(1)乳酸亚铁 是一种常用的补铁剂。
是一种常用的补铁剂。
①基态 核外电子的空间运动状态有
核外电子的空间运动状态有__________ 种。
②乳酸分子中 键与
键与 键的数目比为
键的数目比为__________ 。
③乳酸亚铁中各元素的电负性由大到小的顺序为__________ 。
(2)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:

①该新药分子中有__________ 种不同化学环境的C原子。
②研究发现,适量硒酸钠 可减轻重金属铊引起的中毒。比较键角大小:
可减轻重金属铊引起的中毒。比较键角大小:
__________  (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是__________ 。
(3) 广泛应用于太阳能电池领域。以
广泛应用于太阳能电池领域。以 、
、 和抗坏血酸为原料,可制备
和抗坏血酸为原料,可制备 。抗坏血酸的分子结构如图1所示,
。抗坏血酸的分子结构如图1所示, 晶胞如图2所示。
晶胞如图2所示。

①抗坏血酸的分子式是__________ , 的价层电子轨道表示式为
的价层电子轨道表示式为__________ 。
②下列说法中不正确 的是__________ 。
A.抗坏血酸分子中碳原子的轨道杂化类型为
B.抗坏血酸难溶于水,易溶于乙醇
C.抗坏血酸与足量氢气完全催化还原后的分子中有5个手性碳原子
D. 在水溶液中以
在水溶液中以 形式存在,
形式存在, 的配位原子为
的配位原子为
③ 晶胞为立方体,边长为
晶胞为立方体,边长为 ,设
,设 为阿伏加德罗常数的值,则晶胞的密度
为阿伏加德罗常数的值,则晶胞的密度
__________  。
。
(1)乳酸亚铁
 是一种常用的补铁剂。
是一种常用的补铁剂。①基态
 核外电子的空间运动状态有
核外电子的空间运动状态有②乳酸分子中
 键与
键与 键的数目比为
键的数目比为③乳酸亚铁中各元素的电负性由大到小的顺序为
(2)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:

①该新药分子中有
②研究发现,适量硒酸钠
 可减轻重金属铊引起的中毒。比较键角大小:
可减轻重金属铊引起的中毒。比较键角大小:
 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),原因是
”),原因是(3)
 广泛应用于太阳能电池领域。以
广泛应用于太阳能电池领域。以 、
、 和抗坏血酸为原料,可制备
和抗坏血酸为原料,可制备 。抗坏血酸的分子结构如图1所示,
。抗坏血酸的分子结构如图1所示, 晶胞如图2所示。
晶胞如图2所示。
①抗坏血酸的分子式是
 的价层电子轨道表示式为
的价层电子轨道表示式为②下列说法中
A.抗坏血酸分子中碳原子的轨道杂化类型为

B.抗坏血酸难溶于水,易溶于乙醇
C.抗坏血酸与足量氢气完全催化还原后的分子中有5个手性碳原子
D.
 在水溶液中以
在水溶液中以 形式存在,
形式存在, 的配位原子为
的配位原子为
③
 晶胞为立方体,边长为
晶胞为立方体,边长为 ,设
,设 为阿伏加德罗常数的值,则晶胞的密度
为阿伏加德罗常数的值,则晶胞的密度
 。
。
您最近一年使用:0次
名校
解题方法
6 . 用低品铜矿(主要含CuS、FeO)制备Cu2O的一种工艺流程如下:
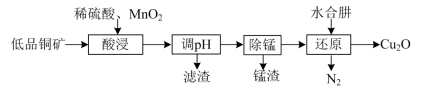
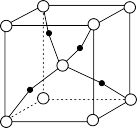
下列说法正确的是


下列说法正确的是
A.“酸浸”过程中CuS发生反应的离子方程式为: S2-+MnO2+4H+ Mn2++S+2H2O Mn2++S+2H2O |
| B.“酸浸”所得溶液中的阳离子主要有H+、Mn2+、Cu2+和Fe2+ |
| C.1个Cu2O晶胞(如图)中含4个氧原子 |
| D.水合肼浓度过大,Cu2O产率下降,可能的原因是Cu2O进一步被还原成单质铜 |
您最近一年使用:0次
2022-05-31更新
|
545次组卷
|
3卷引用:浙江省舟山市舟山中学2021-2022学年高三上学期开学考试化学试题
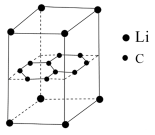
7 . 碳族化合物在研究和生产中有许多重要用途,请回答下列问题:
(1)已知 中硅元素为+4价,则H、Si、O、C的电负性由大到小的顺序为
中硅元素为+4价,则H、Si、O、C的电负性由大到小的顺序为_______ 。
(2)基态锗原子(Ge)价层电子的轨道表示式为_______ 。
(3)邻羟基苯甲酸的沸点比对羟基苯甲酸的沸点低;请解释其原因_______ 。
(4)氮化硅(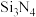 )是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且均达到8电子稳定结构,请比较晶体结构中键角大小:N—Si—N
)是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且均达到8电子稳定结构,请比较晶体结构中键角大小:N—Si—N_______ Si—N—Si(填“>”“<”“=”)。
(5)某锂电池的负极材料是将锂原子嵌入到两层石墨烯层中间,其晶体结构如图。已知该晶体中最近的两个碳原子核间距离为a nm,石墨烯层间距离为b nm,则该晶体的密度为_______  (用
(用 表示阿伏加德罗常数,列式即可)。
表示阿伏加德罗常数,列式即可)。
(1)已知
 中硅元素为+4价,则H、Si、O、C的电负性由大到小的顺序为
中硅元素为+4价,则H、Si、O、C的电负性由大到小的顺序为(2)基态锗原子(Ge)价层电子的轨道表示式为
(3)邻羟基苯甲酸的沸点比对羟基苯甲酸的沸点低;请解释其原因
(4)氮化硅(
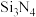 )是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且均达到8电子稳定结构,请比较晶体结构中键角大小:N—Si—N
)是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且均达到8电子稳定结构,请比较晶体结构中键角大小:N—Si—N
(5)某锂电池的负极材料是将锂原子嵌入到两层石墨烯层中间,其晶体结构如图。已知该晶体中最近的两个碳原子核间距离为a nm,石墨烯层间距离为b nm,则该晶体的密度为
 (用
(用 表示阿伏加德罗常数,列式即可)。
表示阿伏加德罗常数,列式即可)。
您最近一年使用:0次
解题方法
8 . 硼及其化合物在工农业生产、新型材料等方面应用广泛,回答下列问题:
(1)基态硼原子的价层电子排布式是______ 。
(2)下列说法不正确 的是______ 。
(3)储氢材料氨硼烷水解释放氢气:3NH3BH3+6H2O 3NH
3NH +
+ +9H2↑。反应中硼原子的杂化轨道类型由
+9H2↑。反应中硼原子的杂化轨道类型由______ 变为______ 。
(4)AlF3的熔点(1040℃)远高于BF3的熔点(-127℃),从晶体类型及微粒间作用力角度分析其原因______ 。
(5)硼化镁是一种离子晶体,属于六方晶系(如图1),a=b≠c, α=90°,β=120°,镁层和硼层交替排列,硼原子层形成平面六元并环结构。硼化镁晶体沿z轴方向的投影如图2所示。

①硼化镁的化学式为______ 。
②B的配位数(紧邻的镁原子数)是______ 。
(1)基态硼原子的价层电子排布式是
(2)下列说法
| A.根据对角线规则,B元素的一些化学性质与Si元素相似 |
| B.第一电离能(I1):I1(Be)<I1(B)<I1(C) |
| C.BF3的空间结构为平面三角形 |
| D.晶体硼的熔点为2300℃,推测其为共价晶体 |
(3)储氢材料氨硼烷水解释放氢气:3NH3BH3+6H2O
 3NH
3NH +
+ +9H2↑。反应中硼原子的杂化轨道类型由
+9H2↑。反应中硼原子的杂化轨道类型由(4)AlF3的熔点(1040℃)远高于BF3的熔点(-127℃),从晶体类型及微粒间作用力角度分析其原因
(5)硼化镁是一种离子晶体,属于六方晶系(如图1),a=b≠c, α=90°,β=120°,镁层和硼层交替排列,硼原子层形成平面六元并环结构。硼化镁晶体沿z轴方向的投影如图2所示。

①硼化镁的化学式为
②B的配位数(紧邻的镁原子数)是
您最近一年使用:0次
名校
9 . 铬是不锈钢的合金元素之一,目前被广泛应用于冶金、化工等领域。
(1)基态Cr原子价层电子的电子排布式为_______ 。
(2)金属铬的第二电离能(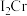 )和锰的第二电离能(
)和锰的第二电离能(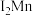 )分别为1590.6kJ/mol、1509.0kJ/mol,
)分别为1590.6kJ/mol、1509.0kJ/mol,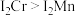 的原因是
的原因是_______ 。
(3) 的熔点(83℃)比
的熔点(83℃)比 的熔点(1100℃)低得多,这是因为
的熔点(1100℃)低得多,这是因为_______ 。
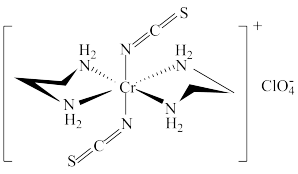
(4)Cr的一种配合物结构如图所示,该配合物阳离子中Cr的配位数为_______ ,阴离子 的空间构型为
的空间构型为_______ 。
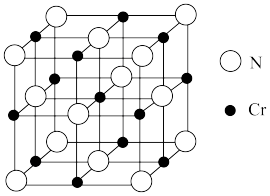
(5)氮化铬晶体的晶胞结构如图所示,若N与Cr核间距离为a pm( ),则氮化铬的密度为
),则氮化铬的密度为_______ g·cm-3。
(1)基态Cr原子价层电子的电子排布式为
(2)金属铬的第二电离能(
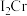 )和锰的第二电离能(
)和锰的第二电离能(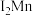 )分别为1590.6kJ/mol、1509.0kJ/mol,
)分别为1590.6kJ/mol、1509.0kJ/mol, 的原因是
的原因是(3)
 的熔点(83℃)比
的熔点(83℃)比 的熔点(1100℃)低得多,这是因为
的熔点(1100℃)低得多,这是因为(4)Cr的一种配合物结构如图所示,该配合物阳离子中Cr的配位数为
 的空间构型为
的空间构型为
(5)氮化铬晶体的晶胞结构如图所示,若N与Cr核间距离为a pm(
 ),则氮化铬的密度为
),则氮化铬的密度为
您最近一年使用:0次
2022-07-05更新
|
374次组卷
|
4卷引用:浙江省舟山市舟山中学2021-2022学年高三上学期开学考试化学试题
浙江省舟山市舟山中学2021-2022学年高三上学期开学考试化学试题浙江省湖州市2021-2022学年高二下学期期末调研测试化学试题(已下线)2023年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷A(已下线)专题02 物质结构专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)
解题方法
10 . 下列说法正确的是
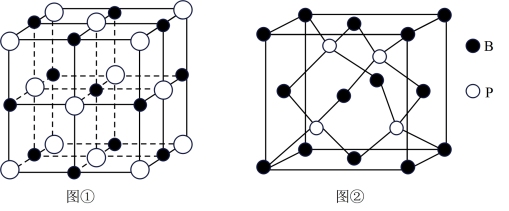

| A.一种由M原子(顶角和面心)和N原子(棱的中心和体心)构成的气态团簇分子结构如图①所示,它的化学式为MN |
| B.若图①为NaCl晶胞,则Na+周围紧邻的Na+数目是12个,Na+周围紧邻的Cl-数目是8个 |
| C.H2S和H2O分子结构相似,但在H2S晶体中一个H2S分子的配位数为12,而冰中H2O的配位数为4,是因为共价键具有饱和性和方向性 |
| D.磷化硼(BP)晶体结构(如图②)与金刚石相似,都是共价晶体,由晶胞结构可知B和P原子均满足8电子稳定结构 |
您最近一年使用:0次



