名校
解题方法
1 . La、Cu、O组成复合氧化物是超导体基体材料,可以做光催化分解水的电极材料,对制备绿色无污染的氢能源意义重大。回答下列问题:
(1)基态Cu原子核外电子排布式为___ 。
(2)我们可以用n+0.7I的值作为电子填充次序的近似规则,量子数n称为主量子数,其值可以取正整数1、2、3、4、5、6、7,对应的符号为K、L、M、N、O、P、Q;I与亚层对应关系表为:
计算5f能级的值为___ 。
(3)已知铜的某些化合物的熔点:
则CuSe为___ 晶体,CuSe的熔点大于CuS的熔点的原因是___ 。
(4)一种Cu2+的配合离子结构简式为: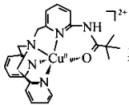 其中,N原子的杂化方式为
其中,N原子的杂化方式为___ ,Cu2+的配位数为___ 。
(5)与Cu(NO3)2中阴离子电子总数相同的等电子体的分子为___ (任写一种)。
(6)La、Cu、O组成的新型超导材料晶体结构及晶胞内各原子的位置关系如图所示。

①该新型超导材料的化学式为___ 。
②已知晶胞参数底边anm,高bnm,阿伏加德罗常数的值为NA,该晶胞密度为___ g·cm-3。
(1)基态Cu原子核外电子排布式为
(2)我们可以用n+0.7I的值作为电子填充次序的近似规则,量子数n称为主量子数,其值可以取正整数1、2、3、4、5、6、7,对应的符号为K、L、M、N、O、P、Q;I与亚层对应关系表为:
| I | 0 | 1 | 2 | 3 |
| 亚层符号 | s | p | d | f |
计算5f能级的值为
(3)已知铜的某些化合物的熔点:
| CuO | CuS | CuSe | |
| 熔点(℃) | 1326 | 103 | 387 |
则CuSe为
(4)一种Cu2+的配合离子结构简式为:
 其中,N原子的杂化方式为
其中,N原子的杂化方式为(5)与Cu(NO3)2中阴离子电子总数相同的等电子体的分子为
(6)La、Cu、O组成的新型超导材料晶体结构及晶胞内各原子的位置关系如图所示。

①该新型超导材料的化学式为
②已知晶胞参数底边anm,高bnm,阿伏加德罗常数的值为NA,该晶胞密度为
您最近一年使用:0次
2021-09-10更新
|
107次组卷
|
2卷引用:湖南省天壹名校联盟 2022届高三入学摸底考试化学试题
2 . 随着科学的发展,氟及其化合物的用途日益广泛。
Ⅰ.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如下图。
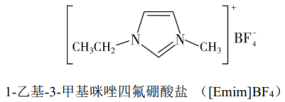
(1)基态N原子的价层电子轨道表示式为_______ 。
(2)①N、F、P三种元素的电负性由大到小的顺序为_______ 。
②根据VSEPR模型, 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为_______ ,空间结构为_______ 形。
(3) 是制备此离子液体的原料。
是制备此离子液体的原料。
①微粒中F—B—F键角:
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
② 可以与NaF反应生成
可以与NaF反应生成 的原因是
的原因是_______ 。
(4)以 和
和 的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为
的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为_______ ,电解质溶液中 向
向_______ (填“阴”或“阳”)极移动。
Ⅱ.NaF等氟化物可以做光导纤维材料,一定条件下,某NaF的晶胞结构示意图如下图所示,晶胞的边长为apm 。
。

(5)与 距离最近且相等的
距离最近且相等的 有
有_______ 个。
(6)已知NaF的摩尔质量是Mg/mol,阿伏伽德罗常数为 。该晶体的密度为
。该晶体的密度为_______  。
。
Ⅰ.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如下图。

(1)基态N原子的价层电子轨道表示式为
(2)①N、F、P三种元素的电负性由大到小的顺序为
②根据VSEPR模型,
 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为(3)
 是制备此离子液体的原料。
是制备此离子液体的原料。①微粒中F—B—F键角:

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②
 可以与NaF反应生成
可以与NaF反应生成 的原因是
的原因是(4)以
 和
和 的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为
的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为 向
向Ⅱ.NaF等氟化物可以做光导纤维材料,一定条件下,某NaF的晶胞结构示意图如下图所示,晶胞的边长为apm
 。
。
(5)与
 距离最近且相等的
距离最近且相等的 有
有(6)已知NaF的摩尔质量是Mg/mol,阿伏伽德罗常数为
 。该晶体的密度为
。该晶体的密度为 。
。
您最近一年使用:0次
名校
解题方法
3 . 碳族元素中的碳、硅、锗及其化合物在诸多领域具有重要用途。回答下列问题:
(1)锗元素位于周期表___________ 区,基态硅原子核外电子排布式为___________ ,基态碳原子核外有___________ 种不同运动状态的电子。
(2)草酸(分子式:H2C2O4,结构简式:HOOC-COOH)与NiSO4溶液反应,可制备NiC2O4∙2H2O。
①组成H2C2O4的元素中第一电离能最大的为___________ (填元素符号),该分子中σ键与π键的个数比为___________ 。
② 中的键角为
中的键角为___________ ,该离子的空间构型为___________ 。
(3)金刚石的结构及某碳硅化合物的晶胞结构如图所示,晶胞参数为anm。___________ (NA为阿伏加德罗常数的值,下同)。
②该碳硅化合物的化学式为___________ ,其晶体的密度为___________ g∙cm-3。
(1)锗元素位于周期表
(2)草酸(分子式:H2C2O4,结构简式:HOOC-COOH)与NiSO4溶液反应,可制备NiC2O4∙2H2O。
①组成H2C2O4的元素中第一电离能最大的为
②
 中的键角为
中的键角为(3)金刚石的结构及某碳硅化合物的晶胞结构如图所示,晶胞参数为anm。

②该碳硅化合物的化学式为
您最近一年使用:0次
2023-12-26更新
|
143次组卷
|
3卷引用:黑龙江省绥化市绥棱县第一中学2023-2024学年高二下学期开学化学试题
名校
4 . 随着科学的发展,氟及其化合物的用途日益广泛。
I.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如图。 是制备此离子液体的原料。
是制备此离子液体的原料。
(1)微粒中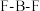 键角:
键角:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2) 可以与
可以与 反应生成
反应生成 的原因是
的原因是___________ 。
Ⅱ.氟化镁钾( )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。 晶体中,每个
晶体中,每个 周围有
周围有___________ 个距离最近的F。
(4) 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
①基态 价电子的轨道表示式为
价电子的轨道表示式为___________ 。
②某实验室合成新型催化剂材料 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为 。若要合成厚度为
。若要合成厚度为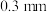 、面积为
、面积为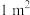 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为___________  (
(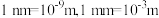 ,阿伏加德罗常数约为
,阿伏加德罗常数约为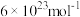 )。
)。
(5)我国科研工作者以 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子 ,
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型 。已知
。已知 与
与 的结构简式如下:
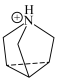
的结构简式如下: 中N原子的杂化方式为
中N原子的杂化方式为___________ , 中心N原子的杂化方式为
中心N原子的杂化方式为___________ 。
② 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与 还存在着
还存在着___________ ,上述相互作用不会随 的转动改变。
的转动改变。
I.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如图。
 是制备此离子液体的原料。
是制备此离子液体的原料。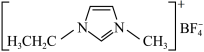
(1)微粒中
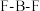 键角:
键角:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)
 可以与
可以与 反应生成
反应生成 的原因是
的原因是Ⅱ.氟化镁钾(
 )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。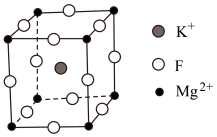
 晶体中,每个
晶体中,每个 周围有
周围有(4)
 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。①基态
 价电子的轨道表示式为
价电子的轨道表示式为②某实验室合成新型催化剂材料
 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为 。若要合成厚度为
。若要合成厚度为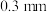 、面积为
、面积为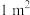 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为 (
(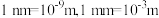 ,阿伏加德罗常数约为
,阿伏加德罗常数约为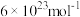 )。
)。(5)我国科研工作者以
 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子 ,
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型 。已知
。已知 与
与 的结构简式如下:
的结构简式如下: :
:
 :
: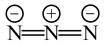
 中N原子的杂化方式为
中N原子的杂化方式为 中心N原子的杂化方式为
中心N原子的杂化方式为②
 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与 还存在着
还存在着 的转动改变。
的转动改变。
您最近一年使用:0次
解题方法
5 . 铜元素的化合价有+1、+2.铜元素常见的+1价化合物有氧化亚铜和氯化亚铜,回答下列问题:
I.氧化亚铜是一种砖红色物质,用途非常广泛。某化工厂以某铜矿(主要含CuS、FeO)为原料制备Cu2O的一种工艺流程如下图:

已知:常温下,相关金属离子生成氢氧化物沉淀的pH见表。
(1)Cu的第二电离能远大于第一电离能的原因是___________ 。
(2)滤渣的主要成分是MnCO3,写出生成它的离子方程式:___________ 。
(3)“调pH”的范围是___________ 。
(4)“还原”前Cu元素以[Cu(NH3)4](OH)2的形式存在,还原过程中氧化剂与还原剂的物质的量之比为___________ 。
Ⅱ.氯化亚铜是一种重要的工业原料和应用广泛的催化剂。
(5)CuCl的晶胞中,C1-的位置如图所示。Cu+填充于Cl-构成的四面体空隙中,则Cu+的配位数为___________ ;若NA为阿伏加德罗常数的值,该晶体的密度为pg·cm-3,则该晶胞中Cu+之间的最短距离为___________ nm(用含p、NA的代数式表示)。
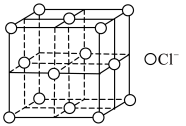
I.氧化亚铜是一种砖红色物质,用途非常广泛。某化工厂以某铜矿(主要含CuS、FeO)为原料制备Cu2O的一种工艺流程如下图:

已知:常温下,相关金属离子生成氢氧化物沉淀的pH见表。
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 4.8 | 1.9 | 7.5 | 8.8 |
| 沉淀完全的pH | 6.4 | 3.2 | 9.7 | 10.4 |
(1)Cu的第二电离能远大于第一电离能的原因是
(2)滤渣的主要成分是MnCO3,写出生成它的离子方程式:
(3)“调pH”的范围是
(4)“还原”前Cu元素以[Cu(NH3)4](OH)2的形式存在,还原过程中氧化剂与还原剂的物质的量之比为
Ⅱ.氯化亚铜是一种重要的工业原料和应用广泛的催化剂。
(5)CuCl的晶胞中,C1-的位置如图所示。Cu+填充于Cl-构成的四面体空隙中,则Cu+的配位数为

您最近一年使用:0次
名校
6 . 砷(As)、镓(Ga)等形成的化合物在现代工业中有广泛的用途,其中砷化镓是一种重要的半导体材料,晶胞结构如图所示,其熔点为1238℃,以下说法正确的是

| A.一个晶胞中As原子的个数为2 | B.砷化镓晶体中每个原子均形成4个共价键 |
| C.As的配位数是2 | D.砷化锌、砷化铝、砷化硼的熔沸点逐渐降低 |
您最近一年使用:0次
2024-02-26更新
|
238次组卷
|
2卷引用:山东省东营市第一中学2023-2024学年高二下学期开学收心考试化学试题
名校
7 . 2022年北京冬季奥运会场馆建设使用了大量不锈钢材质,不锈钢属于铁碳合金,常含铬(Cr)、镍(Ni)等元素。回答下列问题:
(1)某钛酸盐晶体结构模型如图1所示。该晶体的化学式是_______ ,在晶体中1个Co原子周围距离最近的O原子数目为_______ 个。

(2)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图2所示。晶体中每个镁原子周围距离最近的铁原子有_______ 个,该铁镁合金中原子个数比Fe:Mg=_______ ;原子坐标参数可以表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0),C为( ,
, ,0),B点坐标参数为
,0),B点坐标参数为_______ 。

(3)金属铬晶胞如图3,已知其密度为ag•cm-3,阿伏加德罗常数的值为NA,则晶体中铬原子的半径为_______ cm(用含NA的表达式表示)。

(1)某钛酸盐晶体结构模型如图1所示。该晶体的化学式是

(2)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图2所示。晶体中每个镁原子周围距离最近的铁原子有
 ,
, ,0),B点坐标参数为
,0),B点坐标参数为
(3)金属铬晶胞如图3,已知其密度为ag•cm-3,阿伏加德罗常数的值为NA,则晶体中铬原子的半径为

您最近一年使用:0次
名校
解题方法
8 . 氮元素可形成丰富的化合物,在生产生活中具有广泛用途。
(1) 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为_____ ;从轨道重叠方式的角度分析 的成键,
的成键, 分子中氮原子的
分子中氮原子的_____ 轨道与氢原子的 轨道重叠形成
轨道重叠形成 键。
键。
(2) 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
_____ (填“>”或“<”) 。
。
(3) (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
① 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是_____
②比较沸点:
_____ (填“>”或“<”,下同) ,水溶性:
,水溶性:
_____  。
。
(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
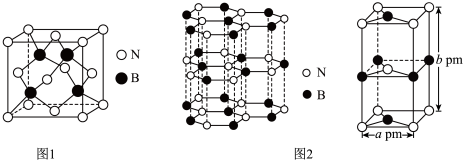
 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为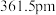 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为_____ (只列计算式) 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
_____ (列含a、b、d的计算式即可)
(1)
 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为 的成键,
的成键, 分子中氮原子的
分子中氮原子的 轨道重叠形成
轨道重叠形成 键。
键。(2)
 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
 。
。(3)
 (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。①
 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是②比较沸点:

 ,水溶性:
,水溶性:
 。
。(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为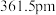 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
您最近一年使用:0次
2024-04-02更新
|
440次组卷
|
3卷引用:青海省海南州贵德高级中学2023-2024学年高三下学期开学理综试题-高中化学
名校
解题方法
9 . 铜、铁及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)某氨基吡啶衍生物铜配合物X的结构简式如下图所示。
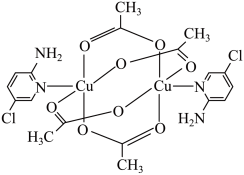
①基态氮原子的价层电子排布图为___________ ,在元素周期表中铜属于___________ (填“s”、“p”、“d”或“ds”)区。
②C.N、O元素原子的第一电离能由大到小的顺序为___________ 。
③X中 的配位数是
的配位数是___________ ,C原子的杂化轨道类型为___________ 。
(2)胆矾的简单平面结构式如图所示。
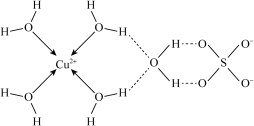
胆矾的化学式用配合物的形式可表示为___________ ;其阴离子的立体构型为___________ 。
(3)铁与硫能形成多种化合物,某种化合物的晶胞结构如下图所示。该化合物的化学式是___________ ;若该晶胞边长为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为___________  。
。

(1)某氨基吡啶衍生物铜配合物X的结构简式如下图所示。

①基态氮原子的价层电子排布图为
②C.N、O元素原子的第一电离能由大到小的顺序为
③X中
 的配位数是
的配位数是(2)胆矾的简单平面结构式如图所示。

胆矾的化学式用配合物的形式可表示为
(3)铁与硫能形成多种化合物,某种化合物的晶胞结构如下图所示。该化合物的化学式是
 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。
。
您最近一年使用:0次
2023-12-19更新
|
246次组卷
|
2卷引用:四川省遂宁市射洪市四川省射洪中学校2023-2024学年高三下学期开学理综试题-高中化学
解题方法
10 . 铋及其化合物在工业生产中用途广泛,如氯氧化铋( )常用作电子设备、塑料助剂等。一种用铋精矿(
)常用作电子设备、塑料助剂等。一种用铋精矿( ,含有
,含有 、
、 、
、 及不溶性杂质)制备
及不溶性杂质)制备 的一种方法,其流程如图:
的一种方法,其流程如图:

已知:
① 开始沉淀(
开始沉淀( )的pH为1.9,沉淀完全(
)的pH为1.9,沉淀完全( )时的pH为3.2
)时的pH为3.2
② 开始沉淀(
开始沉淀( )的pH为7.0,沉淀完全(
)的pH为7.0,沉淀完全( )时的pH为9.0
)时的pH为9.0
③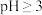 时,
时, 极易水解为
极易水解为 沉淀
沉淀
请回答以下问题:
(1)“加压浸取"过程中, 转化为
转化为 ,
, 转化为
转化为 ,而
,而 溶解进入浸出液且硫元素转化为
溶解进入浸出液且硫元素转化为 ,请写出
,请写出 在此过程中发生反应的离子方程式:
在此过程中发生反应的离子方程式:___________ 。
(2)“操作I”为___________ 、___________ 、过滤、洗涤、干燥。
(3)分析盐酸羟胺(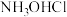 )在流程中的作用:
)在流程中的作用:___________ 。
(4)滤液3中 的浓度为
的浓度为 ,“调pH”步骤中pH的范围为
,“调pH”步骤中pH的范围为___________ 。
(5)写出流程中生成 的离子方程式:
的离子方程式:___________ 。
(6)铋化锂晶胞结构如图所示:

①晶胞可以看作是由Bi原子构成的面心立方晶格,Li原子填充在其中的四面体和八面体空隙处,图中铋原子坐标参数:A为(0,0,0)、B为___________ 。
②若晶胞的参数为apm,阿伏加德罗常数为 ,晶体的密度为
,晶体的密度为_______ 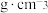 (填计算表达式)。
(填计算表达式)。
 )常用作电子设备、塑料助剂等。一种用铋精矿(
)常用作电子设备、塑料助剂等。一种用铋精矿( ,含有
,含有 、
、 、
、 及不溶性杂质)制备
及不溶性杂质)制备 的一种方法,其流程如图:
的一种方法,其流程如图:
已知:
①
 开始沉淀(
开始沉淀( )的pH为1.9,沉淀完全(
)的pH为1.9,沉淀完全( )时的pH为3.2
)时的pH为3.2②
 开始沉淀(
开始沉淀( )的pH为7.0,沉淀完全(
)的pH为7.0,沉淀完全( )时的pH为9.0
)时的pH为9.0③
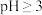 时,
时,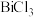 极易水解为
极易水解为 沉淀
沉淀请回答以下问题:
(1)“加压浸取"过程中,
 转化为
转化为 ,
, 转化为
转化为 ,而
,而 溶解进入浸出液且硫元素转化为
溶解进入浸出液且硫元素转化为 ,请写出
,请写出 在此过程中发生反应的离子方程式:
在此过程中发生反应的离子方程式:(2)“操作I”为
(3)分析盐酸羟胺(
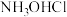 )在流程中的作用:
)在流程中的作用:(4)滤液3中
 的浓度为
的浓度为 ,“调pH”步骤中pH的范围为
,“调pH”步骤中pH的范围为(5)写出流程中生成
 的离子方程式:
的离子方程式:(6)铋化锂晶胞结构如图所示:

①晶胞可以看作是由Bi原子构成的面心立方晶格,Li原子填充在其中的四面体和八面体空隙处,图中铋原子坐标参数:A为(0,0,0)、B为
②若晶胞的参数为apm,阿伏加德罗常数为
 ,晶体的密度为
,晶体的密度为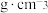 (填计算表达式)。
(填计算表达式)。
您最近一年使用:0次



