名校
1 .  为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.25℃,101kPa下,28L氢气中质子的数目为2.5 |
B.1mol Fe和Cu分别与足量的S反应,转移的电子数均为2 |
C.在 晶体中,每摩Si原子与4 晶体中,每摩Si原子与4 个O原子形成共价键 个O原子形成共价键 |
D.将2mol  与1mol 与1mol  置于密闭容器中充分反应,产物的分子数为2 置于密闭容器中充分反应,产物的分子数为2 |
您最近一年使用:0次
名校
2 . 目前,碳族元素按原子序数增大,依次为:碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)。请回答:
(1)锗原子的最外层电子排布式:________ ,锡原子的最外层电子云有______ 种伸展方向; 单质锗具有__________ (填字母)。
a.只有金属性 b.只有非金属性 c. 既有金属性,又有非金属性
(2)硅可存在二氧化硅和碳化硅两种晶体,请结合原子结构等相关知识判断二者的熔点:前者___________ (大于、小于)后者。你的依据是____________ 。
(3)某同学根据反应:SiO2 + 2C Si + 2CO↑,得出结论:碳的非金属性强于硅的反应。请对此给予评价并说明理由:
Si + 2CO↑,得出结论:碳的非金属性强于硅的反应。请对此给予评价并说明理由:___________________
(4)高温下,在2L容积固定的密闭容器中,用足量焦炭与一定量二氧化碳发生可逆反应C(s)+CO2(g) 2CO(g)-Q,回答以下题
2CO(g)-Q,回答以下题
①反应至10分钟后,混合气体质量增加了9.6g,则用这段时间内用CO表示的反应速率为____ 。
②反应达到平衡 后,下列各种说法一定正确的是______ 。
A.平衡时速率关系:2v(CO2)= v(CO)
B.压缩容器体积达新平衡,气体浓度增大的倍数:CO>CO2
C.升高温度转移电子数增多
D.改变某一条件,若焦炭量随之增多,则气体密度增大
③达到化学平衡之后,保持其他条件不变,移走少量CO,达到新的平衡时,下列选项中,增大的是___________ (填选项编号)。
A.CO2和CO浓度比 B.混合气体的密度 C.CO2转化率 D.CO的体积分数
(1)锗原子的最外层电子排布式:
a.只有金属性 b.只有非金属性 c. 既有金属性,又有非金属性
(2)硅可存在二氧化硅和碳化硅两种晶体,请结合原子结构等相关知识判断二者的熔点:前者
(3)某同学根据反应:SiO2 + 2C
 Si + 2CO↑,得出结论:碳的非金属性强于硅的反应。请对此给予评价并说明理由:
Si + 2CO↑,得出结论:碳的非金属性强于硅的反应。请对此给予评价并说明理由:(4)高温下,在2L容积固定的密闭容器中,用足量焦炭与一定量二氧化碳发生可逆反应C(s)+CO2(g)
 2CO(g)-Q,回答以下题
2CO(g)-Q,回答以下题①反应至10分钟后,混合气体质量增加了9.6g,则用这段时间内用CO表示的反应速率为
②反应
A.平衡时速率关系:2v(CO2)= v(CO)
B.压缩容器体积达新平衡,气体浓度增大的倍数:CO>CO2
C.升高温度转移电子数增多
D.改变某一条件,若焦炭量随之增多,则气体密度增大
③达到化学平衡之后,保持其他条件不变,移走少量CO,达到新的平衡时,下列选项中,增大的是
A.CO2和CO浓度比 B.混合气体的密度 C.CO2转化率 D.CO的体积分数
您最近一年使用:0次
名校
解题方法
3 . 碳化物衍生碳以其独特的性能被广泛应用在超级电容器、催化剂载体等方面。常用氯气刻蚀法制备。该方法通过高温氯化2小时在SiC表面制备碳涂层(已知: 的沸点是59℃,极易水解),其方法如图:
的沸点是59℃,极易水解),其方法如图:

(1)圆底烧瓶A中为氯酸钾固体,仪器a中的试剂是______________________ ,A中发生反应的化学方程式为__________________ 。
(2)仪器C中所盛物质为_______________ 。
(3)高温环境氯气与氩气混合气氛中氯气与SiC反应,将Si原子从SiC中刻蚀掉形成碳层,反应的化学方程式为__________________ ,如果温度超过1175℃,涂层上的碳结构发生如下变化:碳→骨架碳→非晶碳→石墨碳,则碳涂层硬度会______________ (填“逐渐变高”或“逐渐变低”),SiC熔点远高于 的原因是
的原因是__________________ 。
(4)装置F的作用是__________________ ,NaOH溶液中生成的盐除了NaCl外,还有__________________ 。
 的沸点是59℃,极易水解),其方法如图:
的沸点是59℃,极易水解),其方法如图:
(1)圆底烧瓶A中为氯酸钾固体,仪器a中的试剂是
(2)仪器C中所盛物质为
(3)高温环境氯气与氩气混合气氛中氯气与SiC反应,将Si原子从SiC中刻蚀掉形成碳层,反应的化学方程式为
 的原因是
的原因是(4)装置F的作用是
您最近一年使用:0次
2022-11-19更新
|
367次组卷
|
2卷引用:重庆市第八中学2023届高三上学期适应性月考卷(三)化学试题
4 . 化学反应过程中既有物质变化,又有能量变化。释放或吸收热量是化学反应中能量变化的主要形式之一
(1)甲烷具有较大的燃烧热( ),是常见燃料。请写出甲烷燃烧的热化学反应方程式
),是常见燃料。请写出甲烷燃烧的热化学反应方程式_______ 。
(2)①工业上高纯硅可通过下列反应制取: 该反应的反应热
该反应的反应热
_______  。
。
已知:
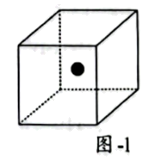
②硅晶体结构与金刚石类似。题图-1所示立方体体心的“●”表示晶体中的一个Si原子,请在立方体的顶点用“●”表示出与之紧邻的所有硅原子。________
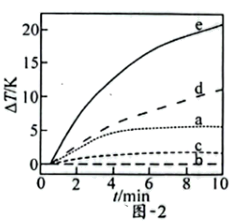
(3)自发热材料在生活中的应用日益广泛。某实验小组为探究“CaO-Al- ”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(
”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值( )随时间(t)的变化曲线,如图-2所示。
)随时间(t)的变化曲线,如图-2所示。
已知:I.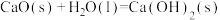
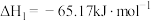
II.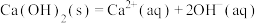
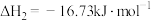
III.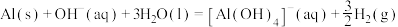
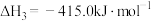
①实验b中, 的变化说明Al粉与
的变化说明Al粉与 在该条件下
在该条件下_______ (填“反应”或“不反应”)。
②实验c中,前3min的 有变化,其原因是
有变化,其原因是_______ ;3min后 基本不变,其原因是
基本不变,其原因是_______ 。
③实验d在10min内温度持续升高的原因是_______ 。
④实验e中发生的总反应可表示为: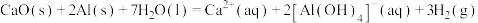 ,其
,其
_______ 。
五组实验对比,e放热效果最好。
(1)甲烷具有较大的燃烧热(
 ),是常见燃料。请写出甲烷燃烧的热化学反应方程式
),是常见燃料。请写出甲烷燃烧的热化学反应方程式(2)①工业上高纯硅可通过下列反应制取:
 该反应的反应热
该反应的反应热
 。
。已知:
| 化学键 | Si-Cl | H-H | H-Cl | Si-Si |
键能/ | 360 | 436 | 431 | 176 |
②硅晶体结构与金刚石类似。题图-1所示立方体体心的“●”表示晶体中的一个Si原子,请在立方体的顶点用“●”表示出与之紧邻的所有硅原子。

(3)自发热材料在生活中的应用日益广泛。某实验小组为探究“CaO-Al-
 ”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(
”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值( )随时间(t)的变化曲线,如图-2所示。
)随时间(t)的变化曲线,如图-2所示。| 实验编号 | 反应物组成 |
| a | 0.20gCaO粉末、5.0mL |
| b | 0.15gAl粉、5.0mL |
| c | 0.15gAl粉、5.0mL饱和石灰水 |
| d | 0.15gAl粉、5.0mL石灰乳 |
| e | 0.15gAl粉、0.20gCaO粉末 5.0mL |

已知:I.
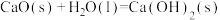
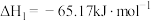
II.
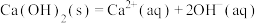
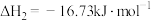
III.
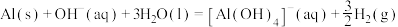
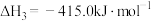
①实验b中,
 的变化说明Al粉与
的变化说明Al粉与 在该条件下
在该条件下②实验c中,前3min的
 有变化,其原因是
有变化,其原因是 基本不变,其原因是
基本不变,其原因是③实验d在10min内温度持续升高的原因是
④实验e中发生的总反应可表示为:
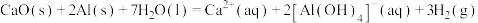 ,其
,其
五组实验对比,e放热效果最好。
您最近一年使用:0次
名校
5 . 有关晶体的结构如图所示,下列说法错误的是
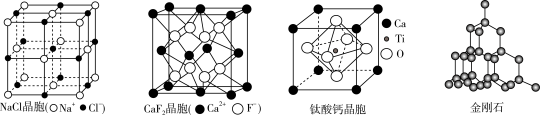

| A.在NaCl晶胞中,距Na+最近的Cl-有6个 |
B.在 晶胞中,每个晶胞平均有4个 晶胞中,每个晶胞平均有4个 |
C.钛酸钙的化学式为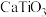 |
D.在金刚石晶体中,碳原子与碳碳键的个数之比为 |
您最近一年使用:0次
2022-11-08更新
|
478次组卷
|
2卷引用:广东省深圳市福田区福田中学2022-2023学年高三上学期第二次月考化学试题
2022高三·全国·专题练习
解题方法
6 . 填空。
(1)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为_______ ,微粒间存在的作用力是_______ ,SiC和晶体Si的熔、沸点高低顺序是_______ 。
(2)氧化物MO的电子总数与SiC的相等,则M为_______ (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是_______ 。
(3)C、Si为同一主族的元素,CO2和SiO2的化学式相似,但结构和性质有很大的不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成π键。从原子半径大小的角度分析,C、O原子间能形成π键,而Si、O原子间不能形成π键的原因是____ 。SiO2属于___ 晶体,CO2属于_____ 晶体,所以熔点:CO2_______ SiO2(填“<”“=”或“>”)。
(4)金刚石、晶体硅、二氧化硅、CO2 4种晶体的构成微粒种类分别是_______ ,熔化时克服的微粒间的作用力分别是_______ 。
(1)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
(2)氧化物MO的电子总数与SiC的相等,则M为
(3)C、Si为同一主族的元素,CO2和SiO2的化学式相似,但结构和性质有很大的不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成π键。从原子半径大小的角度分析,C、O原子间能形成π键,而Si、O原子间不能形成π键的原因是
(4)金刚石、晶体硅、二氧化硅、CO2 4种晶体的构成微粒种类分别是
您最近一年使用:0次
名校
解题方法
7 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A. 与足量水反应,转移电子数为 与足量水反应,转移电子数为 |
B.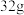 硫在足量的氧气中充分燃烧,转移电子数为 硫在足量的氧气中充分燃烧,转移电子数为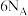 |
C.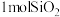 晶体中硅氧键的数目为 晶体中硅氧键的数目为 |
D.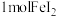 与 与 反应时转移的电子数为 反应时转移的电子数为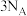 |
您最近一年使用:0次
名校
解题方法
8 . 下列关于物质的结构或性质及解释均正确的是
| 选项 | 物质的结构或性质 | 解释 |
| A | 键角: | 水分子中O上孤电子对数比氨分子中N上的多 |
| B | 稳定性: |  分子间氢键强于 分子间氢键强于 分子间作用力 分子间作用力 |
| C | 熔点:碳化硅>金刚石 |  的键能大于 的键能大于 的键能 的键能 |
| D | 稳定性:CH3CH3>CH2=CH2 | CH2=CH2中存在有不稳定的π键容易断裂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . 设NA代表阿伏加德罗常数的值。下列说法正确的是
| A.101kPa、25℃,11.2LCO中含有的原子数为1NA |
| B.常温常压下,12g金刚石中含有C-C键数为4NA |
| C.1L0.1mol/LCH3COOH溶液中O-H键数小于0.1NA |
| D.熔融状态下1mol NaHSO4中存在NA个阳离子 |
您最近一年使用:0次
22-23高二上·浙江·期末
解题方法
10 . 下列说法正确的是
| A.金刚石晶体中每个碳原子被12个最小碳环共用 |
| B.石墨为混合型晶体,因层间存在分子间作用力,故熔点低于金刚石 |
| C.金属能导热是因为自由电子在热的作用下相互碰撞,从而发生热的传导 |
| D.NaCl晶体中每个Na+周围有6个距离最近且相等的Na+ |
您最近一年使用:0次



