名校
解题方法
1 . 铬(Cr)广泛应用于冶金、化工、航天等领域。工业上以络铁矿(主要成分为FeCr2O4,含有少量Al2O3)为原料制备金属铬的工艺流程如图所示:
(1)FeCr2O4中Fe为+2价,Cr的化合价为______ ,“焙烧”中FeCr2O4反应的化学方程式为__________ 。
(2)“沉铝”中所得滤渣的成分为________ ,需控制pH=6~10的原因为_______________ 。
(3)“酸化”中反应的离子方程式为____________ ;若该反应的平衡常数K=4×1014,已知:“酸化”后溶液中c( )=1.6×10-3mol/L,则溶液中c(
)=1.6×10-3mol/L,则溶液中c( )=
)=_______ mol/L。
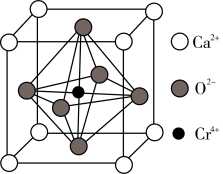
(4)Ca、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+、O2-采用面心立方最密堆积方式(处于面对角线上的钙离子与氧离子紧密相邻)。________ pm。

(1)FeCr2O4中Fe为+2价,Cr的化合价为
(2)“沉铝”中所得滤渣的成分为
(3)“酸化”中反应的离子方程式为
 )=1.6×10-3mol/L,则溶液中c(
)=1.6×10-3mol/L,则溶液中c( )=
)=(4)Ca、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+、O2-采用面心立方最密堆积方式(处于面对角线上的钙离子与氧离子紧密相邻)。
您最近一年使用:0次
2024-04-11更新
|
153次组卷
|
2卷引用:浙江省舟山中学2023-2024学年高二下学期4月月考化学试题
解题方法
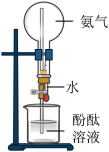
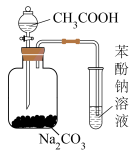
2 . 利用下列装置和试剂进行实验,能达到实验目的的是
|
|
| A.用乙醇萃取碘水中的碘 | B.验证 易溶于水且溶液呈碱性 易溶于水且溶液呈碱性 |
|
|
| C.比较碳酸和苯酚的酸性强弱 | D.中和反应反应热的测定 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 苯甲酸[M(苯甲酸)=122g/mol]是一种常用的食品防腐剂,微溶于水,易溶于乙醇等有机溶剂。苯甲酸在水中的溶解度如下:
某实验小组设计粗苯甲酸(含有少量NaCl和泥沙)的提纯方案如下:___________ 。
(2)操作Ⅱ名称是___________ 。操作Ⅱ目的是:___________ 。操作Ⅲ名称___________ 。
(3)步骤Ⅳ遵循“少量多次”的原则用冷水洗涤晶体,判断是否洗涤干净的实验方案是___________ 。
(4)测定产品的纯度
苯甲酸纯度的测定:称取1.00g苯甲酸产品,溶于烧杯中配成250mL溶液,移取25.00 mL溶液于锥形瓶中,加酚酞作指示剂,在不断摇动下用0.03mol/L NaOH标准溶液滴定至终点。平行测试3次,平均消耗 NaOH标准溶液22.50 mL。
①关于该实验的说法不正确 的是___________ 。
A.锥形瓶用蒸馏水洗净后需再用待测液润洗
B.选用干燥洁净的滴定管不用经待装液润洗即可使用
C.滴定时滴定管尖嘴内有气泡,滴定后无气泡,使得测定结果偏大
D.滴定终点时俯视读数,导致测定结果偏小
E.滴定时溶液由浅红色变无色,且30秒不复原,即可判断达到滴定终点
②计算该产品中苯甲酸的纯度是___________ %。(精确到小数点一位)
| 温度/℃ | 25 | 50 | 75 |
| 溶解度/g | 0.34 | 0.85 | 2.2 |

(2)操作Ⅱ名称是
(3)步骤Ⅳ遵循“少量多次”的原则用冷水洗涤晶体,判断是否洗涤干净的实验方案是
(4)测定产品的纯度
苯甲酸纯度的测定:称取1.00g苯甲酸产品,溶于烧杯中配成250mL溶液,移取25.00 mL溶液于锥形瓶中,加酚酞作指示剂,在不断摇动下用0.03mol/L NaOH标准溶液滴定至终点。平行测试3次,平均消耗 NaOH标准溶液22.50 mL。
①关于该实验的说法
A.锥形瓶用蒸馏水洗净后需再用待测液润洗
B.选用干燥洁净的滴定管不用经待装液润洗即可使用
C.滴定时滴定管尖嘴内有气泡,滴定后无气泡,使得测定结果偏大
D.滴定终点时俯视读数,导致测定结果偏小
E.滴定时溶液由浅红色变无色,且30秒不复原,即可判断达到滴定终点
②计算该产品中苯甲酸的纯度是
您最近一年使用:0次
4 . 粗盐中含有Ca2+、SO 等可溶性杂质和泥沙等不溶性杂质。实验室用下述方案模拟粗盐的精制:
等可溶性杂质和泥沙等不溶性杂质。实验室用下述方案模拟粗盐的精制:
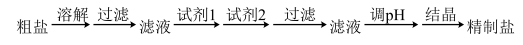
下列说法正确的是
 等可溶性杂质和泥沙等不溶性杂质。实验室用下述方案模拟粗盐的精制:
等可溶性杂质和泥沙等不溶性杂质。实验室用下述方案模拟粗盐的精制: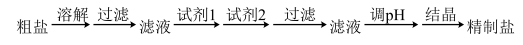
下列说法正确的是
| A.过滤操作中必须用到的玻璃仪器有烧杯、玻璃棒和分液漏斗 |
| B.试剂1可选用Na2CO3溶液,试剂2可选用BaCl2溶液 |
| C.调pH时,可选用盐酸或者硫酸 |
| D.结晶时,当蒸发皿中出现较多固体时停止加热,利用蒸发皿的余热使滤液蒸干 |
您最近一年使用:0次
解题方法
5 . 过氧化钙( )微溶于水,碱性条件下较稳定,可作为医用防腐剂和消毒剂,也可作为改良剂为农业、园艺和生物技术应用提供氧气。以下是一种实验室制备较高纯度过氧化钙的流程图:
)微溶于水,碱性条件下较稳定,可作为医用防腐剂和消毒剂,也可作为改良剂为农业、园艺和生物技术应用提供氧气。以下是一种实验室制备较高纯度过氧化钙的流程图: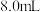 盐酸,所用的仪器是___________。
盐酸,所用的仪器是___________。
(2)下列说法正确的是___________。
(3)写出步骤Ⅲ发生反应的化学方程式___________ ,步骤Ⅲ采用冰水浴可提高产率,其原因有(回答两点)___________ 。
(4)准确称取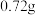 产品配成
产品配成 溶液。取
溶液。取 溶液,加入
溶液,加入 醋酸溶液和2-3滴
醋酸溶液和2-3滴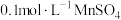 溶液,用
溶液,用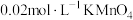 标准溶液滴定至浅红色,半分钟不褪色;平行测定3次,消耗
标准溶液滴定至浅红色,半分钟不褪色;平行测定3次,消耗 标准溶液的平均值为
标准溶液的平均值为 。
。
① 溶液的作用是
溶液的作用是___________ 。
② 的纯度为
的纯度为___________ 。
 )微溶于水,碱性条件下较稳定,可作为医用防腐剂和消毒剂,也可作为改良剂为农业、园艺和生物技术应用提供氧气。以下是一种实验室制备较高纯度过氧化钙的流程图:
)微溶于水,碱性条件下较稳定,可作为医用防腐剂和消毒剂,也可作为改良剂为农业、园艺和生物技术应用提供氧气。以下是一种实验室制备较高纯度过氧化钙的流程图:
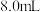 盐酸,所用的仪器是___________。
盐酸,所用的仪器是___________。A. 量筒 量筒 | B. 量筒 量筒 |
C. 碱式滴定管 碱式滴定管 | D. 烧杯 烧杯 |
(2)下列说法正确的是___________。
| A.步骤I中应使用过量的盐酸,以提高碳酸钙的利用率 |
| B.步骤Ⅱ中的煮沸操作的主要目的是加快反应速率 |
| C.步骤Ⅲ中的混合操作,应将氯化钙溶液滴入氨水-双氧水混合液中 |
| D.步骤V中可用冰水洗涤 |
(3)写出步骤Ⅲ发生反应的化学方程式
(4)准确称取
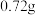 产品配成
产品配成 溶液。取
溶液。取 溶液,加入
溶液,加入 醋酸溶液和2-3滴
醋酸溶液和2-3滴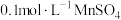 溶液,用
溶液,用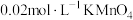 标准溶液滴定至浅红色,半分钟不褪色;平行测定3次,消耗
标准溶液滴定至浅红色,半分钟不褪色;平行测定3次,消耗 标准溶液的平均值为
标准溶液的平均值为 。
。①
 溶液的作用是
溶液的作用是②
 的纯度为
的纯度为
您最近一年使用:0次
解题方法
6 . 硫代尿素 是重要的工业原料.某小组按如图流程开展制备实验(部分装置及夹持仪器已省略)。主要反应:
是重要的工业原料.某小组按如图流程开展制备实验(部分装置及夹持仪器已省略)。主要反应:
步骤Ⅱ: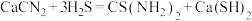
步骤Ⅲ: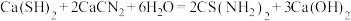
已知:硫代尿素 可溶于水、乙醇,微溶于乙醚
可溶于水、乙醇,微溶于乙醚_________ (填仪器名称)。
(2)下列说法不正确的是_________。
(3)步骤Ⅰ、Ⅱ、Ⅲ的部分操作如下,其正确的顺序是:________ 。
(_________)→(_________)→a→(_________)→e→f→(_________)
c.调节装置B温控磁力搅拌器,并控制温度为
d.调节装置B温控磁力搅拌器,并迅速控温在
g.检测气体纯净后连接三通阀
(4)步骤Ⅳ的主要 操作是(请补上第一步):_________ →洗涤、合并滤液→冷冻结晶。
上述步骤中的最适宜洗涤剂是_________ 。
A.冷水 B.热水 C.乙醚 D.滤液
(5)产品含量的测定:
滴定反应: ;
;
主要步骤:
Ⅰ.称取 产品用蒸馏水溶解并定容至
产品用蒸馏水溶解并定容至 。移取该溶液
。移取该溶液 注入碘量瓶中,加
注入碘量瓶中,加 碘标准液,
碘标准液, 氢氧化钠溶液,于暗处放置
氢氧化钠溶液,于暗处放置 。加适量水及盐酸摇匀,用
。加适量水及盐酸摇匀,用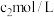 硫代硫酸钠标准溶液滴定,
硫代硫酸钠标准溶液滴定,近终点时,加 3mL淀粉指示液 ,继续滴定至终点,消耗体积 。
。
Ⅱ.空白实验:将上述样品溶液改为蒸馏水 注入碘量瓶中,重复后续步骤,滴定至终点时消耗体积
注入碘量瓶中,重复后续步骤,滴定至终点时消耗体积 。
。
①需要加入淀粉指示液时,锥形瓶中溶液的现象是_________ 。
②产品的质量分数为_________ 。
 是重要的工业原料.某小组按如图流程开展制备实验(部分装置及夹持仪器已省略)。主要反应:
是重要的工业原料.某小组按如图流程开展制备实验(部分装置及夹持仪器已省略)。主要反应:步骤Ⅱ:
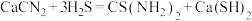
步骤Ⅲ:
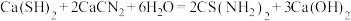
已知:硫代尿素
 可溶于水、乙醇,微溶于乙醚
可溶于水、乙醇,微溶于乙醚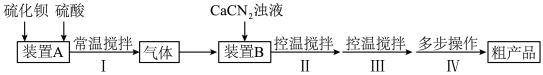
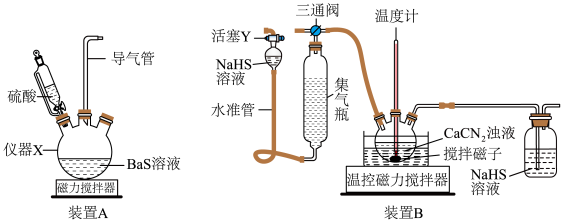
(2)下列说法不正确的是_________。
A.配制5%的 溶液必须用到的玻璃仪器有烧杯、玻璃棒、容量瓶等 溶液必须用到的玻璃仪器有烧杯、玻璃棒、容量瓶等 |
| B.装置A使用恒压分液漏斗添加硫酸溶液时,可以打开漏斗上部的玻璃塞 |
C.在反应前若向装置B中通入一段时间 ,能提高产品的产率 ,能提高产品的产率 |
| D.步骤Ⅱ反应完全的现象是溶液变澄清,集气瓶液面不再改变 |
(3)步骤Ⅰ、Ⅱ、Ⅲ的部分操作如下,其正确的顺序是:
(_________)→(_________)→a→(_________)→e→f→(_________)
a.调节三通阀如图 ,收集气体一段时间
,收集气体一段时间
c.调节装置B温控磁力搅拌器,并控制温度为

d.调节装置B温控磁力搅拌器,并迅速控温在

e.调节三通阀如图
g.检测气体纯净后连接三通阀
(4)步骤Ⅳ的
上述步骤中的最适宜洗涤剂是
A.冷水 B.热水 C.乙醚 D.滤液
(5)产品含量的测定:
滴定反应:
 ;
;
主要步骤:
Ⅰ.称取
 产品用蒸馏水溶解并定容至
产品用蒸馏水溶解并定容至 。移取该溶液
。移取该溶液 注入碘量瓶中,加
注入碘量瓶中,加 碘标准液,
碘标准液, 氢氧化钠溶液,于暗处放置
氢氧化钠溶液,于暗处放置 。加适量水及盐酸摇匀,用
。加适量水及盐酸摇匀,用 硫代硫酸钠标准溶液滴定,
硫代硫酸钠标准溶液滴定, 。
。Ⅱ.空白实验:将上述样品溶液改为蒸馏水
 注入碘量瓶中,重复后续步骤,滴定至终点时消耗体积
注入碘量瓶中,重复后续步骤,滴定至终点时消耗体积 。
。①需要加入淀粉指示液时,锥形瓶中溶液的现象是
②产品的质量分数为
您最近一年使用:0次
2024-04-01更新
|
395次组卷
|
4卷引用:2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题
2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题浙江省温州市普通高中2024届高三下学期第二次适应性考试(二模)化学试题(已下线)化学(浙江卷02)-2024年高考押题预测卷(已下线)压轴题12 化学实验综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
名校
7 . 某学习小组欲从含有 、乙醇和氨水的实验室废液中分离乙醇并制备硫酸铜铵
、乙醇和氨水的实验室废液中分离乙醇并制备硫酸铜铵 晶体,设计方案如下,下列说法
晶体,设计方案如下,下列说法不正确 的是
 、乙醇和氨水的实验室废液中分离乙醇并制备硫酸铜铵
、乙醇和氨水的实验室废液中分离乙醇并制备硫酸铜铵 晶体,设计方案如下,下列说法
晶体,设计方案如下,下列说法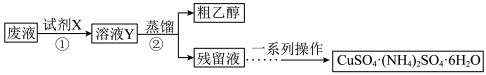
A.试剂X是硫酸,其中发生的反应之一: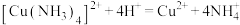 |
| B.步骤②蒸馏实验可用水浴加热 |
| C.若得到的粗乙醇中乙醇的含量明显偏低,可能是蒸馏时加热温度偏低 |
D.将残留液加热浓缩、冷却结晶可得到硫酸铜铵 晶体 晶体 |
您最近一年使用:0次
2024-04-01更新
|
449次组卷
|
6卷引用:2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题
2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题浙江省温州市普通高中2024届高三下学期第二次适应性考试(二模)化学试题(已下线)化学(浙江卷01)-2024年高考押题预测卷(已下线)压轴题03 物质的制备检验分离与提纯(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)(已下线)选择题6-10湖北省沙市中学2024届高三下学期模拟预测化学试题
8 . 下列实验操作和现象及实验结论均正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 将石蜡油蒸汽通过炽热的碎瓷片,再将产生的气体通入酸性高锰酸钾溶液中,溶液褪色 | 石蜡油裂解一定生成了乙烯 |
| B | 甲苯与酸性高锰酸钾溶液混合振荡,水层紫红色褪去 | 苯环对甲基产生了影响 |
| C | 甲烷与氯气在光照下反应后的混合气体能使湿润的蓝色石蕊试纸变红 | 生成的一氯甲烷具有酸性 |
| D | 用裂化汽油萃取溴水中的溴,下层为无色 | 裂化汽油密度比水小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-30更新
|
502次组卷
|
2卷引用:浙江省宁波市镇海中2023-2024学年高二下学期期中考试化学试题
解题方法
9 . 某合金粉末中含有铜、银、铬(Cr),为了从中回收贵金属银和一种盐晶体,某化学兴趣小组的同学们将这三种金属随意编号为A、B、C,设计了如下实验流程:

(1)A、B、C三种金属的活动性顺序由大到小为___________ (用化学式作答)。
(2)操作a中除烧杯、玻璃棒外还需用到的玻璃仪器是___________ ,操作b的名称是___________ 。
(3)已知A的硫酸盐中A元素是 价,请写出步骤①的化学反应方程式:
价,请写出步骤①的化学反应方程式:___________ 。
(4)已知D易溶于水,溶液D中的溶质是___________ (写化学式),写出步骤②的化学反应方程式:___________ 。
(5)溶液D的质量___________ (选填“大于”“小于”或“等于”)滤液E的质量。

(1)A、B、C三种金属的活动性顺序由大到小为
(2)操作a中除烧杯、玻璃棒外还需用到的玻璃仪器是
(3)已知A的硫酸盐中A元素是
 价,请写出步骤①的化学反应方程式:
价,请写出步骤①的化学反应方程式:(4)已知D易溶于水,溶液D中的溶质是
(5)溶液D的质量
您最近一年使用:0次
名校
解题方法
10 . 从含KI、KNO3等成分的废水中回收I2和KNO3流程如图,下列说法不正确 的是

| A.步骤1中有机相应从分液漏斗的下口放出,无机相从上口倒出 |
| B.步骤2分离操作可选用蒸馏 |
| C.步骤3可利用碘易升华的性质提纯粗碘 |
| D.步骤4将溶液蒸发至大量晶体析出时,再用余热蒸干 |
您最近一年使用:0次
2024-03-28更新
|
437次组卷
|
2卷引用:浙江省海宁市高级中学2023-2024学年高二下学期3月月考化学试题