解题方法
1 . 某合金粉末中含有铜、银、铬(Cr),为了从中回收贵金属银和一种盐晶体,某化学兴趣小组的同学们将这三种金属随意编号为A、B、C,设计了如下实验流程:

(1)A、B、C三种金属的活动性顺序由大到小为___________ (用化学式作答)。
(2)操作a中除烧杯、玻璃棒外还需用到的玻璃仪器是___________ ,操作b的名称是___________ 。
(3)已知A的硫酸盐中A元素是 价,请写出步骤①的化学反应方程式:
价,请写出步骤①的化学反应方程式:___________ 。
(4)已知D易溶于水,溶液D中的溶质是___________ (写化学式),写出步骤②的化学反应方程式:___________ 。
(5)溶液D的质量___________ (选填“大于”“小于”或“等于”)滤液E的质量。

(1)A、B、C三种金属的活动性顺序由大到小为
(2)操作a中除烧杯、玻璃棒外还需用到的玻璃仪器是
(3)已知A的硫酸盐中A元素是
 价,请写出步骤①的化学反应方程式:
价,请写出步骤①的化学反应方程式:(4)已知D易溶于水,溶液D中的溶质是
(5)溶液D的质量
您最近一年使用:0次
名校
解题方法
2 . 从含KI、KNO3等成分的废水中回收I2和KNO3流程如图,下列说法不正确 的是

| A.步骤1中有机相应从分液漏斗的下口放出,无机相从上口倒出 |
| B.步骤2分离操作可选用蒸馏 |
| C.步骤3可利用碘易升华的性质提纯粗碘 |
| D.步骤4将溶液蒸发至大量晶体析出时,再用余热蒸干 |
您最近一年使用:0次
2024-03-28更新
|
437次组卷
|
2卷引用:浙江省海宁市高级中学2023-2024学年高二下学期3月月考化学试题
3 . 一包不纯的氯化钾粉末,所含杂质可能是氯化钠、硝酸钾、硝酸钙、氯化铜、碳酸钠中的一种或几种。为确定其成分,某兴趣小组的同学们进行如下实验:
(1)取少量该粉末于烧杯中,加蒸馏水,充分搅拌,得无色澄清溶液。
(2)取上述无色溶液少许于试管中,滴加氯化钡溶液有白色沉淀生成。
(3)另称取14.9g该粉末于烧杯中,加入蒸馏水溶解,再加入足量的硝酸银溶液和稀硝酸,充分反应后生成28.7g白色沉淀。
根据上述实验判断,下列说法正确的是
(1)取少量该粉末于烧杯中,加蒸馏水,充分搅拌,得无色澄清溶液。
(2)取上述无色溶液少许于试管中,滴加氯化钡溶液有白色沉淀生成。
(3)另称取14.9g该粉末于烧杯中,加入蒸馏水溶解,再加入足量的硝酸银溶液和稀硝酸,充分反应后生成28.7g白色沉淀。
根据上述实验判断,下列说法正确的是
| A.杂质中可能含有硝酸钾、氯化钠 |
| B.杂质中肯定不含硝酸钙、氯化铜、碳酸钠 |
| C.杂质中肯定含有碳酸钠,可能含有氯化钠 |
| D.杂质中肯定含有氯化钠、碳酸钠,可能含有硝酸钾 |
您最近一年使用:0次
4 . 从海水中制备纯碱和金属镁的流程如下图所示:
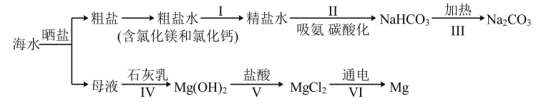
下列说法错误的是

下列说法错误的是
A.流程I中依次向粗盐水中加入过量 溶液、 溶液、 溶液和适量稀盐酸去除杂质 溶液和适量稀盐酸去除杂质 |
| B.流程Ⅱ先吸氨是使溶液呈碱性,有利于吸收二氧化碳 |
| C.上述流程涉及到三种基本反应类型 |
| D.流程Ⅳ、Ⅴ是通过化学方法富集氯化镁 |
您最近一年使用:0次
5 . 下列过程涉及化学变化的是
| A.冰雪融化 | B.碘的升华 | C.海水蒸发 | D.葡萄酿酒 |
您最近一年使用:0次
名校
6 . 苯酚是一种重要的化工原料,其废水对生物具有毒害作用,在排放前必须经过处理。为回收利用含苯酚的废水,某小组设计如下方案,有关说法正确的是

| A.步骤①中,分液时从分液漏斗下口先放出废水,再放出有机溶液 |
B.试剂①可用 溶液或 溶液或 溶液 溶液 |
| C.步骤①②的操作为分液,步骤③的操作为过滤 |
D.试剂②若为少量 ,则反应为2 ,则反应为2 +CO2+H2O=2 +CO2+H2O=2 + +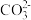 |
您最近一年使用:0次
2024-03-22更新
|
1073次组卷
|
4卷引用:浙江省金丽衢十二校2023-2024学年高三下学期第二次联考 化学试题
浙江省金丽衢十二校2023-2024学年高三下学期第二次联考 化学试题(已下线)压轴题03 物质的制备检验分离与提纯(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)(已下线)通关练03 常考化学实验基础知识-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)广东省新南方联盟2024届高三下学期4月联考化学试题
名校
解题方法
7 . 砷的化合物可用于半导体领域,如我国“天宫”空间站的核心舱“天和号”就是采用砷化镓薄膜电池来供电。一种从酸性高浓度含砷废水[砷主要以亚砷酸( )形式存在]中回收砷的工艺流程如下:
)形式存在]中回收砷的工艺流程如下:
Ⅱ.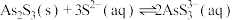
Ⅲ.砷酸( )在酸性条件下有强氧化性
)在酸性条件下有强氧化性
Ⅳ.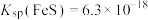 ,
,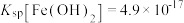
请回答:
(1)从含砷废水到滤液Ⅰ,浓度明显减小的阳离子为__________ (用离子符号表示)。
(2)下列说法正确的是__________。
(3)“沉砷”过程中 是否可用过量的
是否可用过量的 替换
替换__________ (填“是”或“否”);请从平衡移动的角度解释原因__________ 。
(4)砷酸“还原”过程中发生的化学方程式为__________ 。还原后溶液需检验是否仍剩余砷酸,设计检验实验方案__________ 。
 )形式存在]中回收砷的工艺流程如下:
)形式存在]中回收砷的工艺流程如下:

Ⅱ.
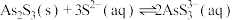
Ⅲ.砷酸(
 )在酸性条件下有强氧化性
)在酸性条件下有强氧化性Ⅳ.
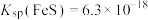 ,
,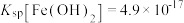
请回答:
(1)从含砷废水到滤液Ⅰ,浓度明显减小的阳离子为
(2)下列说法正确的是__________。
A.沉砷时产生的废气可用 溶液吸收处理 溶液吸收处理 |
B.酸化的目的是增加 价砷的氧化性 价砷的氧化性 |
C. 浸取后所得滤渣的主要成分是 浸取后所得滤渣的主要成分是 ,不含 ,不含 |
D.酸性: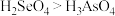 |
(3)“沉砷”过程中
 是否可用过量的
是否可用过量的 替换
替换(4)砷酸“还原”过程中发生的化学方程式为
您最近一年使用:0次
8 . 某实验小组为制备1-氯-2-甲基丙烷(沸点69℃),将2-甲基-1-丙醇和 溶于
溶于 中,加热回流(伴有
中,加热回流(伴有 气体产生)。反应完全后倒入冰水中分解残余的
气体产生)。反应完全后倒入冰水中分解残余的 ,分液收集
,分液收集 层,再用无水
层,再用无水 干燥,过滤、蒸馏后得到目标产物。上述过程中涉及的部分装置(夹持及加热装置略)如下图,下列说法
干燥,过滤、蒸馏后得到目标产物。上述过程中涉及的部分装置(夹持及加热装置略)如下图,下列说法不正确 的是
 溶于
溶于 中,加热回流(伴有
中,加热回流(伴有 气体产生)。反应完全后倒入冰水中分解残余的
气体产生)。反应完全后倒入冰水中分解残余的 ,分液收集
,分液收集 层,再用无水
层,再用无水 干燥,过滤、蒸馏后得到目标产物。上述过程中涉及的部分装置(夹持及加热装置略)如下图,下列说法
干燥,过滤、蒸馏后得到目标产物。上述过程中涉及的部分装置(夹持及加热装置略)如下图,下列说法
| A.装置①在加热回流时,需加入沸石或碎瓷片 |
B.装置②与装置①的冷凝管上端相连,因 气体极易溶于水,需将尾气处理装置设计成防倒吸 气体极易溶于水,需将尾气处理装置设计成防倒吸 |
| C.装置③在分液前无法区分水层与有机层时,可向分液漏斗中滴水,若上层无水滴通过轨迹,则上层为水层 |
D. 沸点为39.8℃,为增强冷凝效果,可使用装置④的蒸馏装置,对圆底烧瓶进行控制温度的温水浴加热 沸点为39.8℃,为增强冷凝效果,可使用装置④的蒸馏装置,对圆底烧瓶进行控制温度的温水浴加热 |
您最近一年使用:0次
2024-03-21更新
|
399次组卷
|
2卷引用:浙江省宁波市十校2024届高三二模联考化学试题
名校
解题方法
9 . 为除去括号内少量的杂质,所用的试剂或方法正确的是
| A.Fe粉(Cu粉):盐酸,过滤 |
B. :氧气,点燃 :氧气,点燃 |
C.除去KCl溶液中的少量 :加入适量NaOH溶液,过滤 :加入适量NaOH溶液,过滤 |
D. :饱和碳酸氢钠溶液,洗气 :饱和碳酸氢钠溶液,洗气 |
您最近一年使用:0次
2024-03-20更新
|
367次组卷
|
3卷引用:浙江省杭州市长河高级中学2023-2024学年高一上学期期末考试化学试题
浙江省杭州市长河高级中学2023-2024学年高一上学期期末考试化学试题浙江省宁波市九校2023-2024学年高一上学期1月期末化学试题(已下线)专题01 硫及其化合物(考点清单)(讲+练)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)
2024高三下·全国·专题练习
10 . Cu元素在生命活动中占有举足轻重的地位,缺铜会造成贫血、记忆力减退、反应迟钝、运动失常等。设计如下实验制备有机补铜剂顺式甘氨酸合铜水合物并测定其组成。
查阅资料:
①制备反应为:
②该反应同时生成顺式产物(天蓝色针状)和反式产物(蓝紫色鳞片状),其反应进程如图所示:

制备有机补铜剂顺式甘氨酸合铜水合物实验过程为:


回答下列问题:
(1)步骤Ⅱ中控制反应温度为70℃的原因是___________ ,可采用的加热方式为___________ 。
(2)下列有关说法正确的是___________。
(3)用间接碘量法测定产物中Cu(Ⅱ)的质量分数。
已知:2Cu2++4I-=I2+2CuI↓ I2+2S2O =S4O
=S4O +2I-
+2I-
请选择以下正确的操作排序:
取2.0g所制备的产品,用稀硫酸溶解配成100mL溶液→a→___________ ,重复操作3次,消耗Na2S2O3标准液平均值为amL。
a.取25mL该溶液转移入锥形瓶
b.立即用酸式滴定管中0.01 molL-1Na2S2O3标准液快速进行滴定
c.立即用碱式滴定管中0.01 mol L-1Na2S2O3标准液快速进行滴定
d.当溶液变为浅黄色时,加入1mL淀粉溶液
e.加入蒸馏水和过量的KI溶液,得到棕黄色溶液
f.继续滴定至溶液蓝色恰好褪去
g.继续滴定至溶液由无色变为蓝色
根据实验数据,所得晶体中Cu(Ⅱ)质量分数为___________ ,若要提高产品的纯度,所用的实验方法名称是___________ 。
查阅资料:
①制备反应为:

②该反应同时生成顺式产物(天蓝色针状)和反式产物(蓝紫色鳞片状),其反应进程如图所示:

制备有机补铜剂顺式甘氨酸合铜水合物实验过程为:


回答下列问题:
(1)步骤Ⅱ中控制反应温度为70℃的原因是
(2)下列有关说法正确的是___________。
| A.CuSO4和NaOH快速生成的Cu(OH)2絮状沉淀易裹挟杂质,故不采用CuSO4和NaOH直接反应制备Cu(OH)2 |
| B.步骤Ⅲ中趁热过滤是为了防止杂质析出 |
| C.步骤Ⅳ加入95%的乙醇可以得到纯度更高的产品,说明顺式甘氨酸的极性大于反式甘氨酸 |
| D.步骤Ⅴ用25%酒精和丙酮分别洗涤晶体的目的是:25%酒精用于除去可溶性杂质(剩余反应物),丙酮用于除去晶体中残余的水 |
(3)用间接碘量法测定产物中Cu(Ⅱ)的质量分数。
已知:2Cu2++4I-=I2+2CuI↓ I2+2S2O
 =S4O
=S4O +2I-
+2I-请选择以下正确的操作排序:
取2.0g所制备的产品,用稀硫酸溶解配成100mL溶液→a→
a.取25mL该溶液转移入锥形瓶
b.立即用酸式滴定管中0.01 molL-1Na2S2O3标准液快速进行滴定
c.立即用碱式滴定管中0.01 mol L-1Na2S2O3标准液快速进行滴定
d.当溶液变为浅黄色时,加入1mL淀粉溶液
e.加入蒸馏水和过量的KI溶液,得到棕黄色溶液
f.继续滴定至溶液蓝色恰好褪去
g.继续滴定至溶液由无色变为蓝色
根据实验数据,所得晶体中Cu(Ⅱ)质量分数为
您最近一年使用:0次



