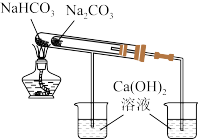
1 . 某校化学兴趣小组为研究氯气的性质,设计用如图所示的装置进行实验,其中a为干燥的红色试纸,b为湿润的红色试纸。

回答下列问题:
(1)装置I中仪器c的名称是______ ,实验室用二氧化锰和浓盐酸制备氯气的化学方程式为_______ 。
(2)装置V的作用是_______ 。
(3)若产生的 足量,实验过程中装置IV中的实验现象是
足量,实验过程中装置IV中的实验现象是________ 。
(4)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“装置II中a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在装置I与II之间添加下图中的装置________ (填序号)。

(5)有一种“地康法”制取氯气的反应原理如图所示:

在450℃条件下,反应II的化学方程式为_________ 。

回答下列问题:
(1)装置I中仪器c的名称是
(2)装置V的作用是
(3)若产生的
 足量,实验过程中装置IV中的实验现象是
足量,实验过程中装置IV中的实验现象是(4)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“装置II中a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在装置I与II之间添加下图中的装置

(5)有一种“地康法”制取氯气的反应原理如图所示:

在450℃条件下,反应II的化学方程式为
您最近一年使用:0次
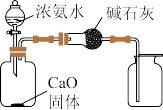
2 . 甲同学通过查询资料知道,一定浓度的硝酸与镁反应时,可得到二氧化氮、一氧化氮、氮气三种气体。该同学用下列仪器组装装置来直接验证有二氧化氮、一氧化氮生成并制取氮化镁 (假设实验中每步转化均是完全的) 。查阅文献得知:
①二氧化氮沸点为21.1 ℃、熔点为-11 ℃,一氧化氮沸点为-151 ℃、熔点为-164 ℃;
②镁也能与二氧化碳反应;
③氮化镁遇水反应生成氢氧化镁和氨气。
(1)实验中先打开开关K,通过导管向装置内通入二氧化碳气体以排出装置内的空气,停止通入二氧化碳的标志是________________________________ 。
(2)为实现上述实验目的,所选用的仪器的正确连接方式是A→____________ →E,确定还原产物中有二氧化氮的现象是______________________________________ ,实验中要多次使用装置F,第二次使用F的目的是______________________________________________ 。
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:________________________________ 。
(4)甲同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是______________________________________ 。
(5)设计一种实验方案,验证镁与硝酸反应时确实有氮气生成:__________________________ 。
①二氧化氮沸点为21.1 ℃、熔点为-11 ℃,一氧化氮沸点为-151 ℃、熔点为-164 ℃;
②镁也能与二氧化碳反应;
③氮化镁遇水反应生成氢氧化镁和氨气。

(1)实验中先打开开关K,通过导管向装置内通入二氧化碳气体以排出装置内的空气,停止通入二氧化碳的标志是
(2)为实现上述实验目的,所选用的仪器的正确连接方式是A→
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:
(4)甲同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是
(5)设计一种实验方案,验证镁与硝酸反应时确实有氮气生成:
您最近一年使用:0次
2016-12-09更新
|
1387次组卷
|
10卷引用:贵州省剑河县二中2018-2019学年高一上学期期末考试化学试题
贵州省剑河县二中2018-2019学年高一上学期期末考试化学试题2016届湖北省沙市中学高三下第一次半月考理综化学试卷2015-2016学年江苏省扬州中学高一下期中化学试卷(已下线)同步君 必修1 第4章 第4节 硝酸高中化学人教版 必修1 第四章 非金属及其化合物 4.氨 硫酸 硝酸 硝酸云南省元江县一中2018-2019学年高一上学期12月考试化学试题内蒙古集宁一中2019-2020学年高二下学期第二次月考化学试题山西省忻州市静乐县第一中学2019-2020学年高二下学期第一次月考化学试题云南省玉溪市通海二中2020-2021学年高一下学期期中考试化学试题辽宁省沈阳市第一二〇中学2021-2022学年高一下学期线上教学质量检测期中考试化学试题
解题方法
3 . 氯化亚铜(CuCl) 为白色粉末,其露置于空气中易被氧化为绿色的碱式氯化铜Cu2(OH)3Cl]。某兴趣小组高温加热分解氯化铜晶体(CuCl2·xH 2O)制备CuCl,其装置如下(加热仪器、夹持仪器省略)

回答下列问题:
(1)装有无水硫酸铜的仪器名称为______ ,装置 D 的作用是______ 。
(2)通入 HCl 气体的主要作用是______ 。
(3)实验过程中,装置C 中的现象为______ 。
(4)硬质玻璃管A 中发生主要反应的化学方程式为__________ 。
(5)为测定 CuCl2·xH 2O 中结晶水的数目 x,实验步骤如下:
a 用电子天平称取一定质量的氯化铜晶体;
b 在坩埚中充分灼烧;
c 在干燥器中冷却;
d 称量所得黑色固体质量;
e 重复 b~d 操作直至连续两次称量差值不超过 0.001g。
①若氯化铜晶体质量为 3.384g,最终得到黑色固体质量为 1.600g,则 x=______ (精确到 0.1)。
②若加热时有固体溅出坩埚,则测得x 值______ 填“偏大”“不变”或“偏小”)。

回答下列问题:
(1)装有无水硫酸铜的仪器名称为
(2)通入 HCl 气体的主要作用是
(3)实验过程中,装置C 中的现象为
(4)硬质玻璃管A 中发生主要反应的化学方程式为
(5)为测定 CuCl2·xH 2O 中结晶水的数目 x,实验步骤如下:
a 用电子天平称取一定质量的氯化铜晶体;
b 在坩埚中充分灼烧;
c 在干燥器中冷却;
d 称量所得黑色固体质量;
e 重复 b~d 操作直至连续两次称量差值不超过 0.001g。
①若氯化铜晶体质量为 3.384g,最终得到黑色固体质量为 1.600g,则 x=
②若加热时有固体溅出坩埚,则测得x 值
您最近一年使用:0次
2020-05-25更新
|
132次组卷
|
3卷引用:贵州省黔西南州兴义市义龙新区2021-2022高三上学期期末考试化学试题
4 . 实验是学习化学的重要途径。下列装置或操作能达到实验目的的是
A | B | C | D |
|
|
|
|
比较 和 和 的热稳定性 的热稳定性 | 验证浓硫酸的脱水性、强氧化性 的漂白性、还原性 的漂白性、还原性 | 制取并收集干燥纯净的 | 用氢氧化钠标准液测定盐酸的浓度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-29更新
|
138次组卷
|
2卷引用:贵州省黔东南苗族侗族自治州)2021-2022学年高二下学期期末联考化学试题
解题方法
5 . 某化学兴趣小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(部分装置已略去)。图中K为止水夹,M是半空的注射器。请回答有关问题:

(1)装置A的目的是利用生成的 将整个装内的空气排尽。避免空气的干扰,装置A中所发生反应的离子方程式为
将整个装内的空气排尽。避免空气的干扰,装置A中所发生反应的离子方程式为_______ ;当装置内空气已经排尽时。可观察到的现象是_______ 。
(2)B装置中稀硝酸发生反应主要表现出的化学性质有_______ 。
(3)为实现装置C的作用,应采用的操作和观察到的现象为_______ 。
(4)将28.8g铜与140mL一定浓度的硝酸反应,铜完全溶解。产生的NO和 混合气体在标准状况下的体积为11.2L,其中NO的体积为
混合气体在标准状况下的体积为11.2L,其中NO的体积为_______ L。

(1)装置A的目的是利用生成的
 将整个装内的空气排尽。避免空气的干扰,装置A中所发生反应的离子方程式为
将整个装内的空气排尽。避免空气的干扰,装置A中所发生反应的离子方程式为(2)B装置中稀硝酸发生反应主要表现出的化学性质有
(3)为实现装置C的作用,应采用的操作和观察到的现象为
(4)将28.8g铜与140mL一定浓度的硝酸反应,铜完全溶解。产生的NO和
 混合气体在标准状况下的体积为11.2L,其中NO的体积为
混合气体在标准状况下的体积为11.2L,其中NO的体积为
您最近一年使用:0次
6 . 草酸亚铁晶体( FeC2O4·2H2O)是一种淡黄色粉末,可用作照相显影剂。某课外小组利用如下实验装置对草酸亚铁晶体分解产物进行探究,并设计实验测定草酸亚铁晶体样品纯度。
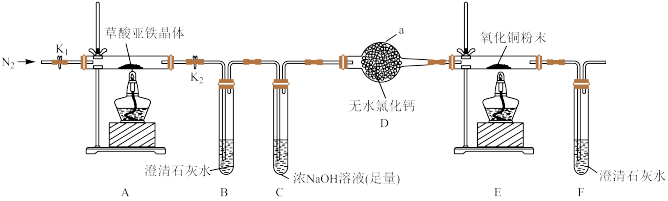
回答下列问题:
(1)仪器a的名称为_____ ;装置B中澄清石灰水变浑浊,说明气体分解产物中含有_____ ;
(2)实验前先通一段时间N2目的是________ ;装置C中浓NaOH溶液的作用是______ ;
(3)证明草酸亚铁晶体分解产物中含有CO的实验现象是______ ;
(4)充分反应后,将装置A硬质玻璃管中的残留固体溶于足量的稀硫酸中,无气泡产生,滴加几滴KSCN溶液,溶液不变红,说明固体分解产物是______ (填化学式);根据上述实验现象写出草酸亚铁晶体分解的化学方程式_______ ;
(5)所给实验装置存在明显的设计缺陷,该缺陷是______ ;
(6)草酸亚铁晶体样品纯度的测定:准确称取12. 000 g某草酸亚铁晶体样品,在一定条件下溶于稍过量的硫酸中,配成250 mL溶液。取25.00 mL上述溶液,用0.100 mol/L KMnO4标准溶液滴定,达到滴定终点时, 消耗35.00 mL KMnO4标准溶液,滴定反应为:FeC2O4·2H2O + KMnO4+ H2SO4→Fe2(SO4)3+CO2↑+ MnSO4 + K2SO4 + H2O(未配平)。则该草酸亚铁晶体样品的纯度为________ (已知该草酸亚铁晶体样品中不含其他与高锰酸钾反应的还原性杂质)。

回答下列问题:
(1)仪器a的名称为
(2)实验前先通一段时间N2目的是
(3)证明草酸亚铁晶体分解产物中含有CO的实验现象是
(4)充分反应后,将装置A硬质玻璃管中的残留固体溶于足量的稀硫酸中,无气泡产生,滴加几滴KSCN溶液,溶液不变红,说明固体分解产物是
(5)所给实验装置存在明显的设计缺陷,该缺陷是
(6)草酸亚铁晶体样品纯度的测定:准确称取12. 000 g某草酸亚铁晶体样品,在一定条件下溶于稍过量的硫酸中,配成250 mL溶液。取25.00 mL上述溶液,用0.100 mol/L KMnO4标准溶液滴定,达到滴定终点时, 消耗35.00 mL KMnO4标准溶液,滴定反应为:FeC2O4·2H2O + KMnO4+ H2SO4→Fe2(SO4)3+CO2↑+ MnSO4 + K2SO4 + H2O(未配平)。则该草酸亚铁晶体样品的纯度为
您最近一年使用:0次
7 . 实验是学习化学的基础,某课外兴趣小组在学了苯与液溴的反应以后,对该反应的类型提出了猜想。
(1)甲组认为苯与液溴的反应是加成反应,乙组则认为苯与液溴的反应是___ ,对此问题你认为该怎样去证明,说出你的方法:___ 。
为了证明他们的猜想是否正确,按照如图的实验装置(夹持装置省略)进行实验。
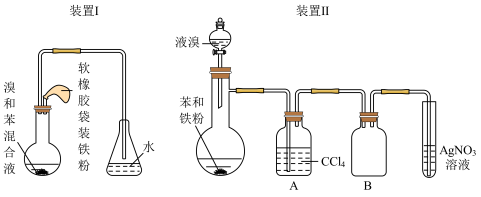
(2)比较装置Ⅰ和装置Ⅱ,选择___ (装置Ⅰ或装置Ⅱ),装置Ⅱ的A中CCl4溶液的作用是___ 。
(3)装有苯和铁粉的仪器名称是___ ,B集气瓶的作用是___ ,若试管中出现___ 现象乙组猜想正确。
(4)写出铁与液溴反应的化学方程式___ ,苯和液溴反应的化学方程式___ 。
(5)简要叙述除去溴苯中溴的方法:___ 。
(1)甲组认为苯与液溴的反应是加成反应,乙组则认为苯与液溴的反应是
为了证明他们的猜想是否正确,按照如图的实验装置(夹持装置省略)进行实验。
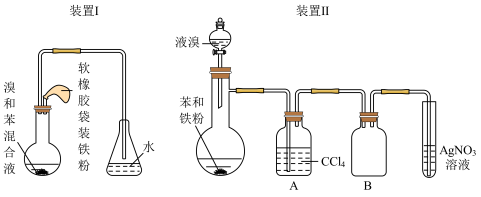
(2)比较装置Ⅰ和装置Ⅱ,选择
(3)装有苯和铁粉的仪器名称是
(4)写出铁与液溴反应的化学方程式
(5)简要叙述除去溴苯中溴的方法:
您最近一年使用:0次
8 . 某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________ 。A中制取Cl2的离子方程式____________________ 。
(2)试剂Y的名称为______________ 。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________ ;
假设2:存在三种成分:NaHCO3和__________________________ 。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。_______
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________ 。

(1)试剂X的化学式
(2)试剂Y的名称为
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和
假设2:存在三种成分:NaHCO3和
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品 于试管中,滴加足量蒸馏水至 固体溶解然后将所得溶液分 别置于A、B试管中 | |
| 步骤2:向A试管中滴加BaCl2 溶液 | ———— ———— |
| 步骤3: | ———— ———— |
您最近一年使用:0次
2020-02-06更新
|
85次组卷
|
4卷引用:贵州省天柱县第二中学2019-2020学年高一上学期期末考试化学试题
解题方法
9 . 某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一段时间后加热铜丝。

根据反应中观察到的现象,回答下列问题:
(1)金属钠的变化现象________ 。
(2)U形管中溶液的颜色_____ ,说明有__________ 生成。
(3)铜丝的变化现象____________ ,说明有________ 生成;若去掉后面的装置,简述检验气体的方法____
(4)若a g钠与b mL水完全反应,则该溶液溶质的质量分数是_______ 。

根据反应中观察到的现象,回答下列问题:
(1)金属钠的变化现象
(2)U形管中溶液的颜色
(3)铜丝的变化现象
(4)若a g钠与b mL水完全反应,则该溶液溶质的质量分数是
您最近一年使用:0次
2019-08-31更新
|
528次组卷
|
5卷引用:贵州省黎平第二中学2019-2020学年高一上学期期末考试化学试题
贵州省黎平第二中学2019-2020学年高一上学期期末考试化学试题广西武宣县第二中学2019-2020学年高一上学期期末考试化学试题第二课时 研究物质性质的基本方法 练习鲁教版高中化学必修1第一章《认识化学科学》测试卷2(已下线)1.2.1 研究物质性质的基本方法 练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)
名校
解题方法
10 . 根据下图所示装置回答以下问题。已知:①KMnO4常温下与浓盐酸反应可制得Cl2。②H2SiO3不溶于水。

(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是________________ 。干燥管D的作用是____________ 。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为____________________________ 。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________ 。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为________ (填序号);试管中发生反应的离子方程式为__________________ 。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是_____________________ 。

(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为
您最近一年使用:0次
2020-01-13更新
|
527次组卷
|
12卷引用:贵州省榕江县第三高级中学2019-2020学年高一上学期期末考试化学试题
贵州省榕江县第三高级中学2019-2020学年高一上学期期末考试化学试题贵州省岑巩县第二中学2019-2020学年高一上学期期末考试化学试题云南省梁河县第一中学2019-2020学年高一上学期期末考试化学试题云南省文山壮族苗族自治州富宁县第二中学2019-2020学年高一上学期期末考试化学试题广西壮族自治区河池市罗城县第二高级中学2019-2020学年高一上学期期末考试化学试题四川省泸县第二中学2019-2020学年高一下学期期末模拟考试化学试题云南省玉溪第三中学2021-2022学年高一上学期期末考试化学试题安徽省定远县育才学校2019-2020学年高一下学期4月月考化学试题甘肃省张掖市临泽县第一中学2019-2020学年高一下学期期中考试化学试题(已下线)5.1.3 同主族元素的性质(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)广西钦州市第四中学2022-2023学年高一上学期12月份考试化学试题河北省衡水市河北武强中学2023-2024学年高二上学期开学考试化学试题