名校
1 . 下列有关海水综合利用的说法正确的是
| A.海水中含有溴和钾元素,只需经过物理变化就可以得到溴和钾单质 |
| B.电解MgCl2饱和溶液,可制得金属镁 |
| C.从海水中可以得到NaCl,电解熔融NaCl可制得金属钠 |
| D.从海带中提取碘单质的过程不涉及氧化还原反应 |
您最近一年使用:0次
2021-08-06更新
|
190次组卷
|
4卷引用:安徽省安庆市第九中学2021-2022学年高二上学期开学考试化学试题
名校
2 . 碘是人体必需的元素之一,海带中含有丰富的碘元素。灼烧海带获取的海带灰中,碘元素主要以 形式存在。在实验室中,从海带灰中提取碘的流程如下:
形式存在。在实验室中,从海带灰中提取碘的流程如下:
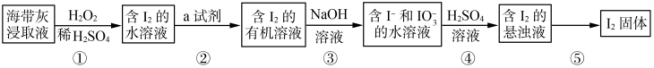
回答下列问题:
(1)实验室灼烧海带的主要仪器有酒精灯、三脚架、泥三角、玻璃棒、___________ 等;
(2)指出上述提取碘的过程中有关实验操作的名称:步骤②___________ ,步骤⑤___________ ;
(3)写出步骤①中发生反应的离子方程式:___________ ;
(4)步骤②中提取碘的过程中,可选择的有机试剂是___________(填编号);
(5)写出步骤④中发生反应的离子方程式:___________ ,在此反应中,每生成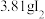 转移
转移___________ mol电子;
(6)上述流程中,含 的水溶液经3步转化为含
的水溶液经3步转化为含 的悬浊液,主要目的是
的悬浊液,主要目的是___________ 。
 形式存在。在实验室中,从海带灰中提取碘的流程如下:
形式存在。在实验室中,从海带灰中提取碘的流程如下:
回答下列问题:
(1)实验室灼烧海带的主要仪器有酒精灯、三脚架、泥三角、玻璃棒、
(2)指出上述提取碘的过程中有关实验操作的名称:步骤②
(3)写出步骤①中发生反应的离子方程式:
(4)步骤②中提取碘的过程中,可选择的有机试剂是___________(填编号);
| A.酒精 | B.醋酸 | C.四氯化碳 | D.苯 |
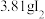 转移
转移(6)上述流程中,含
 的水溶液经3步转化为含
的水溶液经3步转化为含 的悬浊液,主要目的是
的悬浊液,主要目的是
您最近一年使用:0次
2021-08-04更新
|
453次组卷
|
4卷引用:山东省济南市2020-2021学年高一下学期期末考试化学试题
3 . 碘是人体的必需微量元素之一,海带提取碘的部分实验流程如下
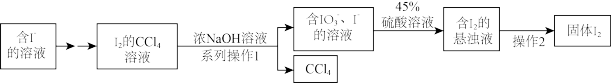
(1)系列操作1中需用到的玻璃仪器有烧杯、玻璃棒和___________ ,操作2的实验方法是___________ 。
(2)氧化 通常用
通常用 作为氧化剂,写出反应的离子方程式
作为氧化剂,写出反应的离子方程式___________ 。
(3)某实验小组研究 的氧化,将
的氧化,将 通入KI溶液中,出现黄色,查阅资料,发生了以下反应:
通入KI溶液中,出现黄色,查阅资料,发生了以下反应: 。为了探究该反应的影响因素,设计以下实验:
。为了探究该反应的影响因素,设计以下实验:
①用水吸收 制取
制取 水溶液,吸收装置最佳的是
水溶液,吸收装置最佳的是___________ 。

②实验1和2探究___________ 对实验的影响,实验2和3探究___________ 对实验的影响,实验2加蒸馏水的体积为___________ (用表中字母或字母的表达式作答)。
③添加药品的合理顺序为: 水溶液、
水溶液、___________ 、稀盐酸、___________ (填“KI溶液”或“蒸馏水”)。
④往三组实验中滴加淀粉溶液,均没有出现蓝色,你认为原因是___________ (用化学方程式解释)。检验该反应发生的实验试剂是___________ 。
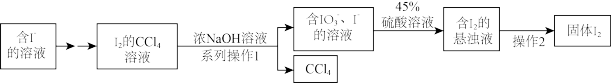
(1)系列操作1中需用到的玻璃仪器有烧杯、玻璃棒和
(2)氧化
 通常用
通常用 作为氧化剂,写出反应的离子方程式
作为氧化剂,写出反应的离子方程式(3)某实验小组研究
 的氧化,将
的氧化,将 通入KI溶液中,出现黄色,查阅资料,发生了以下反应:
通入KI溶液中,出现黄色,查阅资料,发生了以下反应: 。为了探究该反应的影响因素,设计以下实验:
。为了探究该反应的影响因素,设计以下实验:| 实验序号 |  水溶液(mL) 水溶液(mL) |  溶液(mL) 溶液(mL) | 稀盐酸(mL) | 蒸馏水(mL) | 实验现象 |
| 1 | a(过量) | b | 0 | d | 溶液逐渐变浅黄色 |
| 2 | a(过量) | b | c | ___________ | 溶液变黄,有浑浊 |
| 3 | a(过量) | 2b | c | 0 | 溶液变黄,比实验2出现浑浊更快 |
 制取
制取 水溶液,吸收装置最佳的是
水溶液,吸收装置最佳的是
②实验1和2探究
③添加药品的合理顺序为:
 水溶液、
水溶液、④往三组实验中滴加淀粉溶液,均没有出现蓝色,你认为原因是
您最近一年使用:0次
2021-08-04更新
|
586次组卷
|
3卷引用:广东省2022届高三8月阶段性质量检测化学试题
名校
4 . 某工厂的废液中含有CCl4、I2、I-等物质,其提取碘的过程如图所示。下列说法错误的是


A.还原过程发生反应的离子方程式为 +I2+H2O=2I-+ +I2+H2O=2I-+ +2H+ +2H+ |
| B.用淀粉检验所富集碘的溶液中是否含有I- |
| C.操作X的名称为分液 |
| D.氧化过程通入Cl2是为了提取碘 |
您最近一年使用:0次
2021-07-16更新
|
269次组卷
|
3卷引用:黑龙江双鸭山市第一中学2020-2021学年高二下学期期末考试化学试题
黑龙江双鸭山市第一中学2020-2021学年高二下学期期末考试化学试题四川省成都七中2022届高三上学期入学测化学试题(已下线)第2章基础巩固测评-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)
解题方法
5 . 海洋中有丰富的食品、矿产、能源、药物和水产资源。下列有关说法正确的是
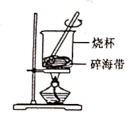

| A.如图装置可用于灼烧碎海带 |
| B.可用淀粉溶液检验海带灰浸出液中的碘元素 |
| C.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 |
| D.可以通过电解氯化镁溶液获得金属镁 |
您最近一年使用:0次
2021-07-15更新
|
119次组卷
|
2卷引用:贵州省贵阳市普通中学2020-2021学年高一下学期期末联考化学试题
名校
6 . 海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是___ (填序号)。
A.Cl2 B.淡水 C.烧碱 D.粗盐
(2)如图是从海水中提取镁的简单流程。___ ,Mg(OH)2转化为MgCl2的离子方程式是___ 。
②由无水MgCl2制取Mg的化学方程式是___ 。
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如图所示:
干海带 海带灰
海带灰 滤液
滤液
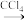
 I2
I2
①灼烧海带时所用的主要仪器名称是___ 。
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式:___ 。
③反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈___ 。
(1)无需经过化学变化就能从海水中获得的物质是
A.Cl2 B.淡水 C.烧碱 D.粗盐
(2)如图是从海水中提取镁的简单流程。

②由无水MgCl2制取Mg的化学方程式是
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如图所示:
干海带
 海带灰
海带灰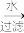 滤液
滤液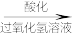
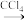
 I2
I2①灼烧海带时所用的主要仪器名称是
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式:
③反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈
您最近一年使用:0次
2021-06-30更新
|
246次组卷
|
2卷引用:江西省南昌市第十中学2020-2021学年高一下学期期末考试化学试题
名校
7 . 从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:
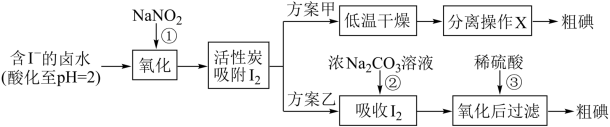
资料显示:
Ⅰ.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成NO;
Ⅱ. ;
;
Ⅲ.I2在碱性溶液中反应生成I-和IO 。
。
(1)写出反应①的离子方程式___________ 。
(2)方案甲中,根据I2的特性,分离操作X应为___________ 、___________ 。
(3)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是___________ 。
(4)写出反应②的离子反应方程式___________
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-。请检验滤液中的I-,将实验方案补充完整。实验中可供选择的试剂:CCl4、稀H2SO4、淀粉溶液、Fe2(SO4)3溶液。
A.将滤液___________ ,直到水层用淀粉溶液检验不出碘单质存在。
B.从水层取少量溶液于试管中,___________ 。

资料显示:
Ⅰ.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成NO;
Ⅱ.
 ;
;Ⅲ.I2在碱性溶液中反应生成I-和IO
 。
。(1)写出反应①的离子方程式
(2)方案甲中,根据I2的特性,分离操作X应为
(3)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是
(4)写出反应②的离子反应方程式
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-。请检验滤液中的I-,将实验方案补充完整。实验中可供选择的试剂:CCl4、稀H2SO4、淀粉溶液、Fe2(SO4)3溶液。
A.将滤液
B.从水层取少量溶液于试管中,
您最近一年使用:0次
2021-06-24更新
|
257次组卷
|
2卷引用:云南省玉溪市一中2020-2021学年高一下学期第二次月考化学试题
21-22高一上·江苏镇江·期末
解题方法
8 . 海藻中含有丰富的碘元素,海藻灼烧后碘元素通常以I-的形式存在。实验室从海藻灰中提取I2的流程如图所示:
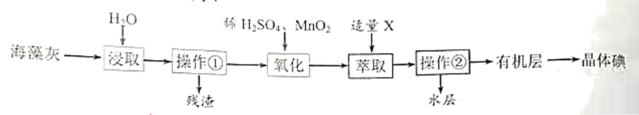
(1)操作①为___________ ,操作②为___________ 。
(2)氧化时发生反应的离子方程式为___________ 。
(3)试剂X可以选择___________ (选填字母)
A.酒精 B.四氯化碳 C.盐酸 D.苯
(4)实验室进行操作②需要的玻璃仪器有烧杯、玻璃棒和___________ 。

(1)操作①为
(2)氧化时发生反应的离子方程式为
(3)试剂X可以选择
A.酒精 B.四氯化碳 C.盐酸 D.苯
(4)实验室进行操作②需要的玻璃仪器有烧杯、玻璃棒和
您最近一年使用:0次
9 . 下列说法不正确 的是
| A.应避免铵态氮肥与草木灰混合施用 |
| B.工业上可用离子交换法提高海带中碘的提取率 |
| C.电解饱和食盐水可以得到金属钠和氯气 |
| D.将生铁进一步炼制减少含碳量,能得到耐腐蚀的钢 |
您最近一年使用:0次
2021-06-15更新
|
5294次组卷
|
11卷引用:2021年6月新高考浙江化学高考真题
2021年6月新高考浙江化学高考真题(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题05.元素及其化合物-十年(2012-2021)高考化学真题分项汇编(浙江专用)辽宁省东北育才学校2021-2022学年高二上学期期中考试化学试题(已下线)2021年6月浙江高考化学试题变式题1-10(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)微专题02 化学与STSE-备战2023年高考化学一轮复习考点微专题(已下线)考点09 氯及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题01 化学与STSE 物质的组成、性质和用途-2023年高考化学真题题源解密(全国通用)
10 . 从海带中提取碘的实验中,所选择的装置或仪器(夹持装置已略去)正确的是
A.灼烧 | B.溶解 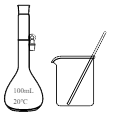 |
C.过滤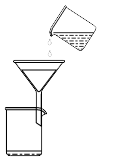 | D.分液 |
您最近一年使用:0次
2021-06-07更新
|
241次组卷
|
2卷引用:河南省豫西名校2020-2021学年高一下期第二次联考化学试题



