江苏省百校联考2021届高三第一次考试化学试题
江苏
高三
阶段练习
2020-12-31
351次
整体难度:
容易
考查范围:
化学与STSE、认识化学科学、有机化学基础、物质结构与性质、常见无机物及其应用、化学反应原理、化学实验基础
江苏省百校联考2021届高三第一次考试化学试题
江苏
高三
阶段练习
2020-12-31
351次
整体难度:
容易
考查范围:
化学与STSE、认识化学科学、有机化学基础、物质结构与性质、常见无机物及其应用、化学反应原理、化学实验基础
一、单选题 添加题型下试题
1. 各省将继续大力实施“清水蓝天”工程。下列做法不利于“清水蓝天”工程实施的是
| A.积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 |
| B.禁止未经处理的工业废水和生活污水的任意排放 |
| C.规划禽畜禁养区,关闭、拆除禁养区养殖场,减少粪污对河道的污染 |
| D.用Ba(OH)2消除水中Cu2+等重金属离子污染 |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
2. “新冠病毒”疫情让人们再次认识到化学的重要性。下列有关抗疫物资的化学用语表示正确的是
A.碘酊中质量数为127的碘原子: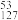 I I |
| B.医用酒精中乙醇的结构简式: C2H6O |
| C.“84”消毒液中次氯酸钠的电离方程式:NaClO=Na++ClO- |
D.口罩“熔喷层”原料中聚丙烯的结构简式: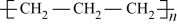 |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
3. 下列有关物质的性质与用途不相符合的是
| A.铜的金属活动性比铁的弱,可用铜罐代替铁罐贮运浓硝酸 |
| B.浓硫酸具有吸水性,可用于干燥HCl、SO2等 |
| C.铁粉具有还原性,可用作食品袋内的抗氧化剂 |
| D.液氨汽化时要吸收大量的热,可用作制冷剂 |
您最近一年使用:0次
2020-12-23更新
|
250次组卷
|
5卷引用:江苏省百校联考2021届高三第一次考试化学试题
单选题
|
较易(0.85)
解题方法
4. 室温下,下列各组离子在指定溶液中能大量共存的是
A.c(H+)=0.1 mol∙L−1的溶液中:Mg2+、K+、 、CH3COO- 、CH3COO- |
B.c( )=0.1 mol∙L−1的溶液中:K+、Na+、 )=0.1 mol∙L−1的溶液中:K+、Na+、 、OH- 、OH- |
C. =10−12的溶液中: =10−12的溶液中: 、ClO-、K+、 、ClO-、K+、 |
| D.加入KSCN显血红色的澄清透明溶液中:Cu2+、Na+、I-、Cl- |
【知识点】 离子共存 限定条件下的离子共存解读 水的离子积常数解读
您最近一年使用:0次
单选题
|
适中(0.65)
5. 实验是化学学习的基础。用下列实验装置进行相应的实验,能达到实验目的的是






| A.用装置甲制取并收集干燥纯净的NH3 |
| B.用装置乙制取Fe(OH)2并能较长时间观察其颜色 |
| C.用装置丙完成醋酸、碳酸和苯酚的酸性强弱验证实验 |
| D.用装置丁实验室制取少量乙烯 |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
6. W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10;X原子的核外电子数和Ne原子的核外电子数相差1;Y元素的最高正价和最低负价的代数和为4。下列说法一定正确的是
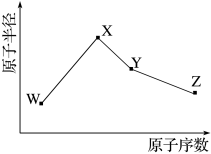

| A.Z的单质有毒,且有漂白性 |
| B.最简单气态氢化物的稳定性:Y>Z |
| C.化合物XZW中既含离子键,又含共价键 |
| D.Y的氧化物对应水化物的酸性比Z的氧化物对应水化物的酸性弱 |
您最近一年使用:0次
单选题
|
适中(0.65)
7. 下列指定反应的离子方程式正确的是
A.SO2通入溴水中:SO2+2H2O+Br2=2H++S +2HBr +2HBr |
| B.向NaClO溶液中加入浓盐酸:ClO-+Cl-+2H+=Cl2↑+H2O |
C.Cu与浓硝酸反应:3Cu+8H++2N =3Cu2++2NO↑+4H2O =3Cu2++2NO↑+4H2O |
D.向银氨溶液中加入CH3CHO溶液并水浴加热:CH3CHO+2Ag(NH3)2OH CH3COO-+N CH3COO-+N +2Ag↓+3NH3+H2O +2Ag↓+3NH3+H2O |
您最近一年使用:0次
单选题
|
较易(0.85)
8. 在给定条件下,下列物质间的转化均能实现的是
A.Fe Al Al H2 H2 |
B.MgCO3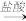 MgCl2(aq) MgCl2(aq)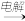 Mg Mg |
C.BrCH2COOH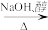 HOCH2COONa HOCH2COONa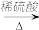 HOCH2COOH HOCH2COOH |
D.NH3 NO NO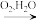 HNO3 HNO3 |
您最近一年使用:0次
单选题
|
适中(0.65)
9. 下列说法正确的是
| A.相同条件下,pH=3的HA溶液与HB溶液分别与足量的锌反应,与HB反应放出的氢气较多,说明HB的酸性比HA的弱 |
| B.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除 |
| C.合成氨生产中将NH3液化分离,可加快正反应速率,提高 N2、H2的转化率 |
D.向Na2CO3溶液中加入少量Ca(OH)2固体,C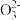 水解程度减小,溶液的pH减小 水解程度减小,溶液的pH减小 |
您最近一年使用:0次
单选题
|
适中(0.65)
10. 下列关于各图象的解释或得出的结论正确的是
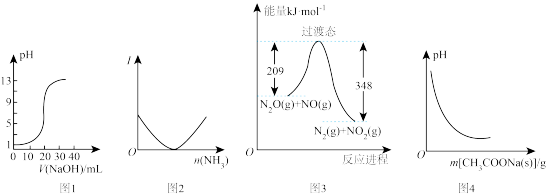

| A.图1表示0.10 mol·L-1的NaOH溶液滴定20.00 mL 0.10 mol·L-1醋酸溶液的滴定曲线 |
| B.图2表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 |
| C.根据图3所示可知:N2(g)+NO2(g)=N2O(g)+NO(g) ΔH=+139 kJ·mol-1 |
| D.图4表示向CH3COOH溶液中逐步加CH3COONa固体后,溶液pH的变化 |
您最近一年使用:0次
二、多选题 添加题型下试题
多选题
|
较易(0.85)
解题方法
11. 香豆素是一类重要的有机杂环化合物,其合成中涉及下列a、b、c 3个化合物的转化。下列有关说法正确的是


| A.a、b、c都属于芳香族化合物 |
| B.a和c分子中所有碳原子一定处于同一平面 |
| C.a和b生成c的反应类型是取代反应 |
| D.1 mol b、c均最多能与4 mol NaOH反应 |
您最近一年使用:0次
三、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
12. 下列说法正确的是
| A.常温下,反应2A(s)+B(g)=2C(g)+D(g)不能自发进行,则反应ΔH一定大于0 |
| B.船底部放锌板是利用牺牲阴极的阳极保护法减少海水对船体的腐蚀 |
| C.加水稀释0.01 mol·L-1的醋酸溶液,溶液中所有离子浓度均减小 |
| D.铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 |
【知识点】 化学反应进行方向的判据 水的电离 金属的电化学腐蚀与防护 电镀解读
您最近一年使用:0次
2020-12-23更新
|
103次组卷
|
2卷引用:江苏省百校联考2021届高三第一次考试化学试题
单选题
|
适中(0.65)
解题方法
13. 下列实验操作和现象与实验结论一定正确的是
实验操作和现象 | 实验结论 | |
A | 加入少量硫酸铜可加快锌与稀硫酸的反应速率 | Cu2+是该反应的催化剂 |
B | 分别向等物质的量浓度的苯酚钠溶液和碳酸钠溶液中滴加酚酞,后者红色更深 | 结合质子的能力:C |
C | 常温下,向AgNO3溶液中先滴加少量KCl溶液,再继续向其中滴加少量KI溶液,先后生成白色沉淀和黄色沉淀 | 常温下,Ksp(AgCl)>Ksp(AgI) |
D | 向20%的麦芽糖溶液中加入少量稀硫酸,加热,再加入 NaOH 溶液调至碱性, 再加入银氨溶液, 水浴加热,出现银镜 | 麦芽糖的水解产物具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
四、多选题 添加题型下试题
多选题
|
较易(0.85)
解题方法
14. 室温下,下列溶液中微粒的物质的量浓度关系正确的是
| A.新制氯水中:c(H+)=c(HClO)+2c(ClO-)+c(OH-) |
| B.0.1 mol∙L−1的NaOH溶液与0.2 mol∙L−1的CH3COOH溶液等体积混合,pH<7:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+) |
C.pH=9的NaHCO3溶液中:c(H2CO3)-c( )=c(OH-)-c(H+) )=c(OH-)-c(H+) |
D.0.2 mol∙L−1的Na2C2O4 溶液与0.1 mol∙L−1的NaHC2O4 溶液等体积混合: 5c(Na+)=3[c( )+c( )+c( )+c(H2C2O4)] )+c(H2C2O4)] |
您最近一年使用:0次
多选题
|
较难(0.4)
15. 一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:CO(g)+2H2(g)⇌CH3OH(g),各容器中各物质的起始物质的量与反应温度见下表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:

下列说法正确的是
容器 | 温度/℃ | 起始物质的量/mol | ||
CO(g) | H2(g) | CH3OH(g) | ||
Ⅰ | T1 | 0.2 | 0.4 | 0 |
Ⅱ | T1 | 0.06 | 0.16 | 0.2 |
Ⅲ | T2 | 0.2 | 0.4 | 0 |

下列说法正确的是
| A.前10 min内,容器Ⅲ中反应的平均速率为v(H2)=0.005 mol·L-1·min-1 |
| B.容器Ⅰ达到平衡后,向容器Ⅰ中再充入2.0 mol CO和2.0 mol CH3OH,再次到达平衡时,c(H2)<0.08 mol·L-1 |
C.达到平衡时,容器Ⅱ中的压强与容器Ⅰ中的压强比大于 |
| D.将容器Ⅲ改为绝热容器,实验起始温度为T2,达到平衡时,CO的转化率大于50% |
您最近一年使用:0次
五、解答题 添加题型下试题
解答题-工业流程题
|
较易(0.85)
解题方法
16. 金属钒在汽车、航空、铁路、电子技术、国防工业等行业应用广泛,钒的氧化物已经成为化学工业中最佳催化剂之一。从钒铬还原渣 [VO2·H2O、Cr(OH)3]中分离钒、铬的工业流程如下:

(1) 为提高“碱浸”速率,除适当升高温度外,还可采取的措施有____ (举一例)。
(2)“碱浸”中主要反应的离子方程式为________ 。
(3)“焙烧”产物经不同浓度的NaOH溶液浸出后所得到的V2O5和Cr2O3浸出率如图所示:

则NaOH溶液适宜的浓度为____ 。
(4)“碱浸”时加入的氢氧化钠不宜过量太多的原因是_________ 。
(5)流程中“沉淀”所得为钒的铵盐沉淀物[x(NH4)2O·yV2O5·zH2O],证明沉淀已洗净的操作是______ 。
(6)实验室“过滤”时,用到的硅酸盐质仪器除烧杯外,还用到的两种为___ 、 __ 。

(1) 为提高“碱浸”速率,除适当升高温度外,还可采取的措施有
(2)“碱浸”中主要反应的离子方程式为
(3)“焙烧”产物经不同浓度的NaOH溶液浸出后所得到的V2O5和Cr2O3浸出率如图所示:

则NaOH溶液适宜的浓度为
(4)“碱浸”时加入的氢氧化钠不宜过量太多的原因是
(5)流程中“沉淀”所得为钒的铵盐沉淀物[x(NH4)2O·yV2O5·zH2O],证明沉淀已洗净的操作是
(6)实验室“过滤”时,用到的硅酸盐质仪器除烧杯外,还用到的两种为
您最近一年使用:0次
解答题-有机推断题
|
困难(0.15)
解题方法
17. 随着年龄的增长,血液更容易高凝,就容易得血栓。H( )是一种抗血栓新药的主要成分,其合成路线如下:
)是一种抗血栓新药的主要成分,其合成路线如下:


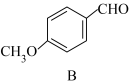




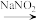 E
E
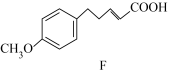


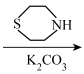 H
H
(1)化合物C中的含氧官能团为____ (填官能团名称)。
(2)C⟶D的反应类型为____ 。
(3)E的分子式为C10H12O2,写出E的结构简式:____ 。
(4)写出G⟶H的化学方程式:_________ 。
(5)写出同时满足下列条件的F的一种同分异构体的结构简式:____ 。
①能发生银镜反应,也能与FeCl3溶液发生显色反应
②核磁共振氢谱显示有4组峰,吸收强度之比为9∶2∶2∶1
(6)已知: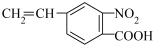
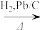
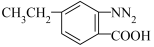 ,且—NH2易被氧化。
,且—NH2易被氧化。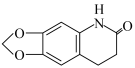 是一种调节血脂药物的中间体。请写出以
是一种调节血脂药物的中间体。请写出以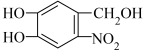 、CH2(COOH)2、CH2Cl2及C5H11N为原料制备该中间体的合成路线流程图(无机试剂任用)
、CH2(COOH)2、CH2Cl2及C5H11N为原料制备该中间体的合成路线流程图(无机试剂任用)______ 。合成路线流程示例如下:CH2=CH2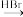 CH3CH2Br
CH3CH2Br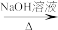 CH3CH2OH。
CH3CH2OH。
 )是一种抗血栓新药的主要成分,其合成路线如下:
)是一种抗血栓新药的主要成分,其合成路线如下:






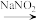 E
E



 H
H(1)化合物C中的含氧官能团为
(2)C⟶D的反应类型为
(3)E的分子式为C10H12O2,写出E的结构简式:
(4)写出G⟶H的化学方程式:
(5)写出同时满足下列条件的F的一种同分异构体的结构简式:
①能发生银镜反应,也能与FeCl3溶液发生显色反应
②核磁共振氢谱显示有4组峰,吸收强度之比为9∶2∶2∶1
(6)已知:

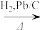
 ,且—NH2易被氧化。
,且—NH2易被氧化。 是一种调节血脂药物的中间体。请写出以
是一种调节血脂药物的中间体。请写出以 、CH2(COOH)2、CH2Cl2及C5H11N为原料制备该中间体的合成路线流程图(无机试剂任用)
、CH2(COOH)2、CH2Cl2及C5H11N为原料制备该中间体的合成路线流程图(无机试剂任用)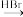 CH3CH2Br
CH3CH2Br CH3CH2OH。
CH3CH2OH。
您最近一年使用:0次
解答题-实验探究题
|
较难(0.4)
18. 草酸合铁(Ⅲ) 酸钾晶体,即K3[Fe(C2O4)3]·3H2O,是制备某些铁触媒的主要原料。该配合物易溶于水,难溶于乙醇,对光敏感,光照下即发生分解。可用如下流程来制备。根据题意完成下列各题:

(1)“溶解”时加入硫酸的目的是___________ 。
(2)流程的“氧化”这一步,是依次加入一定量的饱和K2C2O4溶液、H2C2O4溶液、3%H2O2溶液,不断搅拌溶液并维持在40 ℃左右。充分反应后,沉淀溶解,溶液的pH保持在4~5,此时溶液呈翠绿色,趁热将溶液过滤到烧杯中,___ (补充必要的步骤),得草酸合铁(Ⅲ) 酸钾晶体。
(3)写出在“氧化”这一步中,使沉淀溶解生成翠绿色溶液的离子方程式:___ 。
(4)草酸合铁(Ⅲ) 酸钾晶体光照下立即发生分解生成两种草酸盐、CO2等,写出该反应的化学方程式:____ 。
(5)某学生想测定草酸合铁(Ⅲ)酸钾晶体{Ka[Fe(C2O4)b]·cH2O}的组成,查阅资料,发现该晶体加热到110 ℃时仅完全失去结晶水。在实验室通过下列方法完成了该过程。具体如下:
步骤1:准确称取两份质量均为0.4910 g的草酸合铁(Ⅲ)酸钾样品。
步骤2:一份在N2氛围下保持110 ℃加热至恒重,称得残留固体质量为0.4370 g。
步骤3:另一份完全溶于水后,让其通过装有某阴离子交换树脂的交换柱{发生反应:aRCl+[Fe(C2O4)b]a-=Ra[Fe(C2O4)b]+aCl-},用蒸馏水冲洗交换柱,收集交换出的Cl-,以K2CrO4为指示剂,用0.1500 mol·L-1的AgNO3溶液滴定至终点,消耗AgNO3溶液20.00 mL。
①若步骤3中未用蒸馏水冲洗交换柱,则测得的样品中K+的物质的量____ (填“偏大”“偏小”或“不变”)。
②通过计算确定草酸合铁(Ⅲ)酸钾样品的化学式:____________ (写出计算过程)。

(1)“溶解”时加入硫酸的目的是
(2)流程的“氧化”这一步,是依次加入一定量的饱和K2C2O4溶液、H2C2O4溶液、3%H2O2溶液,不断搅拌溶液并维持在40 ℃左右。充分反应后,沉淀溶解,溶液的pH保持在4~5,此时溶液呈翠绿色,趁热将溶液过滤到烧杯中,
(3)写出在“氧化”这一步中,使沉淀溶解生成翠绿色溶液的离子方程式:
(4)草酸合铁(Ⅲ) 酸钾晶体光照下立即发生分解生成两种草酸盐、CO2等,写出该反应的化学方程式:
(5)某学生想测定草酸合铁(Ⅲ)酸钾晶体{Ka[Fe(C2O4)b]·cH2O}的组成,查阅资料,发现该晶体加热到110 ℃时仅完全失去结晶水。在实验室通过下列方法完成了该过程。具体如下:
步骤1:准确称取两份质量均为0.4910 g的草酸合铁(Ⅲ)酸钾样品。
步骤2:一份在N2氛围下保持110 ℃加热至恒重,称得残留固体质量为0.4370 g。
步骤3:另一份完全溶于水后,让其通过装有某阴离子交换树脂的交换柱{发生反应:aRCl+[Fe(C2O4)b]a-=Ra[Fe(C2O4)b]+aCl-},用蒸馏水冲洗交换柱,收集交换出的Cl-,以K2CrO4为指示剂,用0.1500 mol·L-1的AgNO3溶液滴定至终点,消耗AgNO3溶液20.00 mL。
①若步骤3中未用蒸馏水冲洗交换柱,则测得的样品中K+的物质的量
②通过计算确定草酸合铁(Ⅲ)酸钾样品的化学式:
您最近一年使用:0次
解答题-原理综合题
|
较易(0.85)
解题方法
19. 硫化氢(H2S)是一种有毒气体,对环境和人体健康造成极大的危害,工业上采用多种方法减少 H2S的排放。
(1)去除废气中H2S的相关热化学方程式如下:
2H2S(g)+3O2(g)=2H2O(l)+2SO2(g) ΔH=a kJ∙mol−1
2H2S(g)+SO2(g)=2H2O(l)+3S(s) ΔH=b kJ∙mol−1
反应2H2S(g)+O2(g)=2H2O(l)+2S(s) ΔH=____ kJ∙mol−1。
为了有效去除废气中的H2S,在燃烧炉中通入的H2S和空气(O2的体积分数约为20%)的体积比一般控制在0.4,理由是_____ 。
(2)最近我国科学家设计了一种H2S和CO2的协同转化装置,实现对天然气中H2S和CO2的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应:
a.EDTA−Fe2+-e-=EDTA−Fe3+
b.2EDTA−Fe3++H2S=2H+ +S↓+2EDTA−Fe2+_______ 。
②协同转化的总反应为__________ 。
(3)用Fe2(SO4)3吸收液脱除H2S法包含的反应如下:
Ⅰ.H2S(g) H2S(aq)
H2S(aq)
Ⅱ.H2S(aq) H++HS-
H++HS-
Ⅲ.HS-+2Fe3+ S↓+2Fe2++H+
S↓+2Fe2++H+
一定条件下测得脱硫率与Fe3+浓度的变化关系如图所示:____ 。
②图中当Fe3+的浓度大于10 g·L −1时,浓度越大,脱硫率越低,这是由于_____ 。
(4)生物脱H2S的原理为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O。
2Fe2(SO4)3+2H2O。
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的3×105倍,该菌的作用是_____ 。
②由图甲和图乙判断使用硫杆菌的最佳条件:_______ 。该反应必须在适应的温度下,才能有利于反应的进行,其原因可能是_____ 。
(1)去除废气中H2S的相关热化学方程式如下:
2H2S(g)+3O2(g)=2H2O(l)+2SO2(g) ΔH=a kJ∙mol−1
2H2S(g)+SO2(g)=2H2O(l)+3S(s) ΔH=b kJ∙mol−1
反应2H2S(g)+O2(g)=2H2O(l)+2S(s) ΔH=
为了有效去除废气中的H2S,在燃烧炉中通入的H2S和空气(O2的体积分数约为20%)的体积比一般控制在0.4,理由是
(2)最近我国科学家设计了一种H2S和CO2的协同转化装置,实现对天然气中H2S和CO2的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应:
a.EDTA−Fe2+-e-=EDTA−Fe3+
b.2EDTA−Fe3++H2S=2H+ +S↓+2EDTA−Fe2+

②协同转化的总反应为
(3)用Fe2(SO4)3吸收液脱除H2S法包含的反应如下:
Ⅰ.H2S(g)
 H2S(aq)
H2S(aq)Ⅱ.H2S(aq)
 H++HS-
H++HS-Ⅲ.HS-+2Fe3+
 S↓+2Fe2++H+
S↓+2Fe2++H+一定条件下测得脱硫率与Fe3+浓度的变化关系如图所示:

②图中当Fe3+的浓度大于10 g·L −1时,浓度越大,脱硫率越低,这是由于
(4)生物脱H2S的原理为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4
 2Fe2(SO4)3+2H2O。
2Fe2(SO4)3+2H2O。①硫杆菌存在时,FeSO4被氧化的速率是无菌时的3×105倍,该菌的作用是
②由图甲和图乙判断使用硫杆菌的最佳条件:

您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
解题方法
20. 实验表明,由Al2O3负载的Ni基化合物纳米粒子催化剂在CO2甲烷化(CO2+4H2=CH4+2H2O)中具有高活性,应用前景良好。回答下列问题:
(1)元素Al在周期表__ 区;写出Ni2+的外围电子排布式:____ 。
(2)元素Al与O中,第一电离能较大的是__ ;Al与Ni相比,基态原子核外未成对电子数较少的是__ 。(填元素符号)
(3)CO2与H2反应所涉及的4种物质中,属于极性分子的有__ (填化学式),与CH4互为等电子体的阴离子为__ ,CO2和CH4分子中C原子的杂化形式分别为__ 、__ 。
(4)干冰(固态CO2)的密度比冰的密度大,其主要原因是__ 。
(5)碳的一种单质C60可以认为是每个碳原子与周围的3个碳原子形成2个单键和1个双键,则1 mol C60中含有的σ键和π键的数目分别是__ 、__ 。C60的衍生物在多个领域有着诱人的应用前景,它与钾形成低温超导化合物,晶体结构如图所示,K位于立方体的棱上和立方体的内部,此化合物的化学式为__ 。

(1)元素Al在周期表
(2)元素Al与O中,第一电离能较大的是
(3)CO2与H2反应所涉及的4种物质中,属于极性分子的有
(4)干冰(固态CO2)的密度比冰的密度大,其主要原因是
(5)碳的一种单质C60可以认为是每个碳原子与周围的3个碳原子形成2个单键和1个双键,则1 mol C60中含有的σ键和π键的数目分别是

您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学与STSE、认识化学科学、有机化学基础、物质结构与性质、常见无机物及其应用、化学反应原理、化学实验基础
试卷题型(共 20题)
题型
数量
单选题
12
多选题
3
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 水体污染来源及保护措施 金属废弃物的回收及利用 新能源的开发 | |
| 2 | 0.85 | 电离方程式 乙醇的“三式一型” 原子中相关数值及其之间的相互关系 | |
| 3 | 0.85 | 氨的物理性质 硝酸的强氧化性 浓硫酸的吸水性 铁与非金属单质反应 | |
| 4 | 0.85 | 离子共存 限定条件下的离子共存 水的离子积常数 | |
| 5 | 0.65 | 氨气的制备 氢氧化亚铁的制备 乙烯制备的机理及装置 化学实验方案的设计与评价 | |
| 6 | 0.85 | 元素周期律、元素周期表的推断 由元素性质的递变规律进行相关推断 根据原子结构进行元素种类推断 根据物质性质进行元素种类推断 | |
| 7 | 0.65 | 离子方程式的正误判断 硝酸的强氧化性 二氧化硫与其他强氧化剂的反应 乙醛的银镜反应 | |
| 8 | 0.85 | 物质的转化 氨的还原性 含镁化合物 卤代烃的消去反应 | |
| 9 | 0.65 | 浓度对化学反应速率的影响 弱电解质在水溶液中的电离平衡 浓度对盐类水解的影响 沉淀转化 | |
| 10 | 0.65 | 热化学方程式含义 酸碱中和滴定 酸碱中和滴定原理的应用 同离子效应对电离的影响 | |
| 12 | 0.65 | 化学反应进行方向的判据 水的电离 金属的电化学腐蚀与防护 电镀 | |
| 13 | 0.65 | 盐溶液的酸碱性判断 沉淀转化 原电池原理对化学反应速率的影响 蔗糖与麦芽糖组成与结构 | |
| 二、多选题 | |||
| 11 | 0.85 | 有机官能团的性质及结构 有机分子中原子共面的判断 芳香族化合物的区别与分类 多官能团有机物的结构与性质 | |
| 14 | 0.85 | 盐类水解规律理解及应用 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 15 | 0.4 | 化学平衡的移动及其影响因素 化学平衡的有关计算 化学平衡题中基于图表数据的相关计算 | |
| 三、解答题 | |||
| 16 | 0.85 | 离子方程式的书写 物质分离、提纯综合应用 常见无机物的制备 物质制备的探究 | 工业流程题 |
| 17 | 0.15 | 有机推断综合考查 | 有机推断题 |
| 18 | 0.4 | 蒸发与结晶 常见无机物的制备 探究物质组成或测量物质的含量 | 实验探究题 |
| 19 | 0.85 | 化学反应原理综合考查 盖斯定律与热化学方程式 化学反应条件的控制及优化 电解池电极反应式及化学方程式的书写与判断 | 原理综合题 |
| 20 | 0.65 | 物质结构与性质综合考查 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |



