名校
1 . N-Zn/TiO2光催化氧化可用于工业上含硫废液的处理,光生电子(e-)与水电离出的H+、O2作用生成过羟基自由基(HO2·),空穴(h+)与水电离出的OH-作用生成羟基自由基(·OH),HO2·和·OH分别与 反应生成
反应生成 ,变化过程如下图所示。下列说法错误的是
,变化过程如下图所示。下列说法错误的是
 反应生成
反应生成 ,变化过程如下图所示。下列说法错误的是
,变化过程如下图所示。下列说法错误的是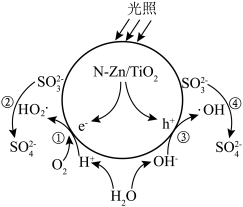
A.·OH氧化 的反应为 的反应为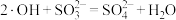 |
B.①②过程和③④过程产生的 之比为1:1 之比为1:1 |
| C.pH过低或过高均会影响催化剂的催化效果 |
D.氧化含硫废液的总反应为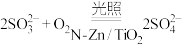 |
您最近半年使用:0次
2024-04-21更新
|
133次组卷
|
2卷引用:东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题
2 . 光催化剂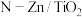 可用于含硫废液的氧化处理,光生电子
可用于含硫废液的氧化处理,光生电子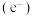 与水电离出的
与水电离出的 、
、 作用生成过氧羟基自由基
作用生成过氧羟基自由基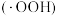 ,空穴
,空穴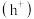 与水电离出的
与水电离出的 作用生成羟基自由基
作用生成羟基自由基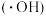 ,
, 分别与
分别与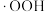 和
和 反应生成
反应生成 ,变化过程如图所示。下列说法错误的是
,变化过程如图所示。下列说法错误的是
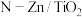 可用于含硫废液的氧化处理,光生电子
可用于含硫废液的氧化处理,光生电子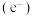 与水电离出的
与水电离出的 、
、 作用生成过氧羟基自由基
作用生成过氧羟基自由基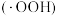 ,空穴
,空穴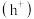 与水电离出的
与水电离出的 作用生成羟基自由基
作用生成羟基自由基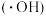 ,
, 分别与
分别与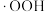 和
和 反应生成
反应生成 ,变化过程如图所示。下列说法错误的是
,变化过程如图所示。下列说法错误的是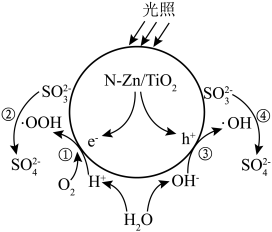
A.通过①②过程和③④过程产生的 之比为 之比为 |
B. 氧化 氧化 的反应为 的反应为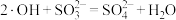 |
C. 过低或过高均会影响催化剂的催化效果 过低或过高均会影响催化剂的催化效果 |
D.氧化含硫废液的总反应为 |
您最近半年使用:0次
2024-04-16更新
|
204次组卷
|
2卷引用:东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题
名校
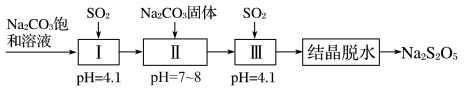
3 . 焦亚硫酸钠(Na2S2O5)为白色或黄色结晶,有强烈的刺激性气味,溶于水,水溶液呈酸性,与强酸接触放出SO2并生成相应的盐类;久置空气中,易氧化变质。Na2S2O5可由NaHSO3过饱和溶液经结晶脱水制得。利用SO2生产Na2S2O5的流程如图:
下列相关叙述不正确的是

下列相关叙述不正确的是
| A.1molNa2S2O5晶体中过氧键数目为NA |
| B.Na2S2O5久置空气中可发生反应为:Na2S2O5+O2+H2O=2NaHSO4 |
| C.反应Ⅱ为:Na2CO3+2NaHSO3=2Na2SO3+CO2↑+H2O |
| D.反应Ⅲ中充入SO2是为得到NaHSO3过饱和溶液 |
您最近半年使用:0次
名校
解题方法
4 . 下列类比或推理合理的是
| 选项 | 已知 | 方法 | 结论 |
| A | 碘遇淀粉显蓝色 | 类比 | 溴单质遇淀粉变蓝色 |
| B |  在空气中易变质 在空气中易变质 | 类比 |  在空气中也易变质 在空气中也易变质 |
| C | HCl是强酸 | 推理 | HF是强酸 |
| D |  有还原性 有还原性 | 推理 |  有强还原性 有强还原性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-10-26更新
|
583次组卷
|
7卷引用:辽宁省部分学校2023-2024学年高三上学期一轮复习联考(二)化学试题
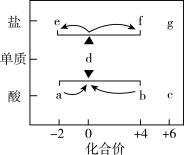
5 . 在“价-类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。图中的字母分别代表硫及其常见化合物,f、g均为含钠元素的正盐,请回答:___________ ;
(2)固体f露置在空气中易变质转化为g,该转化的化学方程式为___________ ;
(3)某同学利用下列装置测定空气中 的含量。
的含量。___________ ,该装置中 与碘(
与碘( )溶液发生反应的离子方程式为:
)溶液发生反应的离子方程式为:___________ 。若空气流速为 ,当
,当 与碘(
与碘( )溶液恰好完全反应时,耗时10 min,则该空气样品中
)溶液恰好完全反应时,耗时10 min,则该空气样品中 的含量是
的含量是___________  。(用含V的最简表达式表示)。
。(用含V的最简表达式表示)。
(2)固体f露置在空气中易变质转化为g,该转化的化学方程式为
(3)某同学利用下列装置测定空气中
 的含量。
的含量。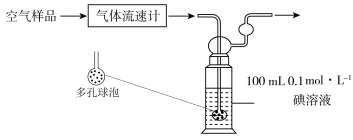
 与碘(
与碘( )溶液发生反应的离子方程式为:
)溶液发生反应的离子方程式为: ,当
,当 与碘(
与碘( )溶液恰好完全反应时,耗时10 min,则该空气样品中
)溶液恰好完全反应时,耗时10 min,则该空气样品中 的含量是
的含量是 。(用含V的最简表达式表示)。
。(用含V的最简表达式表示)。
您最近半年使用:0次
2023-09-08更新
|
244次组卷
|
2卷引用:辽宁省大连市第八中学2022-2023学年高一下学期期中考试化学试题
6 . 己二酸在有机合成工业等方面有着重要作用,以环己醇( ,M=
,M= ,
, )为原料制取己二酸[
)为原料制取己二酸[ ,M=
,M= ]
]
I.实验原理:3 +8KMnO4
+8KMnO4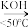 3KOOC(CH2)4COOK+8MnO2↓+2KOH+5H2O
3KOOC(CH2)4COOK+8MnO2↓+2KOH+5H2O
II.实验步骤:向250mL三颈烧瓶中加入搅拌磁子、50mL1.0%的KOH溶液和9.0g高锰酸钾,按图1所示安装装置,控制滴速并维持温度在45℃左右,共滴加环己醇2.0mL,滴加结束时需启动加热装置加热一段时间,得到浊液X。趁热过滤分离出 ,再向滤液Y中加入约4mL浓盐酸,使溶液呈酸性,加热浓缩使溶液体积减少至10mL,经过冷却、脱色得到1.46g产品。
,再向滤液Y中加入约4mL浓盐酸,使溶液呈酸性,加热浓缩使溶液体积减少至10mL,经过冷却、脱色得到1.46g产品。
(1)图1中仪器A的名称为___________ ,仪器B是冷凝管,进出水的方向为___________ (填“下进上出”“上进下出”),搅拌磁子的作用是___________ 。
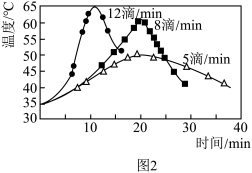
(2)“氧化”过程中,三颈烧瓶中浊液温度逐渐升高,说明该反应是___________ (填“吸热反应”或“放热反应”);在环己醇不同滴速下,浊液温度随滴加时间变化曲线如图2,为减少副反应发生及安全角度考虑,应选择的滴速为___________ 滴/min。
(3)“氧化”后,用玻璃棒蘸取一滴浊液X点在滤纸上,在黑色圆点周围出现紫色环。该现象说明___________ ;向滤液Y中加入适量的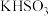 ,反应的离子方程式为
,反应的离子方程式为___________ ,若不加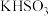 ,在加入浓盐酸制取己二酸的过程中会观察到的现象是
,在加入浓盐酸制取己二酸的过程中会观察到的现象是___________ 。
(4)环己醇的转化率为___________ (保留4位有效数字)。
 ,M=
,M= ,
, )为原料制取己二酸[
)为原料制取己二酸[ ,M=
,M= ]
]I.实验原理:3
 +8KMnO4
+8KMnO4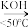 3KOOC(CH2)4COOK+8MnO2↓+2KOH+5H2O
3KOOC(CH2)4COOK+8MnO2↓+2KOH+5H2OII.实验步骤:向250mL三颈烧瓶中加入搅拌磁子、50mL1.0%的KOH溶液和9.0g高锰酸钾,按图1所示安装装置,控制滴速并维持温度在45℃左右,共滴加环己醇2.0mL,滴加结束时需启动加热装置加热一段时间,得到浊液X。趁热过滤分离出
 ,再向滤液Y中加入约4mL浓盐酸,使溶液呈酸性,加热浓缩使溶液体积减少至10mL,经过冷却、脱色得到1.46g产品。
,再向滤液Y中加入约4mL浓盐酸,使溶液呈酸性,加热浓缩使溶液体积减少至10mL,经过冷却、脱色得到1.46g产品。
(1)图1中仪器A的名称为
(2)“氧化”过程中,三颈烧瓶中浊液温度逐渐升高,说明该反应是

(3)“氧化”后,用玻璃棒蘸取一滴浊液X点在滤纸上,在黑色圆点周围出现紫色环。该现象说明
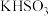 ,反应的离子方程式为
,反应的离子方程式为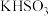 ,在加入浓盐酸制取己二酸的过程中会观察到的现象是
,在加入浓盐酸制取己二酸的过程中会观察到的现象是(4)环己醇的转化率为
您最近半年使用:0次
名校
解题方法
7 . 下列说法正确的是
A.反应N2+3Mg Mg3N2不属于氮的固定,工业合成氨的过程是固氮的过程 Mg3N2不属于氮的固定,工业合成氨的过程是固氮的过程 |
B.标准状况下,22.4升SO3中含有的分子数为 |
| C.2mol NO和1 molO2充分反应后,NO2分子数小于2NA |
| D.用饱和Na2SO3溶液可除去SO2中含有的HCl杂质 |
您最近半年使用:0次
名校
8 . 能正确表示下列反应的离子方程式是
A.用Na2SO3溶液吸收少量Cl2:3 +Cl2+H2O=2 +Cl2+H2O=2 +2Cl-+ +2Cl-+ |
B.NaOH溶液与过量H2C2O4溶液反应:H2C2O4+2OH-= +2H2O +2H2O |
C.电解MgCl2水溶液:2Cl-+2H2O 2OH-+Cl2↑+H2↑ 2OH-+Cl2↑+H2↑ |
D.(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应: +Ba2+=BaSO4↓ +Ba2+=BaSO4↓ |
您最近半年使用:0次
2023-08-28更新
|
224次组卷
|
2卷引用:辽宁省沈阳市第二中学2023-2024学年高三上学期开学暑假阶段验收化学测试题
9 . 溴、碘主要存在于海水里,有“海洋元素”的美称。我国海带产量位居世界第一,海带除供食用外,还可大量用于制碘。从海带中提取碘单质的工艺流程如图。请回答下列问题:
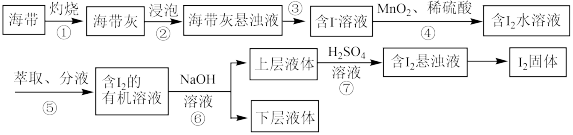
(1)溴、碘均为第ⅦA族元素,位于元素周期表前五周期的第ⅦA族元素对应的最简单氢化物中沸点最高的是_____ (填氢化物的化学式),位于元素周期表前五周期的第ⅦA族元素对应的单质的氧化性由强到弱的顺序为_____ (填化学式), 的空间结构为
的空间结构为_____ 。
(2)步骤④发生反应的离子方程式为_____ (已知: 转化为
转化为 ),此步骤中“
),此步骤中“ 、稀硫酸”可用
、稀硫酸”可用_____ (填标号)代替。
A. B.
B. 、稀硫酸 C.
、稀硫酸 C.
(3)步骤⑤所用的仪器主要是分液漏斗(如图所示)。

“萃取、分液”的具体操作如下:
a.把20mL碘水与5mL萃取剂加入分液漏斗中,并盖好玻璃塞;
b.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
c.把盛有溶液的分液漏斗放在铁架台的铁圈中,静置、分层。
d.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
e.旋开活塞,用烧杯接收下层溶液,从分液漏斗上口倒出上层溶液。
步骤⑥使用的是反萃取法,目的是富集碘元素,利用空气吹出法从海水中提取溴时若采用酸液吸收法,可选用_____ 吸收含溴单质的空气来达到富集溴元素的目的。

(1)溴、碘均为第ⅦA族元素,位于元素周期表前五周期的第ⅦA族元素对应的最简单氢化物中沸点最高的是
 的空间结构为
的空间结构为(2)步骤④发生反应的离子方程式为
 转化为
转化为 ),此步骤中“
),此步骤中“ 、稀硫酸”可用
、稀硫酸”可用A.
 B.
B. 、稀硫酸 C.
、稀硫酸 C.
(3)步骤⑤所用的仪器主要是分液漏斗(如图所示)。

“萃取、分液”的具体操作如下:
a.把20mL碘水与5mL萃取剂加入分液漏斗中,并盖好玻璃塞;
b.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
c.把盛有溶液的分液漏斗放在铁架台的铁圈中,静置、分层。
d.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
e.旋开活塞,用烧杯接收下层溶液,从分液漏斗上口倒出上层溶液。
步骤⑥使用的是反萃取法,目的是富集碘元素,利用空气吹出法从海水中提取溴时若采用酸液吸收法,可选用
您最近半年使用:0次
解题方法
10 . 已知 与足量的
与足量的 硫酸溶液混合微热,产生下列现象:①有红色固体生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法合理的是
硫酸溶液混合微热,产生下列现象:①有红色固体生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法合理的是
 与足量的
与足量的 硫酸溶液混合微热,产生下列现象:①有红色固体生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法合理的是
硫酸溶液混合微热,产生下列现象:①有红色固体生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法合理的是A. 中硫元素被还原 中硫元素被还原 |
B.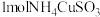 完全反应,转移 完全反应,转移 电子 电子 |
| C.该反应中硫酸既体现了酸性又体现了氧化性 |
| D.刺激性气味的气体是二氧化硫和氨气 |
您最近半年使用:0次



