1 . Ⅰ.某小组利用数字化实验模拟制备Fe(OH)2并探究其相关性质。
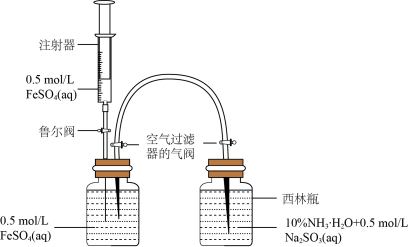
(1)模拟制备Fe(OH)2装置如图:打开右瓶上方空气过滤器的气阀(平衡压强,便于FeSO4溶液能够进入右瓶);然后,依次打开鲁尔阀、推动注射器,将注射器中的FeSO4溶液加入左瓶的溶液中,促使左瓶中的FeSO4溶液流入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、关闭右瓶上方的空气过滤器的气阀、打开左瓶上方的空气过滤器的气阀。实验证明制备Fe(OH)2最佳pH是6~8,氨水代替NaOH溶液效果更好的原因是_____ ,Na2SO3的作用是_____ 。
(2)探究原材料FeSO4的相关性质。向50mL蒸馏水中加入FeSO4·7H2O晶体搅拌以加快溶解,用溶解氧传感器测定液体中溶解氧浓度随时间的变化, 点时加入NaOH溶液所得曲线如图。
点时加入NaOH溶液所得曲线如图。

对比ab、bc段溶解氧的消耗速率,可以得出什么结论_____ 。
(3)已知:在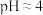 时溶液中,
时溶液中, 被氧化成
被氧化成 的过程中会产生
的过程中会产生 ,且
,且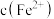 降低量大于
降低量大于 增加量,
增加量, 几乎不变,用总离子方程式说明原因
几乎不变,用总离子方程式说明原因_____ ,检验反应后的溶液中是否存在 ,可以选择的试剂是
,可以选择的试剂是_____ 。
A.NaOH溶液 B.K3[Fe(CN)6] C.KSCN D.KMnO4
Ⅱ.
(4)用氢氧化钠固体配制实验所需的NaOH溶液,下列图示对应的操作规范的是_____
(5)用NaOH固体配制实验所需的NaOH溶液时,下列操作会导致所配溶液浓度偏高的是_____ 。
A.未冷却至室温就定容
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线,并将多余溶液吸出
E.称量NaOH时用了生锈的砝码
(1)模拟制备Fe(OH)2装置如图:打开右瓶上方空气过滤器的气阀(平衡压强,便于FeSO4溶液能够进入右瓶);然后,依次打开鲁尔阀、推动注射器,将注射器中的FeSO4溶液加入左瓶的溶液中,促使左瓶中的FeSO4溶液流入右瓶;当右瓶中明显有白色沉淀生成时,停止加液,依次关闭鲁尔阀、关闭右瓶上方的空气过滤器的气阀、打开左瓶上方的空气过滤器的气阀。实验证明制备Fe(OH)2最佳pH是6~8,氨水代替NaOH溶液效果更好的原因是

(2)探究原材料FeSO4的相关性质。向50mL蒸馏水中加入FeSO4·7H2O晶体搅拌以加快溶解,用溶解氧传感器测定液体中溶解氧浓度随时间的变化,
 点时加入NaOH溶液所得曲线如图。
点时加入NaOH溶液所得曲线如图。
对比ab、bc段溶解氧的消耗速率,可以得出什么结论
(3)已知:在
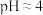 时溶液中,
时溶液中, 被氧化成
被氧化成 的过程中会产生
的过程中会产生 ,且
,且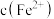 降低量大于
降低量大于 增加量,
增加量, 几乎不变,用总离子方程式说明原因
几乎不变,用总离子方程式说明原因 ,可以选择的试剂是
,可以选择的试剂是A.NaOH溶液 B.K3[Fe(CN)6] C.KSCN D.KMnO4
Ⅱ.
(4)用氢氧化钠固体配制实验所需的NaOH溶液,下列图示对应的操作规范的是_____
 |  | 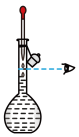 | 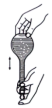 |
| A.称量 | B.转移 | C、定容 | D、摇匀 |
| A.A | B.B | C.C | D.D |
(5)用NaOH固体配制实验所需的NaOH溶液时,下列操作会导致所配溶液浓度偏高的是
A.未冷却至室温就定容
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线,并将多余溶液吸出
E.称量NaOH时用了生锈的砝码
您最近半年使用:0次
2 . 实验室制备SO2并探究SO2的性质,利用如图装置进行实验。

回答下列问题:
(1)盛装浓硫酸的仪器名称为________ ,装置A中的化学方程式为________ 。
(2)若试剂a为蒸馏水,则装置B中反应的化学方程式为________ 。
(3)若试剂a为BaCl2溶液,则B中________ (填“能”或“不能”)观察到有白色沉淀生成,请说明原因: _______ 。
(4)若试剂a为AgNO3溶液,装置B中观察到白色沉淀。分析装置B中沉淀的成分,提出白色沉淀中可能含有Ag2SO3或Ag2SO4或二者混合物。
①请设计实验检验白色沉淀中是否含有Ag2SO3:________ ;
②推测含Ag2SO4的原因是_______ 。

回答下列问题:
(1)盛装浓硫酸的仪器名称为
(2)若试剂a为蒸馏水,则装置B中反应的化学方程式为
(3)若试剂a为BaCl2溶液,则B中
(4)若试剂a为AgNO3溶液,装置B中观察到白色沉淀。分析装置B中沉淀的成分,提出白色沉淀中可能含有Ag2SO3或Ag2SO4或二者混合物。
①请设计实验检验白色沉淀中是否含有Ag2SO3:
②推测含Ag2SO4的原因是
您最近半年使用:0次
名校
解题方法
3 . 下列的各组离子在酸性溶液中能大量共存的是
A.Na+、Ca2+、 、ClO- 、ClO- | B.Ca2+、K+、Cl-、 |
C.Al3+、K+、OH-、 | D.Na+、Ca2+、 、Cl- 、Cl- |
您最近半年使用:0次
2024-02-16更新
|
154次组卷
|
2卷引用:江西省景德镇市乐平市第三中学2023-2024学年高一下学期3月月考化学试题
名校
4 . 下列溶液中,能大量共存的离子组是
A.含有 的溶液中: 的溶液中: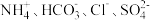 |
B.加入足量 的溶液中: 的溶液中: |
C.在透明的溶液中: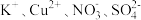 |
D.强碱性溶液中: |
您最近半年使用:0次
2024-01-07更新
|
163次组卷
|
3卷引用:江西省南昌市第十九中学2023-2024学年高一下学期3月月考化学试题
江西省南昌市第十九中学2023-2024学年高一下学期3月月考化学试题重庆市第一中学校2023-2024学年高一上学期期中(半期)考试化学试卷(已下线)期中测试卷一【测试范围:第五、六章】-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)
名校
5 . 实验室模拟“镁法工业烟气脱硫”并制备MgSO4∙H2O,其实验过程可表示如下:

(1)在搅拌下向氧化镁浆料[主要成分为Mg(OH)2]中匀速缓慢通入SO2气体,生成 。
。
①“吸收”过程中,发生的主要反应的化学方程式为___________ ;
②64gSO2在标准状况下的体积约为___________ L;
③NaOH溶液也可以用于捕集SO2,配制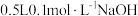 溶液,需NaOH
溶液,需NaOH___________ g;
(2)在催化剂作用下MgSO3被O2氧化为MgSO4。“氧化”过程若转移1mole⁻,则消耗标准状况下O2的体积约为___________ L;
(3)制取MgSO4∙H2O晶体。将氧化后溶液蒸发浓缩、降温至室温结晶,___________ (填写操作步骤),洗涤,干燥,制得MgSO4∙H2O晶体;
(4)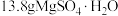 中所含Mg2+的物质的量为
中所含Mg2+的物质的量为___________ mol。

(1)在搅拌下向氧化镁浆料[主要成分为Mg(OH)2]中匀速缓慢通入SO2气体,生成
 。
。①“吸收”过程中,发生的主要反应的化学方程式为
②64gSO2在标准状况下的体积约为
③NaOH溶液也可以用于捕集SO2,配制
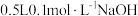 溶液,需NaOH
溶液,需NaOH(2)在催化剂作用下MgSO3被O2氧化为MgSO4。“氧化”过程若转移1mole⁻,则消耗标准状况下O2的体积约为
(3)制取MgSO4∙H2O晶体。将氧化后溶液蒸发浓缩、降温至室温结晶,
(4)
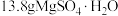 中所含Mg2+的物质的量为
中所含Mg2+的物质的量为
您最近半年使用:0次
2023-11-09更新
|
167次组卷
|
2卷引用:江西省赣州市全南中学2023-2024学年高一上学期11月期中考试化学试题
名校
解题方法
6 . 为测定Na2CO3与Na2SO3混合物中各组分的含量,设计如下实验方案:
(1)方案一:称取一定质量的样品(30g),置于坩埚中加热至恒重,冷却,称取剩余固体质量为31.6g,计算。①实验中加热至恒重的目的是_______ 。②样品中Na2CO3的质量分数为_______ 。
(2)方案二:以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
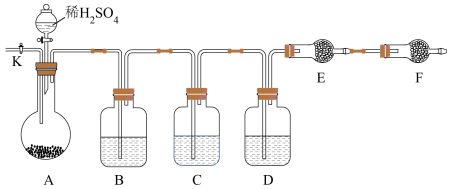
①已知仪器C中装有品红溶液,其作用是_______ ,
②实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.氢氧化钠溶液e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙 请将下列容器中应盛放的试剂序号填入相应空格:B中_______ ,D中_______ ,E中_______ 。
③实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的氮气。这样做的目的是_______ 。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量BaCl2溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗干净的方法是_______ 。
(1)方案一:称取一定质量的样品(30g),置于坩埚中加热至恒重,冷却,称取剩余固体质量为31.6g,计算。①实验中加热至恒重的目的是
(2)方案二:以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)

①已知仪器C中装有品红溶液,其作用是
②实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.氢氧化钠溶液e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙 请将下列容器中应盛放的试剂序号填入相应空格:B中
③实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的氮气。这样做的目的是
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量BaCl2溶液。过滤、洗涤、干燥沉淀,称量固体质量。实验中判断沉淀洗干净的方法是
您最近半年使用:0次
2023-08-22更新
|
74次组卷
|
2卷引用:江西省吉安市万安中学2023-2024学年高二上学期开学考试化学试题
7 . 宏观辨识与微观探析是化学学科核心素养之一、下列方程式符合题意的是
A.向 溶液中滴加少量NaClO溶液: 溶液中滴加少量NaClO溶液: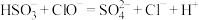 |
B.向溴的四氯化碳溶液中通入丙烯,溶液褪色并分层: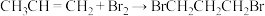 |
C.在 溶液中滴加稀盐酸,溶液变黄色: 溶液中滴加稀盐酸,溶液变黄色: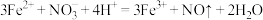 |
D.甲醇( )和乙酸、浓硫酸混合并共热制备乙酸甲酯: )和乙酸、浓硫酸混合并共热制备乙酸甲酯: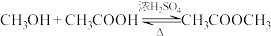 |
您最近半年使用:0次
2023-06-28更新
|
71次组卷
|
3卷引用:江西省重点中学九江六校2022-2023学年高一下学期期末联考化学试题
名校
8 . 下列物质中既能与稀硫酸反应,又能与氢氧化钠溶液反应的是
① ;②
;② ;③
;③ ;④
;④ ;⑤
;⑤ ;⑥
;⑥
①
 ;②
;② ;③
;③ ;④
;④ ;⑤
;⑤ ;⑥
;⑥
| A.①②③④⑤⑥ | B.①②③ | C.①②③⑤ | D.②③⑤ |
您最近半年使用:0次
2023-04-29更新
|
242次组卷
|
2卷引用:江西省宜春市高安市灰埠中学2022-2023学年高一下学期5月期中考试化学试题
名校
9 . 某无色溶液中可能含有 ,且所有离子物质的量浓度相等。向该溶液中滴加少量氯水,溶液仍呈无色(已知碘溶于水呈黄褐色)。下列关于该溶液的判断正确的是
,且所有离子物质的量浓度相等。向该溶液中滴加少量氯水,溶液仍呈无色(已知碘溶于水呈黄褐色)。下列关于该溶液的判断正确的是
 ,且所有离子物质的量浓度相等。向该溶液中滴加少量氯水,溶液仍呈无色(已知碘溶于水呈黄褐色)。下列关于该溶液的判断正确的是
,且所有离子物质的量浓度相等。向该溶液中滴加少量氯水,溶液仍呈无色(已知碘溶于水呈黄褐色)。下列关于该溶液的判断正确的是A.肯定不含 |
B.肯定不含 |
| C.可能含有上述离子中的3种或5种 |
D.若含有 ,肯定同时含有 ,肯定同时含有 |
您最近半年使用:0次
2023-04-23更新
|
248次组卷
|
2卷引用:江西省吉安市井冈山宁冈中学2022-2023学年高一下学期5月期中考试化学试题
名校
10 . 已知固体X由三种前四周期元素组成,其转化关系、实验流程和结果如下:
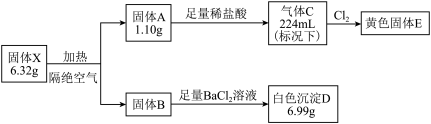
已知:①固体A、固体B的焰色试验均呈紫色
②气体C在标准状况下的密度为1.518 g·L-1。
请回答:
(1)气体C分子的电子式___________ ,白色沉淀D的化学式___________ 。
(2)固体X的化学式___________ 。
(3)固体X受热分解的化学方程式___________ 。
(4)固体X、固体A和碘单质以物质的量1∶1∶1发生反应,生成两种盐,请写出发生反应的化学方程式___________ 。
(5)设计实验证明固体X样品是否已经被氧化:___________ 。

已知:①固体A、固体B的焰色试验均呈紫色
②气体C在标准状况下的密度为1.518 g·L-1。
请回答:
(1)气体C分子的电子式
(2)固体X的化学式
(3)固体X受热分解的化学方程式
(4)固体X、固体A和碘单质以物质的量1∶1∶1发生反应,生成两种盐,请写出发生反应的化学方程式
(5)设计实验证明固体X样品是否已经被氧化:
您最近半年使用:0次
2023-04-21更新
|
159次组卷
|
2卷引用:江西省安福中学2022-2023学年高一下学期5月期中考试化学试题



