名校
解题方法
1 . 根据下列实验操作及现象所得结论正确的是
| 选项 | 实验操作及现象 | 结论 |
| A | 向少量酸性 溶液中滴入 溶液中滴入 溶液,溶液褪色 溶液,溶液褪色 | +4价硫具有还原性 |
| B | 将红色鲜花置于盛有干燥 的集气瓶中,鲜花褪色 的集气瓶中,鲜花褪色 |  具有漂白性 具有漂白性 |
| C | 将集满 的试管倒置于水中,水柱上升,但不能充满试管 的试管倒置于水中,水柱上升,但不能充满试管 |  微溶于水 微溶于水 |
| D | 在水玻璃中滴加稀盐酸,出现白色胶状浑浊 | 非金属性: |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
2 . 下列各组离子,在强碱性溶液中可以大量共存的是
A.K+、Na+、 、Cl- 、Cl- | B.Na+、Ba2+、 、 、 |
C. 、K+、Cl-、 、K+、Cl-、 | D.K+、Na+、ClO-、S2- |
您最近半年使用:0次
名校
解题方法
3 . 下列的各组离子在酸性溶液中能大量共存的是
A.Na+、Ca2+、 、ClO- 、ClO- | B.Ca2+、K+、Cl-、 |
C.Al3+、K+、OH-、 | D.Na+、Ca2+、 、Cl- 、Cl- |
您最近半年使用:0次
2024-02-16更新
|
154次组卷
|
2卷引用:海南省农垦中学2023-2024学年高一上学期期末考试化学试题(重点班)
解题方法
4 . 下列反应的离子方程式书写正确的是
A.用稀硝酸溶解FeO: |
B.将浓盐酸加入氨水中: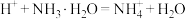 |
C.用氯化铁溶液腐蚀铜板上的Cu: |
D.用 溶液除去实验中残余的 溶液除去实验中残余的 : :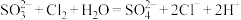 |
您最近半年使用:0次
5 . 实验室以浓硫酸、铜与NaOH溶液为原料制取少量NaHSO3并探究其性质,已知CuCl为白色难溶于水的化合物。
I.制备NaHSO3(装置如图所示)。

(1)仪器a的名称是____ 。
(2)装置丙的作用是____ 。
II.探究:NaHSO3与Cu2+的反应,设计实验:向2mL1mol·L-1NaHSO3溶液中加入2mL1mol·L-1CuSO4溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份。
①第一份加入适量Na2SO4固体,瞬间无明显变化,30s时也无明显变化。
②另一份加入适量NaCl固体,瞬间无明显变化,30s时有无色气体和白色沉淀生成,上层溶液颜色变浅。
(3)推测实验②产生的无色气体为SO2,用新制的氯水检验该无色气体,可观察到淡黄绿色消失,滴加BaCl2溶液有白色沉淀生成。写出SO2与氯气反应的离子方程式:____ 。
(4)对实验II产生SO2的原因进行分析,提出两种假设:
假设1:Cu2+水解使溶液中c(H+)增大。
假设2:Cl-存在时,Cu2+与HSO 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设1不合理,实验证据是____ 。
②实验证实假设2合理,实验II中发生反应的离子方程式有____ 和H++HSO =SO2↑+H2O。
=SO2↑+H2O。
III.与碘酸盐的反应:向用H2SO4酸化的KIO3溶液中滴加NaHSO3溶液(以及少量淀粉溶液)。实验现象为“无色→蓝色→无色→蓝色→……”的周期性变化,此反应过程分为三步:①IO +3HSO
+3HSO =3SO
=3SO +3H++I-(慢);②IO
+3H++I-(慢);②IO +5I-+6H+=3I2+3H2O(慢);③I2+HSO
+5I-+6H+=3I2+3H2O(慢);③I2+HSO +H2O=2I-+SO
+H2O=2I-+SO +3H+(快)。
+3H+(快)。
(5)请解释出现该实验现象可能的原因:____ 。
IV.NaHSO3固体的纯度测定:称取wgNaHSO3固体溶于水配成100mL溶液,取25.00mL已配好的溶液置于锥形瓶中,用0.1000mol·L-1的酸性KMnO4溶液进行滴定,消耗KMnO4溶液VmL。(已知:2MnO +5HSO
+5HSO +H+=2Mn2++5SO
+H+=2Mn2++5SO +3H2O)
+3H2O)
(6)滴定终点的颜色变化为____ ,NaHSO3固体的纯度为____ (用含V和w的代数式表示)。
I.制备NaHSO3(装置如图所示)。

(1)仪器a的名称是
(2)装置丙的作用是
II.探究:NaHSO3与Cu2+的反应,设计实验:向2mL1mol·L-1NaHSO3溶液中加入2mL1mol·L-1CuSO4溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份。
①第一份加入适量Na2SO4固体,瞬间无明显变化,30s时也无明显变化。
②另一份加入适量NaCl固体,瞬间无明显变化,30s时有无色气体和白色沉淀生成,上层溶液颜色变浅。
(3)推测实验②产生的无色气体为SO2,用新制的氯水检验该无色气体,可观察到淡黄绿色消失,滴加BaCl2溶液有白色沉淀生成。写出SO2与氯气反应的离子方程式:
(4)对实验II产生SO2的原因进行分析,提出两种假设:
假设1:Cu2+水解使溶液中c(H+)增大。
假设2:Cl-存在时,Cu2+与HSO
 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。①假设1不合理,实验证据是
②实验证实假设2合理,实验II中发生反应的离子方程式有
 =SO2↑+H2O。
=SO2↑+H2O。III.与碘酸盐的反应:向用H2SO4酸化的KIO3溶液中滴加NaHSO3溶液(以及少量淀粉溶液)。实验现象为“无色→蓝色→无色→蓝色→……”的周期性变化,此反应过程分为三步:①IO
 +3HSO
+3HSO =3SO
=3SO +3H++I-(慢);②IO
+3H++I-(慢);②IO +5I-+6H+=3I2+3H2O(慢);③I2+HSO
+5I-+6H+=3I2+3H2O(慢);③I2+HSO +H2O=2I-+SO
+H2O=2I-+SO +3H+(快)。
+3H+(快)。(5)请解释出现该实验现象可能的原因:
IV.NaHSO3固体的纯度测定:称取wgNaHSO3固体溶于水配成100mL溶液,取25.00mL已配好的溶液置于锥形瓶中,用0.1000mol·L-1的酸性KMnO4溶液进行滴定,消耗KMnO4溶液VmL。(已知:2MnO
 +5HSO
+5HSO +H+=2Mn2++5SO
+H+=2Mn2++5SO +3H2O)
+3H2O)(6)滴定终点的颜色变化为
您最近半年使用:0次
6 . 随着电动汽车的大量使用,废旧锂电池的再利用成为科技工作者研究的重要课题。某化工厂从废旧锂电池正极材料(主要成分为 、炭黑及铝片)中回收锂、铝、钴的流程如图所示。
、炭黑及铝片)中回收锂、铝、钴的流程如图所示。
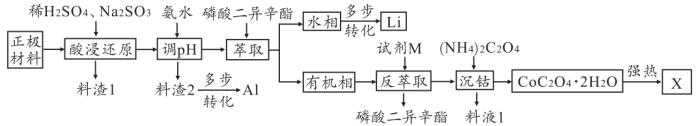
(1)在“酸浸还原”时需对正极材料进行研磨粉碎等预处理,该操作的目的是_______ ;“料渣1”的主要成分是_______ (填名称)。
(2)“酸浸还原”中, (难溶于水)在
(难溶于水)在 的作用下转化为
的作用下转化为 和
和 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。
(3)“料渣2”经过加热分解、电解可制得 ,写出该过程发生反应的化学方程式:
,写出该过程发生反应的化学方程式:_______ 、_______ 。
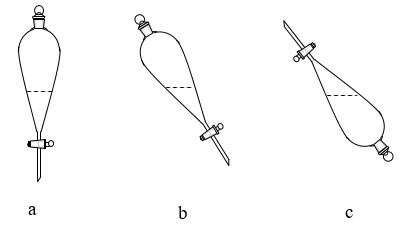
(4)萃取剂选择磷酸二异辛酯,是因为其具有两种物理性质:_______ ;_______ 。实验室进行萃取操作时,需要不时打开分液漏斗活塞放气,图中正确的放气图示是_______ (填标号)。
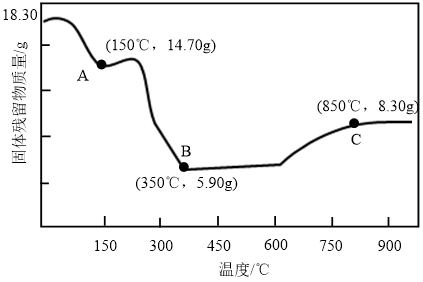
(5) 热分解的质量变化过程如图所示,其中
热分解的质量变化过程如图所示,其中 之前是隔绝空气加热,
之前是隔绝空气加热, 之后是在空气中加热,A、B、C三点时的产物均为纯净物。用化学方程式表示从A点到B点的物质转化:
之后是在空气中加热,A、B、C三点时的产物均为纯净物。用化学方程式表示从A点到B点的物质转化:_______ ,C点时产物的化学式是_______ 。
 、炭黑及铝片)中回收锂、铝、钴的流程如图所示。
、炭黑及铝片)中回收锂、铝、钴的流程如图所示。
(1)在“酸浸还原”时需对正极材料进行研磨粉碎等预处理,该操作的目的是
(2)“酸浸还原”中,
 (难溶于水)在
(难溶于水)在 的作用下转化为
的作用下转化为 和
和 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(3)“料渣2”经过加热分解、电解可制得
 ,写出该过程发生反应的化学方程式:
,写出该过程发生反应的化学方程式:(4)萃取剂选择磷酸二异辛酯,是因为其具有两种物理性质:

(5)
 热分解的质量变化过程如图所示,其中
热分解的质量变化过程如图所示,其中 之前是隔绝空气加热,
之前是隔绝空气加热, 之后是在空气中加热,A、B、C三点时的产物均为纯净物。用化学方程式表示从A点到B点的物质转化:
之后是在空气中加热,A、B、C三点时的产物均为纯净物。用化学方程式表示从A点到B点的物质转化:
您最近半年使用:0次
2021-11-08更新
|
392次组卷
|
3卷引用:2021年海南高考化学试题变式题11-19
7 . 物质的类别和核心元素的化合价是研究物质性质的两个重要维度。右图为硫及其部分 化合物的“价类二维图'',下列说法正确的是
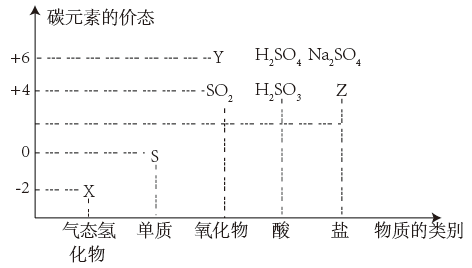

| A.S与O2在点燃下一步反应生成Y | B.Z参加氧化还原反应时只作还原剂 |
| C.X、Y属于非电解质 | D.X的水溶液在空气中放置,易被氧化 |
您最近半年使用:0次
2021-06-15更新
|
403次组卷
|
4卷引用:海南省屯昌县2023届高三二模统考(A)化学试题
海南省屯昌县2023届高三二模统考(A)化学试题福建省莆田第二中学2019~2020学年高一下学期4月线上月考化学试题(已下线)第一次月考卷?-2024年高考化学一轮复习考点通关卷(新高考通用)新疆阿克苏市实验中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
8 . 下列反应中,一定有白色沉淀的是:①向久置的Na2SO3溶液中加入BaCl2溶液,再加入稀盐酸;②将SO2气体通入CaCl2溶液;③向H2SO3溶液中通入Cl2,再滴加BaCl2和稀盐酸;④向H2SO3溶液中加入NaOH溶液后再加入BaCl2溶液
| A.①③④ | B.①④ | C.①②③④ | D.②③④ |
您最近半年使用:0次
2021-04-18更新
|
160次组卷
|
4卷引用:海南省北京师范大学海口附属学校2020-2021学年高一下学期月考化学试题
名校
解题方法
9 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 将一块用砂纸打磨过的铝条放入试管,再加入98%浓硫酸3mL,铝条表面无明显现象 | 铝与浓硫酸常温下不反应 |
| B | 向试管中加入3mL稀KMnO4酸性溶液,再通入SO2气体,紫红色褪去 | SO2具有漂白性 |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
| D | 将溶液X与稀盐酸反应产生的气体通入品红溶液中,品红溶液褪色 | 溶液X中一定含有SO |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2021-03-16更新
|
1358次组卷
|
5卷引用:海南省北京师范大学海口附属学校2020-2021学年高一下学期月考化学试题
名校
解题方法
10 . 25℃时某溶液中由水电离出的c(OH-) = 1× 10-13 mol/L,则该溶液中一定不能大量共存的离子组是( )
A. 、Fe3+、Cl- 、Fe3+、Cl- | B. 、 、 、K+、 、K+、 |
C. 、K+、 、K+、 -、 -、 | D.Na+、 、 、 |
您最近半年使用:0次



