名校
解题方法
1 . 某兴趣小组以海藻灰(主要成分是 )为原料进行
)为原料进行 的制备实验。具体步骤如下:将海菜灰浸泡加热过滤后,得到
的制备实验。具体步骤如下:将海菜灰浸泡加热过滤后,得到 溶液,将适量
溶液,将适量 固体溶于
固体溶于 溶液,再将
溶液,再将 饱和溶液滴入上述溶液中,生成白色
饱和溶液滴入上述溶液中,生成白色 ,向白色沉淀中边搅拌边滴入适量浓硝酸得
,向白色沉淀中边搅拌边滴入适量浓硝酸得 。下列有关反应的离子方程式正确的是
。下列有关反应的离子方程式正确的是
 )为原料进行
)为原料进行 的制备实验。具体步骤如下:将海菜灰浸泡加热过滤后,得到
的制备实验。具体步骤如下:将海菜灰浸泡加热过滤后,得到 溶液,将适量
溶液,将适量 固体溶于
固体溶于 溶液,再将
溶液,再将 饱和溶液滴入上述溶液中,生成白色
饱和溶液滴入上述溶液中,生成白色 ,向白色沉淀中边搅拌边滴入适量浓硝酸得
,向白色沉淀中边搅拌边滴入适量浓硝酸得 。下列有关反应的离子方程式正确的是
。下列有关反应的离子方程式正确的是A.生成白色沉淀的反应为: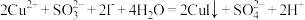 |
B. 固体中加入适量浓硝酸: 固体中加入适量浓硝酸: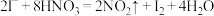 |
C. 中加入过量盐酸: 中加入过量盐酸: |
D. 溶液与氢氧化钡溶液混合: 溶液与氢氧化钡溶液混合: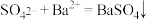 |
您最近半年使用:0次
2024-04-03更新
|
260次组卷
|
2卷引用:河南省漯河市高级中学2023-2024学年高一下学期3月月考化学试题
解题方法
2 . 下列离子方程式书写正确的是
A.向氨水中通入过量二氧化硫: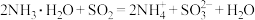 |
B.氢氧化钠溶液与铝反应: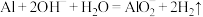 |
C.铁与少量稀硝酸反应: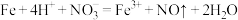 |
D.向亚硫酸钠溶液中通入氯气: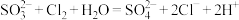 |
您最近半年使用:0次
3 . 碘酸钾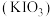 是重要的分析试剂。某研究小组设计实验制备
是重要的分析试剂。某研究小组设计实验制备 ,并进行相关探究。
,并进行相关探究。
I.制备
制备 实验装置如图:
实验装置如图:
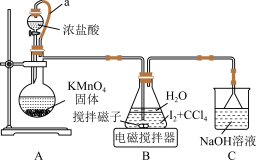
查阅资料: 为白色固体,能溶于水,难溶于四氯化碳;
为白色固体,能溶于水,难溶于四氯化碳; 溶于水,难溶于乙醇。
溶于水,难溶于乙醇。
(1)装置 中
中 可以提高化学反应速率,其原因是
可以提高化学反应速率,其原因是___________ 。
(2)装置 中制取
中制取 的化学反应方程式为
的化学反应方程式为___________ 。
II.制备
(3)从B中分离出 溶液,所需玻璃仪器有烧杯、玻璃棒和
溶液,所需玻璃仪器有烧杯、玻璃棒和___________ 。加入 溶液中和制得
溶液中和制得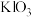 溶液,再加入适量
溶液,再加入适量___________ ,经搅拌、静置、过滤等操作,得到白色固体粗产品,提纯得 晶体。
晶体。
III.实验探究
为探究 溶液和
溶液和 溶液的反应,该小组设计了实验A:向足量的酸性
溶液的反应,该小组设计了实验A:向足量的酸性 溶液滴入数滴淀粉溶液,再加入
溶液滴入数滴淀粉溶液,再加入 溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
(4)溶液变蓝,表明 体现了
体现了___________ 性。
(5)针对T秒前溶液未变蓝,小组做出如下猜想:
i.猜想 秒前未生成
秒前未生成 ,是由于反应的活化能大,影响了反应速率导致的。
,是由于反应的活化能大,影响了反应速率导致的。
ii.猜想b:T秒前生成了 ,但由于存在
,但由于存在 迅速被消耗,反应为
迅速被消耗,反应为___________ (用离子方程式表示)。
(6)请设计实验B,证明猜想b成立:向实验A的蓝色溶液中加入少量的___________ (填化学式)溶液,蓝色迅速消失,后再次变蓝。
 是重要的分析试剂。某研究小组设计实验制备
是重要的分析试剂。某研究小组设计实验制备 ,并进行相关探究。
,并进行相关探究。I.制备

制备
 实验装置如图:
实验装置如图:
查阅资料:
 为白色固体,能溶于水,难溶于四氯化碳;
为白色固体,能溶于水,难溶于四氯化碳; 溶于水,难溶于乙醇。
溶于水,难溶于乙醇。(1)装置
 中
中 可以提高化学反应速率,其原因是
可以提高化学反应速率,其原因是(2)装置
 中制取
中制取 的化学反应方程式为
的化学反应方程式为II.制备

(3)从B中分离出
 溶液,所需玻璃仪器有烧杯、玻璃棒和
溶液,所需玻璃仪器有烧杯、玻璃棒和 溶液中和制得
溶液中和制得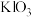 溶液,再加入适量
溶液,再加入适量 晶体。
晶体。III.实验探究
为探究
 溶液和
溶液和 溶液的反应,该小组设计了实验A:向足量的酸性
溶液的反应,该小组设计了实验A:向足量的酸性 溶液滴入数滴淀粉溶液,再加入
溶液滴入数滴淀粉溶液,再加入 溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。
溶液,开始时无明显现象,一段时间(T秒)后,溶液变蓝。(4)溶液变蓝,表明
 体现了
体现了(5)针对T秒前溶液未变蓝,小组做出如下猜想:
i.猜想
 秒前未生成
秒前未生成 ,是由于反应的活化能大,影响了反应速率导致的。
,是由于反应的活化能大,影响了反应速率导致的。ii.猜想b:T秒前生成了
 ,但由于存在
,但由于存在 迅速被消耗,反应为
迅速被消耗,反应为(6)请设计实验B,证明猜想b成立:向实验A的蓝色溶液中加入少量的
您最近半年使用:0次
名校
4 . 在酸性高锰酸钾溶液中,可能大量共存的离子是
A. | B. | C. | D. |
您最近半年使用:0次
名校
解题方法
5 . 下列指定反应的离子方程式错误 的是
A.向氢氧化镁悬浊液中加氯化铵溶液,加热沉淀溶解: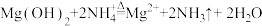 |
B.用Na2CO3溶液处理水垢中的CaSO4: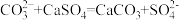 |
C.Na2SO3溶液吸收少量Cl2: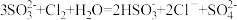 |
D.Mg(HCO3)2溶液与过量NaOH溶液反应: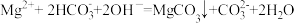 |
您最近半年使用:0次
名校
解题方法
6 . 常温下,在下列透明溶液中可能大量共存的离子组是
A.Fe2+、Mg2+、 、 、 | B.Fe3+、K+、Cl-、 |
C.Na+、 、OH-、 、OH-、 | D.H+、K+、S2-、 |
您最近半年使用:0次
7 . 化学实验小组在实验室中利用某化工厂排出的废渣[主要成分为BaCO3、Ba(FeO2)2、BaSO3]制备Ba(NO3)2晶体的流程如图所示。
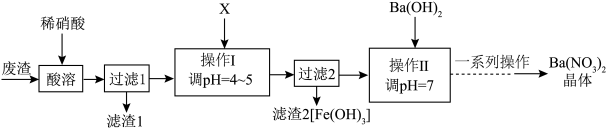
已知:Ba(NO3)2的溶解度受温度影响较大。下列说法错误的是

已知:Ba(NO3)2的溶解度受温度影响较大。下列说法错误的是
| A.酸溶时,Ba(FeO2)2、BaSO3都能与稀硝酸发生氧化还原反应 |
| B.滤渣1的主要成分是BaSO4 |
| C.试剂X可选择BaCO3 |
| D.流程中“一系列操作”有蒸发浓缩、冷却结晶、过滤、洗涤、干燥 |
您最近半年使用:0次
名校
解题方法
8 . 下列类比或推理合理的是
| 选项 | 已知 | 方法 | 结论 |
| A | 碘遇淀粉显蓝色 | 类比 | 溴单质遇淀粉变蓝色 |
| B |  在空气中易变质 在空气中易变质 | 类比 |  在空气中也易变质 在空气中也易变质 |
| C | HCl是强酸 | 推理 | HF是强酸 |
| D |  有还原性 有还原性 | 推理 |  有强还原性 有强还原性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-10-26更新
|
583次组卷
|
7卷引用:河南省豫北名校2024届高三毕业班上学期一轮复习联考(二)化学试题
名校
9 . 取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(浓度均为0.1mol/L),反应现象不同的是
| 选项 | 试剂① | 试剂② |
| A | 碳酸氢钠溶液 | 澄清石灰水 |
| B | 亚硫酸钠溶液 | 氯化钡溶液 |
| C | 高锰酸钾溶液 | 草酸溶液 |
| D | 硫酸亚铁 | 铁氰化钾溶液 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
10 . 磷酸亚铁锂(LiFePO4)能可逆地嵌入、脱出锂,使其作为锂离子电池的正极材料的研究及应用得到广泛关注。通过水热法制备磷酸亚铁锂的一种方法如下(装置如图所示):
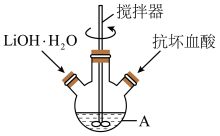
Ⅰ.在A中加入40 mL蒸馏水、0.015 mol H3PO4和0.01 mol FeSO4·7H2O,用搅拌器搅拌溶解后,缓慢加入0.015mol LiOH·H2O,继续搅拌。
Ⅱ.向反应液中加入少量抗坏血酸(即维生素C),继续搅拌5 min。
Ⅲ.快速将反应液装入反应釜中,保持170℃恒温5 h。
Ⅳ.冷却至室温,过滤。
Ⅴ.用蒸馏水洗涤沉淀。
Ⅵ.干燥,得到磷酸亚铁锂产品。
回答下列问题
(1)装置图中仪器A的名称是_______ 。
(2)根据上述实验药品的用量,仪器A的最适宜规格为_______(填标号)。
(3)步骤Ⅱ中,抗坏血酸的作用是_______ 。也可以用Na2SO3代替抗坏血酸,其原理是_______ (用离子方程式表示)。
(4)步骤Ⅴ检验LiFePO4是否洗涤干净的方法是_______
(5)干燥后称量,产品的质量是1.2 g,本实验的产率为_______ %(保留1位小数)。

Ⅰ.在A中加入40 mL蒸馏水、0.015 mol H3PO4和0.01 mol FeSO4·7H2O,用搅拌器搅拌溶解后,缓慢加入0.015mol LiOH·H2O,继续搅拌。
Ⅱ.向反应液中加入少量抗坏血酸(即维生素C),继续搅拌5 min。
Ⅲ.快速将反应液装入反应釜中,保持170℃恒温5 h。
Ⅳ.冷却至室温,过滤。
Ⅴ.用蒸馏水洗涤沉淀。
Ⅵ.干燥,得到磷酸亚铁锂产品。
回答下列问题
(1)装置图中仪器A的名称是
(2)根据上述实验药品的用量,仪器A的最适宜规格为_______(填标号)。
| A.100 mL | B.250 mL | C.500 mL | D.1000 mL |
(3)步骤Ⅱ中,抗坏血酸的作用是
(4)步骤Ⅴ检验LiFePO4是否洗涤干净的方法是
(5)干燥后称量,产品的质量是1.2 g,本实验的产率为
您最近半年使用:0次
2023-09-20更新
|
76次组卷
|
2卷引用:河南省中原名校联盟2024届高三上学期9月调研考试化学试题



