名校
解题方法
1 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。
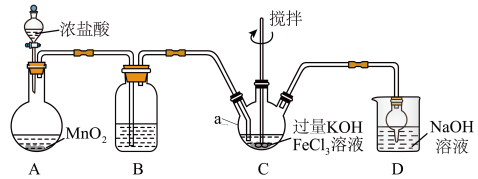
(1)仪器a的名称是______ ,装置B中除杂质所用试剂是______ ,装置D的作用是_____ 。
(2)A中发生反应的化学方程式为______ 。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为_____ ,反应中KOH必须过量的原因是______ 。
(4)写出C中总反应的离子方程式:______ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和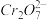 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
(5)根据以上数据,样品中K2FeO4的质量分数为______ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______ (填“偏高”“偏低”或“无影响”)。
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。

(1)仪器a的名称是
(2)A中发生反应的化学方程式为
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(4)写出C中总反应的离子方程式:
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和
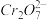 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。(5)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
2023-01-11更新
|
710次组卷
|
8卷引用:2019年四川省绵阳市高三第二次诊断性考试理综化学试题
2019年四川省绵阳市高三第二次诊断性考试理综化学试题2020届高三《新题速递·化学》1月第02期(考点11-13)【全国百强校】安徽省六安市第一中学2020届高三下学期自测(二)化学试题辽宁省实验中学、东北育才学校、鞍山一中、大连八中、大连二十四中五校联考2021-2022学年高三上学期期末联考化学试题(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)天津市静海一中20223-2023学年高三上学期期末定时测验化学试题(已下线)专题十八化学实验综合题解题策略(已下线)实验综合题
2 . 为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸,再进行下列实验,其中结论正确的是
| A.若滴加KSCN溶液,溶液变红,说明铁粉变质 |
| B.若滴加KSCN溶液,溶液未变红,说明铁粉未变质 |
| C.若依次滴加氯水,KSCN溶液,溶液变红,说明铁粉全部变质 |
| D.若滴加KSCN溶液,溶液未变红;再滴加氯水,溶液变红,说明铁粉全部变质 |
您最近一年使用:0次
2022-02-27更新
|
1455次组卷
|
24卷引用:四川省绵阳南山中学2022-2023学年高一上学期期末模拟化学试题
四川省绵阳南山中学2022-2023学年高一上学期期末模拟化学试题四川省江油市太白中学2023-2024学年高一上学期第三次月考化学试题天津市红桥区2020-2021学年高三上学期期中考试化学试题第一节 铁及其化合物 第2课时 铁盐、亚铁盐内蒙古包头市2021-2022学年高一上学期期末考试化学试题辽宁省沈阳市2021-2022学年高一上学期期末质量监测化学试题2广东省化州市第一中学2020-2021学年高一上学期期末考试化学试题北京市北京师范大学第二附属中学2022-2023学年高一上学期12月月考化学试题湖南省株洲世纪星高级中学2022-2023学年高一上学期期末考试化学试题广东省广州中学2022-2023学年高一上学期期末考试化学试题天津市南开中学2022-2023学年高一上学期期末考试化学试题吉林市田家炳高级中学2022-2023学年高一上学期期末考试化学试题内蒙古赤峰市红山区2022-2023学年高一上学期期末质量检测化学试题内蒙古包头市2022-2023学年高一上学期期末考试化学试题内蒙古呼伦贝尔市满洲里市第一中学2022-2023学年高一下学期第一次月考化学试题广东省东莞市南城开心实验学校2022-2023学年高一上学期12月半月考化学试题湖南省长沙市珺琟高级中学2023-2024学年高一上学期第二次月考化学试题 四川省宜宾市第四中学校2023-2024学年高一上学期1月期末化学试题云南省昆明市五华区2023-2024学年高一上学期1月期末化学试题天津市静海区第一中学2023-2024学年高一上学期12月月考化学试题浙江省丽水市三校联考2023-2024学年高一上学期12月月考化学试题湖南省常德石门一中2023-2024年上学期高一年级化学期末考试卷(适用湖南地区))湖南省长沙市长郡中学2023-2024学年高一下学期选科适应性检测化学试卷河南省开封市联考2023-2024学年高一上学期1月期末化学试题
名校
解题方法
3 . 三水合硝酸铜[Cu(NO3)2·3H2O,M=242g·mol-1]是一种重要的无机试剂,常用作搪瓷着色剂,也用于镀铜、制氧化铜及农药等。回答下列问题:
I.三水合硝酸铜[Cu(NO3)2·3H2O]的制备。
实验室常用废铜屑与稀硝酸反应制备硝酸铜溶液,过滤出剩余铜屑,再经蒸发浓缩、冷却结晶、过滤、乙醇洗涤后得到三水合硝酸铜晶体。
(1)制备硝酸铜时发生反应的离子方程式为_____ 。
(2)若废铜屑中含有杂质铁,则检验所得硝酸铜溶液中含有铁元素的方法为_____ 。
II.Cu(NO3)2溶液的配制。
(3)实验室里需要500mL0.1mol·L-1Cu(NO3)2溶液。用三水合硝酸铜[Cu(NO3)2·3H2O]配制该溶液时,下列仪器一定不需要的是_____ (填仪器名称 )。
(4)所需三水合硝酸铜固体的质量为_____ g。
(5)配制过程中,下列操作将导致溶液浓度偏小的是_____(填序号)。
III.三水合硝酸铜[Cu(NO3)2·3H2O]热分解实验。
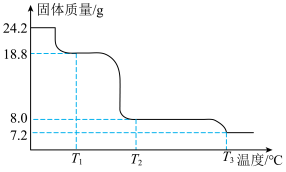
(6)将24.2gCu(NO3)2·3H2O样品置于瓷坩埚中缓慢加热,其热重曲线(样品质量随温度变化的曲线)如图所示。在 过程中有红棕色气体产生,反应的化学方程式为
过程中有红棕色气体产生,反应的化学方程式为_____ 。继续升温至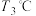 时生成的固体产物为
时生成的固体产物为_____ (填化学式)。
I.三水合硝酸铜[Cu(NO3)2·3H2O]的制备。
实验室常用废铜屑与稀硝酸反应制备硝酸铜溶液,过滤出剩余铜屑,再经蒸发浓缩、冷却结晶、过滤、乙醇洗涤后得到三水合硝酸铜晶体。
(1)制备硝酸铜时发生反应的离子方程式为
(2)若废铜屑中含有杂质铁,则检验所得硝酸铜溶液中含有铁元素的方法为
II.Cu(NO3)2溶液的配制。
(3)实验室里需要500mL0.1mol·L-1Cu(NO3)2溶液。用三水合硝酸铜[Cu(NO3)2·3H2O]配制该溶液时,下列仪器一定不需要的是

(4)所需三水合硝酸铜固体的质量为
(5)配制过程中,下列操作将导致溶液浓度偏小的是_____(填序号)。
| A.加水定容时俯视刻度线 |
| B.容量瓶未干燥处理 |
| C.定容加水时超过刻度线后,立即吸出多余的水 |
| D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
III.三水合硝酸铜[Cu(NO3)2·3H2O]热分解实验。
(6)将24.2gCu(NO3)2·3H2O样品置于瓷坩埚中缓慢加热,其热重曲线(样品质量随温度变化的曲线)如图所示。在
 过程中有红棕色气体产生,反应的化学方程式为
过程中有红棕色气体产生,反应的化学方程式为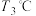 时生成的固体产物为
时生成的固体产物为
您最近一年使用:0次
名校
解题方法
4 . 已知硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O,M=392g/mol](俗称莫尔盐)可溶于水,在100℃~110℃时分解。为探究其化学性质,甲、乙两同学设计了如下实验。
Ⅰ.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验,装置C中可观察到的现象是_______ ,由此可知分解产物中有_______ 。_______ →G。
(3)证明含有SO3的实验现象是_______ ,安全瓶H的作用是_______ 。
Ⅱ.为测定硫酸亚铁铵晶体纯度,称取m g莫尔盐样品,配成500 mL溶液。甲、乙两位同学设计了如下两个实验方案。
(甲)方案一:取20.00 mL硫酸亚铁铵溶液用0.1000mol/L的酸性KMnO4溶液进行三次滴定。
(4)方案一中发生反应的离子方程式为:_______ 。
(5)方案二中判断所加BaCl2溶液已足量的操作及现象为_______ 。
(6)若甲乙两同学实验操作都正确,但方案一的测定结果总是小于方案二,推测可能原因:_______ 。
(7)乙方案测定出硫酸亚铁铵纯度为_______ (列出计算式即可)。
Ⅰ.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验,装置C中可观察到的现象是

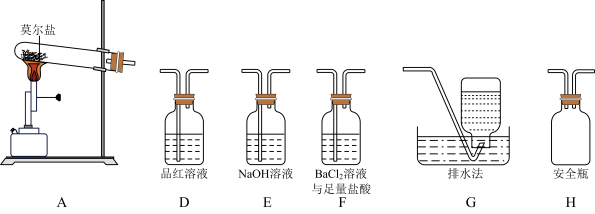
(3)证明含有SO3的实验现象是
Ⅱ.为测定硫酸亚铁铵晶体纯度,称取m g莫尔盐样品,配成500 mL溶液。甲、乙两位同学设计了如下两个实验方案。
(甲)方案一:取20.00 mL硫酸亚铁铵溶液用0.1000mol/L的酸性KMnO4溶液进行三次滴定。
(乙)方案二:
(4)方案一中发生反应的离子方程式为:
(5)方案二中判断所加BaCl2溶液已足量的操作及现象为
(6)若甲乙两同学实验操作都正确,但方案一的测定结果总是小于方案二,推测可能原因:
(7)乙方案测定出硫酸亚铁铵纯度为
您最近一年使用:0次
名校
5 . 有机物种类繁多,广泛存在,在生产和生活中有着重要的应用。
(1)乙炔是有机合成的重要原料之一、实验室制备乙炔的反应方程式为___________ ,制出的乙炔气体应通入___________ 溶液洗气除杂。乙炔可用于合成导电塑料,写出乙炔加聚合成聚乙炔导电塑料的方程式___________ 。
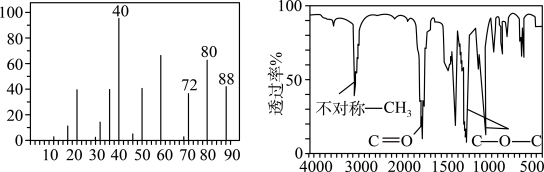
(2)准确称取4.4g某有机物样品X(只含C、H、O三种元素),经充分燃烧后的产物依次通过浓硫酸和碱石灰,二者质量分别增加3.6g和8.8g。又知有机物X的质谱图和红外光谱分别如图所示,则该有机物的分子式为___________ ,结构简式可能为___________ (填序号)。
A.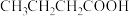 B.
B.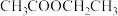 C.
C. D.
D.
(3) 中含有的官能团名称为
中含有的官能团名称为___________ ;该有机物具有多种同分异构体,写出一种同时满足下列条件的同分异构体___________ 。
a.能与FeCl3发生显色反应 b.能与NaOH溶液发生水解反应
c.能发生银镜反应 d.苯环上的一氯代物有两种
(1)乙炔是有机合成的重要原料之一、实验室制备乙炔的反应方程式为
(2)准确称取4.4g某有机物样品X(只含C、H、O三种元素),经充分燃烧后的产物依次通过浓硫酸和碱石灰,二者质量分别增加3.6g和8.8g。又知有机物X的质谱图和红外光谱分别如图所示,则该有机物的分子式为
A.
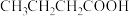 B.
B.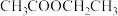 C.
C. D.
D.

(3)
 中含有的官能团名称为
中含有的官能团名称为a.能与FeCl3发生显色反应 b.能与NaOH溶液发生水解反应
c.能发生银镜反应 d.苯环上的一氯代物有两种
您最近一年使用:0次
解题方法
6 . 已知W、X、Y和Z为前20号元素,且原子序数依次增大,W的原子半径在元素周期表中最小, 可以与
可以与 反应生成一种常见的气体。化合物(
反应生成一种常见的气体。化合物( )在
)在 和
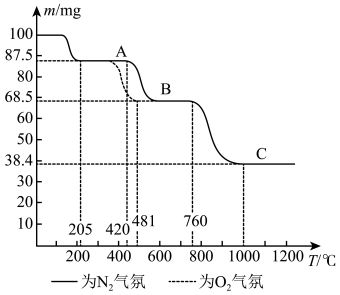
和 气氛中的热重曲线(样品质量随温度变化的曲线)如图所示。下列有关说法错误的是
气氛中的热重曲线(样品质量随温度变化的曲线)如图所示。下列有关说法错误的是
 可以与
可以与 反应生成一种常见的气体。化合物(
反应生成一种常见的气体。化合物( )在
)在 和
和 气氛中的热重曲线(样品质量随温度变化的曲线)如图所示。下列有关说法错误的是
气氛中的热重曲线(样品质量随温度变化的曲线)如图所示。下列有关说法错误的是
| A.原子半径:Z>X>Y>W |
| B.A,B、C是三种不同的盐 |
C.无论是 气氛还是 气氛还是 气氛,A→B阶段均发生了氧化还原反应,但两者的气态产物不同 气氛,A→B阶段均发生了氧化还原反应,但两者的气态产物不同 |
D.在酸性 溶液中加入少量A固体样品时,溶液褪色且有少量气泡产生 溶液中加入少量A固体样品时,溶液褪色且有少量气泡产生 |
您最近一年使用:0次
2022-09-29更新
|
727次组卷
|
4卷引用:2023届四川省绵阳东辰高级中学高三下学期大学预备部三诊模拟考试理综试题
2023届四川省绵阳东辰高级中学高三下学期大学预备部三诊模拟考试理综试题河南省豫北名校普高联考2022-2023学年上学期高三测评(一)化学试题河南省重点高中2023届高三上学期9月联合考试化学试题(已下线)化学(全国乙卷理综卷)-学易金卷:2023年高考第一次模拟考试卷
名校
解题方法
7 . 钠及其化合物的生产、应用,是化工生产与研究的重要组成部分。
(1) 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。回答下列问题:
并检验其纯度的实验流程如图所示。回答下列问题:

①生成 的化学方程式是
的化学方程式是______ 。
② 样品加水溶解的化学方程式为
样品加水溶解的化学方程式为______ ,生成标准状况下33.6 L气体,转移电子数为______ 。
③样液中加入 后产生能使带火星木条复燃的气体,说明
后产生能使带火星木条复燃的气体,说明 与水反应的过程中还生成了
与水反应的过程中还生成了______ (化学式)。
④滤液中加入 溶液产生白色沉淀,说明
溶液产生白色沉淀,说明 样品中含有
样品中含有______ 杂质,生成白色沉淀的离子方程式是______ 。
(2)工业上以侯氏制碱法为基础生产焦亚硫酸钠( ,能溶于水)的工艺流程如图:
,能溶于水)的工艺流程如图:
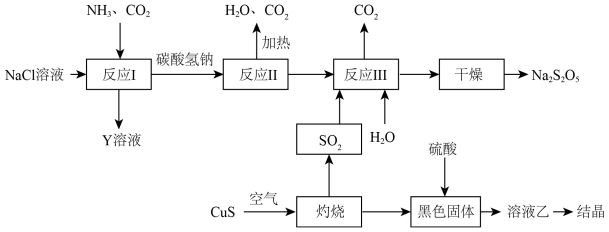
①反应I反应的化学方程式是______ 。
②关于该流程,下列说法正确的是______ (填字母)
a.反应反应I中应先通入 ,再通入
,再通入
b.反应II属于氧化还原反应
c.该流程中, 可以循环使用
可以循环使用
d.溶液乙的结晶产物是硫酸铜晶体
③反应III包含多步反应:
第一步:……
第二步: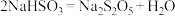
为了减少产品 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为
中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为______ 。
(3)已知 与稀硫酸反应生成
与稀硫酸反应生成 ,其离子方程式为
,其离子方程式为______ 。
(1)
 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。回答下列问题:
并检验其纯度的实验流程如图所示。回答下列问题:
①生成
 的化学方程式是
的化学方程式是②
 样品加水溶解的化学方程式为
样品加水溶解的化学方程式为③样液中加入
 后产生能使带火星木条复燃的气体,说明
后产生能使带火星木条复燃的气体,说明 与水反应的过程中还生成了
与水反应的过程中还生成了④滤液中加入
 溶液产生白色沉淀,说明
溶液产生白色沉淀,说明 样品中含有
样品中含有(2)工业上以侯氏制碱法为基础生产焦亚硫酸钠(
 ,能溶于水)的工艺流程如图:
,能溶于水)的工艺流程如图:
①反应I反应的化学方程式是
②关于该流程,下列说法正确的是
a.反应反应I中应先通入
 ,再通入
,再通入
b.反应II属于氧化还原反应
c.该流程中,
 可以循环使用
可以循环使用d.溶液乙的结晶产物是硫酸铜晶体
③反应III包含多步反应:
第一步:……
第二步:
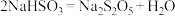
为了减少产品
 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为
中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为(3)已知
 与稀硫酸反应生成
与稀硫酸反应生成 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
2023-02-09更新
|
881次组卷
|
3卷引用:四川省绵阳市东辰学校2023-2024学年高一上学期化学期末复习综合模拟试题
2020高三·全国·专题练习
名校
解题方法
8 . K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]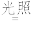 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为___ 。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。

①通入氮气的目的是____ 。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有____ 、___ 。
③为防止倒吸,停止实验时应进行的操作是___ 。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是____ 。
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]
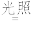 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为(2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。

①通入氮气的目的是
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
③为防止倒吸,停止实验时应进行的操作是
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是
您最近一年使用:0次
2020-12-09更新
|
638次组卷
|
5卷引用:四川省绵阳市南山中学实验学校2022届高三上学学期开学考试化学试题
四川省绵阳市南山中学实验学校2022届高三上学学期开学考试化学试题(已下线)专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测专题9 第一~三单元综合拔高练-高中化学必修第二册苏教版2019四川省泸县第四中学2021-2022学年高三上学期第二次月考理综化学试题(已下线)专题讲座(十)化学实验设计与探究(练) — 2022年高考化学一轮复习讲练测(新教材新高考)
名校
9 . 已知A、B、C、D、E是原子序数依次增大的五种元素,A元素是宇宙大爆炸后最多的元素;B、C、D同周期。B元素的某种同位素原子可用于考古;D原子核外未成对电子有两个。E是第四周期未成对电子最多的元素。请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、D的基态原子的电负性由小到大的顺序为_______ (用元素符号表示)。
(2)B、C、D与A形成的简单化合物键角由大到小的顺序排列:__________ (用化学式表示)。
(3)A2D2分子中D原子的杂化方式为_______ 。C2A4与A2D2在一定条件下反应,生成产物无毒,可参与大气循环。该反应的化学方程式可表示为______________ 。
(4)为测定E的配合物[E(CA3) x(A2D)y]Clz(相对分子质量为262.5)的组成,进行如下实验:称取质量均为2.625 g的样品两份,一份加入过量的NaOH溶液,加热煮沸蒸出所有的CA3,测得CA3的体积为896 mL(标准状况);另一份加入0.2 mol/L AgNO3溶液至恰好反应完全,消耗AgNO3溶液150 mL。完成下列空白:
该配合物的化学式为_______ ,配体中提供孤电子对的原子是_______ ,中心原子化合价_______ 。
(1)元素B、C、D的基态原子的电负性由小到大的顺序为
(2)B、C、D与A形成的简单化合物键角由大到小的顺序排列:
(3)A2D2分子中D原子的杂化方式为
(4)为测定E的配合物[E(CA3) x(A2D)y]Clz(相对分子质量为262.5)的组成,进行如下实验:称取质量均为2.625 g的样品两份,一份加入过量的NaOH溶液,加热煮沸蒸出所有的CA3,测得CA3的体积为896 mL(标准状况);另一份加入0.2 mol/L AgNO3溶液至恰好反应完全,消耗AgNO3溶液150 mL。完成下列空白:
该配合物的化学式为
您最近一年使用:0次
10 . 下列实验的现象与对应结论均正确的是( )
| 选项 | 实验操作 | 现 象 | 结 论 |
| A | 向蔗糖溶液中滴加稀硫酸煮沸,适当冷却后加入银氨溶液 | 无银镜生成 | 蔗糖尚未水解 |
| B | 将铜片和锌片用导线连接并插入稀硫酸中 | 铜片上冒气泡 | 铜片上发生了还原反应 |
| C | 向样品中加入适量浓氢氧化钠,用红色石蕊试纸检测产物 | 红色石蕊试纸变蓝 | 样品中含有铵根 |
| D | 将一小块Na放入无水乙醇中 | 钠浮在液面,产生气泡 | Na能置换出醇羟基中的氢 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



