名校
1 . 下列实验操作、现象和所得出的结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将溶液X与盐酸反应产生的气体通入品红溶液中 | 品红溶液褪色 | 溶液X中一定含有SO |
| B | 将少量碳酸钠溶液滴入足量稀盐酸中 | 有气泡产生 | 非金属性:Cl>C |
| C | 向3 mL KI溶液中滴加几滴溴水,振荡,再滴加 1 mL淀粉溶液 | 溶液显蓝色 | Br2的氧化性比I2强 |
| D | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液 | 溶液变红 | Fe(NO3)2样品已变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-22更新
|
181次组卷
|
2卷引用:四川省南充高级中学2023-2024学年高一下学期3月月考化学试题
2 . 下列有关实验操作,实验现象以及解释或结论都正确的是
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液 | 溶液变成血红色 | Fe(NO3)2变质 |
| B | 向10mL0.1mol/LNa2S溶液中滴加2mL等浓度的ZnSO4溶液,再加入2mL等浓度的CuSO4溶液 | 先产生白色沉淀,后产生黑色沉淀 | Ksp(ZnS)>Ksp(CuS) |
| C | 向淀粉溶液中滴入稀硫酸,水浴加热一段时间后,直接加入少量新制氢氧化铜悬浊液并煮沸 | 生成砖红色沉淀 | 淀粉在酸性条件可水解,产物中有葡萄糖 |
| D | 分别向等物质的量浓度、等体积的KCl和KI溶液中滴加2滴稀的[Ag(NH3)2]OH溶液,充分振荡后 | KCl溶液中无白色沉淀,KI溶液中有黄色沉淀 | Ag+结合微粒的能力I->NH3>Cl- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 某混合溶液中可能含有H+、Na+、K+、NH 、Cl-、SO
、Cl-、SO 、SO
、SO 、CO
、CO ,且溶液中各离子的浓度均相等,取三份样品溶液进行如图所示的实验。
,且溶液中各离子的浓度均相等,取三份样品溶液进行如图所示的实验。

已知:①氨气(NH3)可使湿润的红色石蕊试纸变蓝;
②稀硝酸的还原产物为无色气体NO,遇空气变成红棕色气体NO2。
(1)沉淀A的化学式为_______ ,写出由样品与HNO3、Ba(NO3)2反应生成沉淀A的离子方程式_______ 。
(2)生成沉淀C的离子方程式为_______ 。
(3)生成气体D的离子方程式为_______ 。
(4)通过以上实验可以得出混合物中一定含有的离子有Cl-、Na+、NH 、SO
、SO 及
及_______ ,一定不存在的离子有_______ 。
 、Cl-、SO
、Cl-、SO 、SO
、SO 、CO
、CO ,且溶液中各离子的浓度均相等,取三份样品溶液进行如图所示的实验。
,且溶液中各离子的浓度均相等,取三份样品溶液进行如图所示的实验。
已知:①氨气(NH3)可使湿润的红色石蕊试纸变蓝;
②稀硝酸的还原产物为无色气体NO,遇空气变成红棕色气体NO2。
(1)沉淀A的化学式为
(2)生成沉淀C的离子方程式为
(3)生成气体D的离子方程式为
(4)通过以上实验可以得出混合物中一定含有的离子有Cl-、Na+、NH
 、SO
、SO 及
及
您最近一年使用:0次
名校
解题方法
4 . NiSO4广泛应用于印染、医药、催化、电镀等方面。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4·xH2O的工艺流程如下。 在350℃分解生成
在350℃分解生成 和
和 。
。
Ⅱ.NiSO4·xH2O易溶于水,难溶于乙醇,其水溶液显酸性。
回答下列问题:
(1)“浸渣”的成分有 、
、 外,还含有
外,还含有___________ (写化学式)。
(2)矿渣中部分FeO在空气中焙烧时反应生成 的化学方程式为
的化学方程式为___________ 。
(3)向“浸取液”中加入NaF以除去溶液中 (浓度为
(浓度为 ),当溶液中
),当溶液中 时,除钙率为
时,除钙率为___________ [已知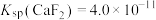 ]。
]。
(4)有机萃取剂(RH)可用于对溶液中的金属离子进行富集与分离,如萃取 的原理为
的原理为 ,萃取剂与溶液的体积比(
,萃取剂与溶液的体积比(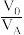 )对溶液中
)对溶液中 、
、 的萃取率影响如图所示,
的萃取率影响如图所示,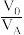 的最佳取值为
的最佳取值为___________ 。在___________ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。 。下列说法正确的是
。下列说法正确的是___________ (填标号)。
A.蒸发浓缩至溶液表面出现晶膜时,停止加热
B.为得到较大NiSO4·xH2O晶体颗粒,宜用冰水快速冷却结晶
C.可通过抽滤提高过滤速度,并鼓入热风干燥,快速得到干燥晶体
D.向冷却结晶后的固液混合物中加入乙醇可提高产率
②NiSO4在一定条件下可被氧化成难溶于水的NiOOH,其在镍镉(Ni-Cd)可充电电池中发生如下反应: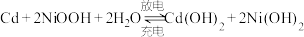 ,充电时阳极反应式为
,充电时阳极反应式为___________ 。
(6)采用热重分析法测定NiSO4·xH2O样品所含结晶水数目。
将样品在900℃下进行煅烧,失重率随时间变化如图所示,A点产物组成为 ,x的值为
,x的值为___________ ;C点产物的化学式为___________ 。

 在350℃分解生成
在350℃分解生成 和
和 。
。Ⅱ.NiSO4·xH2O易溶于水,难溶于乙醇,其水溶液显酸性。
回答下列问题:
(1)“浸渣”的成分有
 、
、 外,还含有
外,还含有(2)矿渣中部分FeO在空气中焙烧时反应生成
 的化学方程式为
的化学方程式为(3)向“浸取液”中加入NaF以除去溶液中
 (浓度为
(浓度为 ),当溶液中
),当溶液中 时,除钙率为
时,除钙率为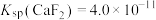 ]。
]。(4)有机萃取剂(RH)可用于对溶液中的金属离子进行富集与分离,如萃取
 的原理为
的原理为 ,萃取剂与溶液的体积比(
,萃取剂与溶液的体积比(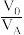 )对溶液中
)对溶液中 、
、 的萃取率影响如图所示,
的萃取率影响如图所示,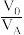 的最佳取值为
的最佳取值为
 。下列说法正确的是
。下列说法正确的是A.蒸发浓缩至溶液表面出现晶膜时,停止加热
B.为得到较大NiSO4·xH2O晶体颗粒,宜用冰水快速冷却结晶
C.可通过抽滤提高过滤速度,并鼓入热风干燥,快速得到干燥晶体
D.向冷却结晶后的固液混合物中加入乙醇可提高产率
②NiSO4在一定条件下可被氧化成难溶于水的NiOOH,其在镍镉(Ni-Cd)可充电电池中发生如下反应:
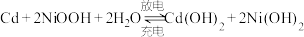 ,充电时阳极反应式为
,充电时阳极反应式为(6)采用热重分析法测定NiSO4·xH2O样品所含结晶水数目。
将样品在900℃下进行煅烧,失重率随时间变化如图所示,A点产物组成为
 ,x的值为
,x的值为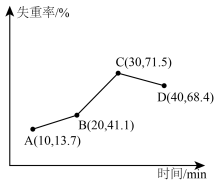
您最近一年使用:0次
名校
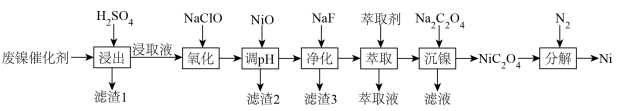
5 . 某催化剂主要含Ni、Ni(OH)2、NiS及少量Zn、Fe、CuO、CaO、SiO2等杂质,从中制备金属Ni的工艺流程如下:
回答下列问题:
(1)为提高废镍催化剂的浸出速率,可采取的措施有_____ (答一条即可)。
(2)反应 的平衡常数K=
的平衡常数K=_____ 。滤渣1的成分除CuS外还有_____ 。
(3)NaClO氧化 为
为 的离子方程式为
的离子方程式为_____ 。
(4)室温下用有机萃取剂HDEHP萃取金属离子的萃取率随溶液pH的变化如下左图。“萃取”时应调节溶液pH的最佳范围是_____ 。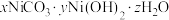 。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如上图所示(300~480℃、500~750℃条件下加热,收集到的气体产物均各只有一种,750℃以上残留固体为NiO)。则样品的化学式为
。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如上图所示(300~480℃、500~750℃条件下加热,收集到的气体产物均各只有一种,750℃以上残留固体为NiO)。则样品的化学式为_____ 。
(6)“分解”时通N2的作用是_____ 。
| 物质 | NiS | ZnS | CuS | FeS | CaF2 |
 (20℃) (20℃) | 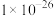 | 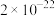 |  |  |  |
(1)为提高废镍催化剂的浸出速率,可采取的措施有
(2)反应
 的平衡常数K=
的平衡常数K=(3)NaClO氧化
 为
为 的离子方程式为
的离子方程式为(4)室温下用有机萃取剂HDEHP萃取金属离子的萃取率随溶液pH的变化如下左图。“萃取”时应调节溶液pH的最佳范围是
 。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如上图所示(300~480℃、500~750℃条件下加热,收集到的气体产物均各只有一种,750℃以上残留固体为NiO)。则样品的化学式为
。为测定其组成,进行下列实验:称取干燥沉淀样品3.41g,隔绝空气加热,剩余固体质量随温度变化的曲线如上图所示(300~480℃、500~750℃条件下加热,收集到的气体产物均各只有一种,750℃以上残留固体为NiO)。则样品的化学式为(6)“分解”时通N2的作用是
您最近一年使用:0次
2023-09-25更新
|
598次组卷
|
4卷引用:四川省南充市2024届高三上学期高考适应性考试(零诊)理科综合化学试题
名校
6 . 有机物分子式的确定常采用燃烧法,其操作如下:在电炉加热下用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。如图所示是用燃烧法测定有机物分子式常用的装置,其中A管装碱石灰,B管装无水CaCl2.下列说法错误的是
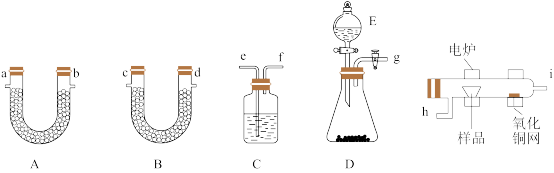

| A.如果A管和B管质量均增加,不能说明有机物含有C、H、O三种元素 |
| B.各装置导管口的连接顺序是g-e-f-h-i-a-b-c-d |
| C.装置C中装有浓硫酸,分液漏斗E中可以装H2O2 |
| D.如果将氧化铜网去掉,A管增加的质量将减小 |
您最近一年使用:0次
2021-12-02更新
|
495次组卷
|
4卷引用:四川省南充高级中学2021-2022学年高二上学期期中考试化学试题
四川省南充高级中学2021-2022学年高二上学期期中考试化学试题(已下线)1.2.2 有机物实验式、分子式和分子结构的确定-2021-2022学年高二化学课后培优练(人教版2019选择性必修3)天津市第一中学2022—2023学年高一下学期第二次月考化学试题安徽省桐城中学2021-2022学年高二下学期开学检测化学试题
13-14高三·江苏南通·阶段练习
名校
7 . LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:

已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是______ 、______ 。反应设备不能用玻璃材质的原因是______ (用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的______ 溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:______ 。
(3)第④步分离采用的方法是______ ;第⑤步分离尾气中HF、HCl采用的方法是______ 。
(4)LiPF6产品中通常混有少量LiF。取样品w g,测得Li的物质的量为n mol,则该样品中LiPF6的物质的量为______ mol(用含w、n的代数式表示)。

已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:
(3)第④步分离采用的方法是
(4)LiPF6产品中通常混有少量LiF。取样品w g,测得Li的物质的量为n mol,则该样品中LiPF6的物质的量为
您最近一年使用:0次
2016-12-08更新
|
376次组卷
|
5卷引用:四川省南充高级中学2018届高三上学期第四次检测理综化学试题
四川省南充高级中学2018届高三上学期第四次检测理综化学试题(已下线)2015届江苏省海安中学、常州一中、沭阳中学高三联合调研化学试卷2014-2015学年湖南省双峰一中高二下期中理科化学试卷2017届湖南省安仁一中、永兴一中高三上学期8月月考化学试卷河北省大名县第一中学2018届高三(实验班)上学期第一次月考化学试题



