解题方法
1 . 下列实验方案、现象和结论均正确的是
| 选项 | 实验方案 | 现象 | 结论 |
| A | 取两份新制氯水,分别滴加AgNO3溶液和淀粉KI溶液 | 前者有白色沉淀,后者溶液变蓝 | 氯气与水反应存在限度 |
| B | 向稀硫酸中加入铜粉,再加入少量KNO3固体 | 开始无明显现象,加入KNO3后,溶液变蓝 | KNO3起催化作用 |
| C | 取少量Na2SO3样品溶于蒸馏水,滴加足量稀盐酸,再加入足量BaCl2溶液 | 有白色沉淀生成 | 样品已经变质 |
| D | 向浓度均为0.1mol·L-1的NaCl和Na2CO3溶液中分别滴加酚酞 | 前者不变色,后者变红 | 非金属性:C<Cl |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-16更新
|
104次组卷
|
2卷引用:四川省雅安市天全中学2024届高三下学期模拟预测化学试题5
名校
2 . 现有一瓶部分变质为碳酸钠的氢氧化钠固体。某同学想了解其变质情况,称取10.00g上述固体样品于烧杯中,加入足量水使之完全溶解,再向烧杯中缓缓加入过量的氢氧化钡溶液,充分反应后,过滤、洗涤、干燥,得到3.94g沉淀。求:
(1)样品中碳酸钠的质量分数___ 。
(2)反应后所得溶液中氢氧化钠的质量___ 。
(1)样品中碳酸钠的质量分数
(2)反应后所得溶液中氢氧化钠的质量
您最近一年使用:0次
3 . 吊白块( NaHSO2·HCHO·2H2O,M=154.0g/mol)在工业中有广泛应用;吊白块在酸性环境下、100℃即发生分解释放出HCHO。实验室制备吊白块的方案如下:
NaHSO3的制备:
如图,在广口瓶中加入一定量Na2SO3和水,振荡溶解,缓慢通入SO2,至广口瓶中溶液pH约为4,制得NaHSO3溶液。
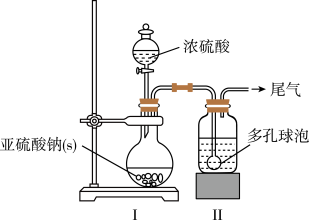
(1)装置Ⅰ中产生气体的化学反应方程式为__ ;Ⅱ中多孔球泡的作用是__ 。
(2)实验室检测NaHSO3晶体在空气中是否发生氧化变质的实验方案是__ 。
吊白块的制备:
如图,向仪器A中加入上述NaHSO3溶液、稍过量的锌粉和一定量甲醛,在80~90℃C下,反应约3h,冷却过滤。
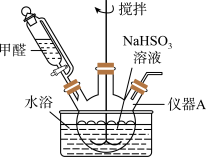
(3)仪器A的名称为___ ;用恒压漏斗代替普通滴液漏斗滴加甲醛的优点是__ 。
(4)将仪器A中的反应温度恒定在80~90℃的目的是__ 。
吊白块纯度的测定:
将0.5000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100℃水蒸气;吊白块分解并释放出甲醛,用含36.00mL0.1000mol·L-1酸性KMnO4吸收甲醛(不考虑SO2影响,4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。
(5)滴定终点的判断方法是__ ;吊白块样品的纯度为__ %(保留四位有效数字);若KMnO4标准溶液久置释放出O2而变质,会导致测量结果__ (填“偏高”、“偏低”或“无影响”)
NaHSO3的制备:
如图,在广口瓶中加入一定量Na2SO3和水,振荡溶解,缓慢通入SO2,至广口瓶中溶液pH约为4,制得NaHSO3溶液。

(1)装置Ⅰ中产生气体的化学反应方程式为
(2)实验室检测NaHSO3晶体在空气中是否发生氧化变质的实验方案是
吊白块的制备:
如图,向仪器A中加入上述NaHSO3溶液、稍过量的锌粉和一定量甲醛,在80~90℃C下,反应约3h,冷却过滤。

(3)仪器A的名称为
(4)将仪器A中的反应温度恒定在80~90℃的目的是
吊白块纯度的测定:
将0.5000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100℃水蒸气;吊白块分解并释放出甲醛,用含36.00mL0.1000mol·L-1酸性KMnO4吸收甲醛(不考虑SO2影响,4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。
(5)滴定终点的判断方法是
您最近一年使用:0次
2019-12-31更新
|
638次组卷
|
4卷引用:2019年四川省雅安市高三第一次诊断考试理综化学试题
名校
4 . 根据实验操作,实验现象和所得出的结论不正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将FeCl2样品溶于盐酸后,滴加KSCN溶液 | 溶液变成红色 | 原FeCl2样品已变质 |
| B | 向某无色溶液中加入铜片和稀硫酸 | 试管口产生红棕色气体 | 该无色溶液中含有NO3-离子 |
| C | 向淀粉KI溶液中滴入3滴稀盐酸,再加入10%的H2O2溶液 | 滴入稀盐酸未见溶液变蓝;加入H2O2溶液后,溶液立即变蓝 | 酸性条件下,H2O2氧化性强于I2 |
| D | 取少量白色晶体于试管,加入氢氧化钠溶液并加热 | 试管口湿润蓝色石蕊试纸变红 | 白色晶体一定含有NH4+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 下表是元素周期表的一部分,针对①~⑧元素在表中的位置,回答下列问题:

(1)⑥元素在元素周期表中的位置为________________________ 。
(2)写出②含有10个中子的核素的化学符号______________ 。
(3)在②、③、④、⑤四种元素中,其离子半径按由大到小的排列顺序为_______________________________________________ 。(用离子符号比较大小)
(4)②、③、⑥元素所形 成
成 氢化物的稳定性由强到弱的顺序是
氢化物的稳定性由强到弱的顺序是_______________________________________________ 。(用化学式比较强弱)
(5)请写出①的氢化物发生催化氧化的化学方程式______________________________ 。
(6)由②④⑥三种元素组成的一种盐在空气中放置会变质,请用化学方程式表示变质的反应_______________________________________________ 。
(7)在⑥与⑦的单质中,化学性质较活泼的是___________ (填化学式);可以用下列事实证明上述结论的是_____________ 。
a.元素⑥单质的熔点比元素⑦单质的熔点高
b.元 素⑦的氢化物比元素⑥的氢化物稳定
素⑦的氢化物比元素⑥的氢化物稳定
c.元素⑦的氢化物的水溶液的酸性强于元素⑥的氢化物的水溶液的酸性
d.一定条件下⑥和⑦的单质分别与Cu反应时,⑦产物中的铜元素价态更高

(1)⑥元素在元素周期表中的位置为
(2)写出②含有10个中子的核素的化学符号
(3)在②、③、④、⑤四种元素中,其离子半径按由大到小的排列顺序为
(4)②、③、⑥元素所形
 成
成 氢化物的稳定性由强到弱的顺序是
氢化物的稳定性由强到弱的顺序是(5)请写出①的氢化物发生催化氧化的化学方程式
(6)由②④⑥三种元素组成的一种盐在空气中放置会变质,请用化学方程式表示变质的反应
(7)在⑥与⑦的单质中,化学性质较活泼的是
a.元素⑥单质的熔点比元素⑦单质的熔点高
b.元
 素⑦的氢化物比元素⑥的氢化物稳定
素⑦的氢化物比元素⑥的氢化物稳定c.元素⑦的氢化物的水溶液的酸性强于元素⑥的氢化物的水溶液的酸性
d.一定条件下⑥和⑦的单质分别与Cu反应时,⑦产物中的铜元素价态更高
您最近一年使用:0次
6 . 富马酸亚铁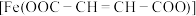 (相对分子质量170)是一种治疗缺铁性贫血的安全有效的铁制剂。常温下是红棕色固体,较难溶于水。某兴趣小组拟用以下试剂和步骤对其制备和纯度检验进行研究。
(相对分子质量170)是一种治疗缺铁性贫血的安全有效的铁制剂。常温下是红棕色固体,较难溶于水。某兴趣小组拟用以下试剂和步骤对其制备和纯度检验进行研究。 ,
,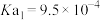 ,
,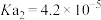 )
)
碳酸: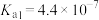 ,
,
Ⅰ.富马酸亚铁的制备
①将自制的富马酸全部置于 烧杯中,加入适量热水使之溶解;
烧杯中,加入适量热水使之溶解;
②向①烧杯中加入适量的纯碱溶液,调节pH为6.5-6.7,并将溶液转移到上图三颈烧瓶中;
③称取稍过量的 固体完全溶于适量新煮沸过的冷水中,并加入到仪器A中;
固体完全溶于适量新煮沸过的冷水中,并加入到仪器A中;
④通入 并加热一段时间后,通过仪器A缓慢加入
并加热一段时间后,通过仪器A缓慢加入
 溶液,维持反应温度100℃,充分加热1.5小时后得到红棕色沉淀;
溶液,维持反应温度100℃,充分加热1.5小时后得到红棕色沉淀;
⑤待反应混合液冷却后,通过减压过滤、用水洗涤沉淀、干燥后得到粗产品。
请回答下列问题:
(1)仪器A的名称是________ 。
(2)请写出步骤②中,富马酸和碳酸钠完全反应的化学方程式____________ ;pH值不能低于6.5的原因是_____________ 。
(3)步骤④中先通 并加热一段时间的目的是
并加热一段时间的目的是___________ ,还有操作________ (填步骤序号)也是这个原因。
(4)步骤⑤中检验沉淀洗净的方法是___________ 。
Ⅱ.富马酸亚铁产品纯度的测定
(5)取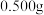 样品放入
样品放入 锥形瓶中,加入新煮沸过的稀硫酸
锥形瓶中,加入新煮沸过的稀硫酸 ,冷却后再加入新煮沸过的冷水
,冷却后再加入新煮沸过的冷水 和2滴邻二氮菲指示剂(该指示剂遇
和2滴邻二氮菲指示剂(该指示剂遇 显红色,遇
显红色,遇 呈无色),随后立即用
呈无色),随后立即用 的
的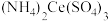 标准液滴定(还原产物为
标准液滴定(还原产物为 )至终点。三次平行试验消耗的标准液体积为
)至终点。三次平行试验消耗的标准液体积为 ,请计算本次实验中富马酸亚铁产品的纯度是
,请计算本次实验中富马酸亚铁产品的纯度是________ (最后结果保留3位有效数字)。
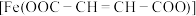 (相对分子质量170)是一种治疗缺铁性贫血的安全有效的铁制剂。常温下是红棕色固体,较难溶于水。某兴趣小组拟用以下试剂和步骤对其制备和纯度检验进行研究。
(相对分子质量170)是一种治疗缺铁性贫血的安全有效的铁制剂。常温下是红棕色固体,较难溶于水。某兴趣小组拟用以下试剂和步骤对其制备和纯度检验进行研究。
 ,
,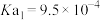 ,
,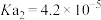 )
)碳酸:
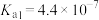 ,
,
Ⅰ.富马酸亚铁的制备
①将自制的富马酸全部置于
 烧杯中,加入适量热水使之溶解;
烧杯中,加入适量热水使之溶解;②向①烧杯中加入适量的纯碱溶液,调节pH为6.5-6.7,并将溶液转移到上图三颈烧瓶中;
③称取稍过量的
 固体完全溶于适量新煮沸过的冷水中,并加入到仪器A中;
固体完全溶于适量新煮沸过的冷水中,并加入到仪器A中;④通入
 并加热一段时间后,通过仪器A缓慢加入
并加热一段时间后,通过仪器A缓慢加入
 溶液,维持反应温度100℃,充分加热1.5小时后得到红棕色沉淀;
溶液,维持反应温度100℃,充分加热1.5小时后得到红棕色沉淀;⑤待反应混合液冷却后,通过减压过滤、用水洗涤沉淀、干燥后得到粗产品。
请回答下列问题:
(1)仪器A的名称是
(2)请写出步骤②中,富马酸和碳酸钠完全反应的化学方程式
(3)步骤④中先通
 并加热一段时间的目的是
并加热一段时间的目的是(4)步骤⑤中检验沉淀洗净的方法是
Ⅱ.富马酸亚铁产品纯度的测定
(5)取
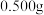 样品放入
样品放入 锥形瓶中,加入新煮沸过的稀硫酸
锥形瓶中,加入新煮沸过的稀硫酸 ,冷却后再加入新煮沸过的冷水
,冷却后再加入新煮沸过的冷水 和2滴邻二氮菲指示剂(该指示剂遇
和2滴邻二氮菲指示剂(该指示剂遇 显红色,遇
显红色,遇 呈无色),随后立即用
呈无色),随后立即用 的
的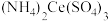 标准液滴定(还原产物为
标准液滴定(还原产物为 )至终点。三次平行试验消耗的标准液体积为
)至终点。三次平行试验消耗的标准液体积为 ,请计算本次实验中富马酸亚铁产品的纯度是
,请计算本次实验中富马酸亚铁产品的纯度是
您最近一年使用:0次
解题方法
7 . 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测说:Fe2+肯定既有还原性又有氧化性。你认为他预测的依据是:_____________ 。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水。
①若小明计划在0.1mol·L-1FeCl2溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应和现象是:_________________ 写离子方程式)、溶液由浅绿色变 ___________ 色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选__________ 滴入小明所得的混合液中,并通过溶液出现___________ 色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为:__________________ 。
(3)小明分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为小明梳理相关问题:若Fe2+在反应中表现出氧化性应转化成_______ (填微粒符号,下同),若Fe2+在反应中表现出还原性应转化成__________ 。
②实际上Fe2+的还原性较强,实验室的FeCl2溶液常因氧化而变质。除杂的方法是:______________ ,相关反应的离子方程式:_______________ 。
(1)实验前小明预测说:Fe2+肯定既有还原性又有氧化性。你认为他预测的依据是:
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水。
①若小明计划在0.1mol·L-1FeCl2溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应和现象是:
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为:
(3)小明分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为小明梳理相关问题:若Fe2+在反应中表现出氧化性应转化成
②实际上Fe2+的还原性较强,实验室的FeCl2溶液常因氧化而变质。除杂的方法是:
您最近一年使用:0次
2016-12-09更新
|
560次组卷
|
3卷引用:2015-2016学年四川省雅安市天全中学高一上学期12月月考化学试卷
2015-2016学年四川省雅安市天全中学高一上学期12月月考化学试卷(已下线)第03章 铁 金属材料(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)陕西省榆林市第十二中学2021届高三上学期第一次月考化学试题
名校
解题方法
8 . 磁性Fe3O4纳米粒子(粒径1~100nm)因其独特的物理化学性质如电学特性、磁学特性等引起广泛的研究。通过共沉淀法制备磁性Fe3O4纳米粒子的方法如下:
I.连接好如图装置;
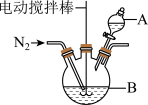
I.取10 mL0.5mol/LFeSO4,溶液和20mL0.5 mol/LFeCl3溶液于反应容器B,并向装置中通入N2;
III.在不断搅拌的条件下,向混合溶液中逐滴加入60mL12 mol/L的氨水,溶液中逐渐出现黑色物质;
IV.充分反应后,从混合液中分离出纳米粒子,并反复洗涤干燥后得到磁性Fe3O4纳米粒子。
回答下列问题:
(1)仪器A的名称为_______ ,反应容器B的最佳规格为_______ (填序号)。
a.100 mL b.250 mL c.500 mL
(2)生成磁性Fe3O4纳米粒子的离子方程式为_______ 。
(3)实验过程中通入N2的目的是_______ 。
(4)从反应后的混合液中分离出Fe3O4纳米粒子,最简便的方法是_______ (填序号);用水洗涤Fe3O4纳米粒子后,需要用无水乙醇洗涤,其原因是_______ 。
a.磁分离 b.过滤 c.分液
(5)产物中混杂的Fe2O3会降低纳米粒子的磁性,为了测定产品中Fe2O3的含量,采取如下实验方法:
准确称取0.3120g产品于锥形瓶中,用稀硝酸充分浸取,再加热使过量的硝酸全部逸出,冷却后加入足量KI溶液充分混合反应后,用0.2000mol/L Na2S2O3标准溶液滴定至溶液颜色明显变浅,加入几滴淀粉溶液,继续滴定至终点,消耗Na2S2O3标准溶液的体积为20.00mL。
已知滴定过程中发生反应的离子方程式为I2+2S2O = 2I—+S4O
= 2I—+S4O 。
。
①滴定终点的现象为_______ 。
②所取样品中Fe2O3的质量为_______ g(结果保留4位小数);若加入KI溶液的量不足,则会导致测定结果_______ (填 “偏高”“偏低”或“不变”)。
I.连接好如图装置;

I.取10 mL0.5mol/LFeSO4,溶液和20mL0.5 mol/LFeCl3溶液于反应容器B,并向装置中通入N2;
III.在不断搅拌的条件下,向混合溶液中逐滴加入60mL12 mol/L的氨水,溶液中逐渐出现黑色物质;
IV.充分反应后,从混合液中分离出纳米粒子,并反复洗涤干燥后得到磁性Fe3O4纳米粒子。
回答下列问题:
(1)仪器A的名称为
a.100 mL b.250 mL c.500 mL
(2)生成磁性Fe3O4纳米粒子的离子方程式为
(3)实验过程中通入N2的目的是
(4)从反应后的混合液中分离出Fe3O4纳米粒子,最简便的方法是
a.磁分离 b.过滤 c.分液
(5)产物中混杂的Fe2O3会降低纳米粒子的磁性,为了测定产品中Fe2O3的含量,采取如下实验方法:
准确称取0.3120g产品于锥形瓶中,用稀硝酸充分浸取,再加热使过量的硝酸全部逸出,冷却后加入足量KI溶液充分混合反应后,用0.2000mol/L Na2S2O3标准溶液滴定至溶液颜色明显变浅,加入几滴淀粉溶液,继续滴定至终点,消耗Na2S2O3标准溶液的体积为20.00mL。
已知滴定过程中发生反应的离子方程式为I2+2S2O
 = 2I—+S4O
= 2I—+S4O 。
。①滴定终点的现象为
②所取样品中Fe2O3的质量为
您最近一年使用:0次
2022-12-18更新
|
598次组卷
|
3卷引用:四川省雅安中学2022-2023学年高二下学期期中考试化学试题
四川省雅安中学2022-2023学年高二下学期期中考试化学试题四川省成都市石室天府中学2022届高三联测卷(四)理综化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)
名校
9 . 硫代硫酸钠晶体(Na2S2O3∙5H2O,M=248g∙mol−1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Na2S2O3为易溶于水的固体,往Na2S2O3溶液中加入稀盐酸会发生歧化反应 +2H+=S↓+SO2↑+2H2O。BaS2O3为难溶于水的固体。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
+2H+=S↓+SO2↑+2H2O。BaS2O3为难溶于水的固体。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在______ 中溶解,完全溶解后,全部转移至100mL_______ 中,加蒸馏水至______ 。
②滴定:取0.00950mol∙L−1的K2Cr2O7(强氧化性物质,其还原产物为Cr3+)标准溶液20.00mL,硫酸酸化后加入过量KI(强还原性物质),发生反应的离子方程式为_____ 然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应I2+2 =
=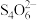 +2I-加入淀粉溶液作为指示剂,继续滴定,当溶液由蓝色变为无色且2半分钟不复原,即为终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为
+2I-加入淀粉溶液作为指示剂,继续滴定,当溶液由蓝色变为无色且2半分钟不复原,即为终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为_____ %(保留1位小数)。
(1)已知:Na2S2O3为易溶于水的固体,往Na2S2O3溶液中加入稀盐酸会发生歧化反应
 +2H+=S↓+SO2↑+2H2O。BaS2O3为难溶于水的固体。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
+2H+=S↓+SO2↑+2H2O。BaS2O3为难溶于水的固体。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③ | ④有淡黄色沉淀和刺激性气体产生 |
⑤静置, | ⑥ |
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在
②滴定:取0.00950mol∙L−1的K2Cr2O7(强氧化性物质,其还原产物为Cr3+)标准溶液20.00mL,硫酸酸化后加入过量KI(强还原性物质),发生反应的离子方程式为
 =
=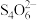 +2I-加入淀粉溶液作为指示剂,继续滴定,当溶液由蓝色变为无色且2半分钟不复原,即为终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为
+2I-加入淀粉溶液作为指示剂,继续滴定,当溶液由蓝色变为无色且2半分钟不复原,即为终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为
您最近一年使用:0次
2020-12-28更新
|
99次组卷
|
2卷引用:四川省雅安中学2020-2021学年高一12月月考化学试题



