名校
解题方法
1 . 化学创造美好生活,下列说法有关物质的性质与用途错误的是
| A.电子跃迁到激发态过程中释放能量产生紫色光—钾盐可用作紫色烟花的原料 |
| B.高铁酸钾(K2FeO4)具有强氧化性—可用作饮用水消毒剂 |
| C.SO2具有较强的还原性—可以在葡萄酒中添加SO2作为抗氧化剂食品保鲜 |
| D.Ca(OH)2具有碱性—理科突击班化学社团用熟石灰处理实验后的酸性废水 |
您最近一年使用:0次
2023-08-21更新
|
505次组卷
|
2卷引用:四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题
名校
解题方法
2 . 镁与稀硝酸的反应为:4Mg+10HNO3(稀)=4Mg(NO3)2+NH4NO3+3H2O
(1)该反应中,还原产物是___________ ,HNO3表现了___________ 。(选填“还原性”、“氧化性”、“酸性”、“碱性”)。氧化剂与还原剂的物质的量之比为___________ 。
(2)用“双线桥法”表示该反应中电子转移的方向和数目。___________ ,4Mg+10HNO3(稀)=4Mg(NO3)2+NH4NO3+3H2O
(3)若反应过程中转移的电子数为6.02×1023,则被还原的硝酸物质的量为___________ 。
(1)该反应中,还原产物是
(2)用“双线桥法”表示该反应中电子转移的方向和数目。
(3)若反应过程中转移的电子数为6.02×1023,则被还原的硝酸物质的量为
您最近一年使用:0次
3 . 某化学兴趣小组用铜和浓硫酸制取SO2,并依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示(图中连接胶管、夹持和加热装置省略):


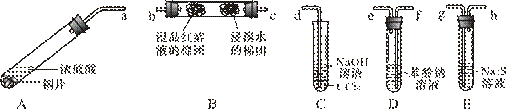
查阅资料可知,HSO 的酸性强弱与H2CO3相近。请回答下列问题:
的酸性强弱与H2CO3相近。请回答下列问题:
(1)上述装置的接口连接顺序依次是___________________ (填导管接口字母)。
(2)装置A、D中发生反应的化学方程式是:A________________________________ , D______________________________________________ 。
(3)证明SO2具有氧化性的现象是________________________________ ;证明SO2具有还原性的实验中,反应的离子方程式是_______________________________________ 。
(4)C试管中NaOH溶液的作用是_________________ ,CCl4的作用是___________ 。
(5)实验过程中还观察到A试管内产生黑色沉淀,查资料可知,该黑色沉淀是副反应产生的CuS和Cu2S。收集黑色沉淀经过滤、洗净、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现黑色固体质量减少a %,则a值范围是_______________ 。



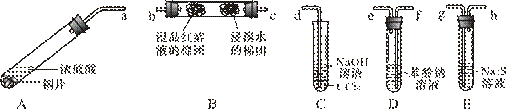
查阅资料可知,HSO
 的酸性强弱与H2CO3相近。请回答下列问题:
的酸性强弱与H2CO3相近。请回答下列问题:(1)上述装置的接口连接顺序依次是
(2)装置A、D中发生反应的化学方程式是:A
(3)证明SO2具有氧化性的现象是
(4)C试管中NaOH溶液的作用是
(5)实验过程中还观察到A试管内产生黑色沉淀,查资料可知,该黑色沉淀是副反应产生的CuS和Cu2S。收集黑色沉淀经过滤、洗净、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现黑色固体质量减少a %,则a值范围是
您最近一年使用:0次
名校
4 . 亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气结合的能力。误食亚硝酸钠中毒,可服用维生素C缓解。上述亚硝酸钠和维生素C表现的性质分别是
| A.还原性和氧化性 | B.氧化性和还原性 |
| C.氧化性和酸性 | D.还原性和碱性 |
您最近一年使用:0次
2020-11-09更新
|
857次组卷
|
22卷引用:四川省绵阳第一中学2021-2022学年高一上学期期中教学质量测试化学试题
四川省绵阳第一中学2021-2022学年高一上学期期中教学质量测试化学试题内蒙古通辽实验中学2017-2018学年高一上学期期末考试化学试题广西桂梧高中2017-2018学年高一下学期第一次月考化学试题山西省运城市新绛中学2021届高三上学期8月月考化学试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高一10月月考化学试题黑龙江省哈尔滨师范大学附属中学2020—2021学年高一上学期第一次月考化学试题(已下线)【浙江新东方】11四川省成都外国语学校2020-2021学年高一上学期期中考试化学试题新疆生产建设兵团第十师北屯高级中学2020-2021学年高一上学期阶段性检测化学试题(已下线)练习7 氧化还原反应-2020-2021学年【补习教材·寒假作业】高一化学(鲁科版2019)广西北流市实验中学2020-2021学年高一上学期期中考试化学试题黑龙江省齐齐哈尔市第二十四中学2021-2022学年高一上学期第一次月考化学试题云南省玉溪第一中学2021-2022学年高一上学期第一次月考化学试题四川省达州市第一中学校2021-2022学年高一上学期期中考试化学试题安徽省芜湖市2021-2022学年高一上学期期末教学质量监控化学试题(已下线)1.3.2 氧化剂与还原剂 氧化还原反应规律-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)河北省重点中学2022-2023学年高一上学期期中考试化学试题辽宁省大连金石高级中学2022-2023学年高一10月月考化学试题陕西省西安市周至县第四中学2021-2022学年高二上学期期中考试化学(文科)试题(已下线)专题03 氧化还原反应【考题猜想】(10大题型)-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)河北省新乐市第一中学2022-2023学年高一上学期11月期中考试化学试题福建泉州中远学校2023-2024学年高三上学期阶段测试化学试卷
名校
解题方法
5 . 管道工人曾经用浓氨水检验氯气管道是否泄漏。当浓氨水靠近氯气泄漏处时会产生大量白烟,这一现象体现了氨的哪些性质?
①易挥发 ②易溶于水 ③还原性 ④氧化性 ⑤碱性 ⑥酸性
①易挥发 ②易溶于水 ③还原性 ④氧化性 ⑤碱性 ⑥酸性
| A.①②③ | B.①③⑤ | C.②④⑥ | D.③④⑤ |
您最近一年使用:0次
2020-09-05更新
|
74次组卷
|
3卷引用:四川省江油中学2022-2023学年高一下学期第一次阶段考试化学试题
名校
6 . 某小组在实验室用NaClO溶液和NH3反应制备N2H4,并进行相关的性质探究实验。
Ⅰ.制备N2H4
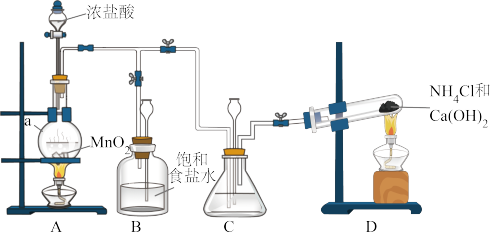
(1)仪器a的名称是___________ 。
(2)装置C中盛放的试剂是___________ 。装置B的作用是___________ 。
(3)制备N2H4的离子方程式为___________ 。
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
(4)称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
①滴定到达终点的现象是___________ 。
②实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合腓的质量分数为___________ 。
Ⅲ.探究的还原性与碱性。将制得的耕分离提纯后,进行如图实验。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
(5)请完成表中的空白部分:①___________ ;②___________ 。
(6)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:___________ 。
Ⅰ.制备N2H4

(1)仪器a的名称是
(2)装置C中盛放的试剂是
(3)制备N2H4的离子方程式为
Ⅱ.测定产品中水合肼(N2H4 · H2O)的含量
(4)称取产品6.0 g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右), 加水配成250 mL溶液,移取25.00 mL置于锥形瓶中,并滴加2 ~ 3滴淀粉溶液,用 0.3000 mol • L-1的碘标准溶液滴定(已知:N2H4·H2O+2I2 =N2↑ +4HI+H2O)。
①滴定到达终点的现象是
②实验测得消耗碘标准溶液的平均值为20.00 mL,产品中水合腓的质量分数为
Ⅲ.探究的还原性与碱性。将制得的耕分离提纯后,进行如图实验。

【查阅资料]AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】设计如下方案,进行实验。
| 操作 | 现象 | 实验结论 |
| i.取少量黑色固体于试管中,加入适量①_________ | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ii.取少量黑色固体于试管中加入足量稀硝酸,振荡 | ②_________ | 黑色固体是Ag和Ag2O |
(6)实验表明,黑色固体主要成分是Ag,还有少量氧化银,请解释原因:
您最近一年使用:0次
2022-03-29更新
|
833次组卷
|
6卷引用:四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题
四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题四川省绵阳市高中2022-2023学年高二下学期理科突击班6月月考化学试题山西省太原市2022届高三下学期模拟考试(一模)理科综合化学试题(已下线)专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16化学实验综合题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)
7 . 镁与稀硝酸的反应为:Mg+ HNO3(稀)—— Mg(NO3)2+ NO↑+ H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目。________
(2)该反应中,还原产物是_________ ,HNO3表现了______________ (选填“还原性”、“氧化性”、“酸性”、“碱性”)。
(3)若反应过程中转移的电子为0.6 mol,则被还原的硝酸物质的量为________ 。
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目。
(2)该反应中,还原产物是
(3)若反应过程中转移的电子为0.6 mol,则被还原的硝酸物质的量为
您最近一年使用:0次
2019-12-13更新
|
198次组卷
|
4卷引用:四川省绵阳南山中学2019-2020学年高一上学期期中考试化学试题
名校
解题方法
8 . 高铁酸钾(K2FeO4,极易溶于水)是常见的水处理剂,其原理如图所示。
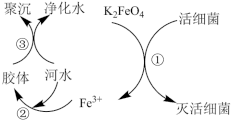
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
请回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为_______ 。
(2)过程①中活性菌表现了_______ (填“氧化”或“还原”)性;过程③属于______ (填“物理”或“化学”)变化。
(3)根据上述原理分析,作水处理剂时, 的作用有
的作用有________ 、_________ (填两个)。
(4)制备高铁酸钾常用的反应原理为 (未配平)。
(未配平)。
①通过该反应说明:在碱性条件下,氧化性:
_______ (填“>”、“=”或“<”) 。
。
②配平该反应的化学方程式,并用双线桥法表示电子转移的方向和数目:_______ 。

【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
请回答下列问题:
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)过程①中活性菌表现了
(3)根据上述原理分析,作水处理剂时,
 的作用有
的作用有(4)制备高铁酸钾常用的反应原理为
 (未配平)。
(未配平)。①通过该反应说明:在碱性条件下,氧化性:

 。
。②配平该反应的化学方程式,并用双线桥法表示电子转移的方向和数目:
您最近一年使用:0次
2022-12-17更新
|
163次组卷
|
2卷引用:四川省绵阳市东辰学校2022-2023学年高一上学期期末模拟化学试卷
9 . 镁与稀硝酸的反应为:Mg+ HNO3(稀)—— Mg(NO3)2+ NH4NO3+ H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目。_____
(2)该反应中,还原产物是_________ ,HNO3表现了________ (选填“还原性”、“氧化性”、“酸性”、“碱性”)。
(3)若反应过程中转移的电子数为6.02×1023,则被还原的硝酸物质的量为________ 。
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目。
(2)该反应中,还原产物是
(3)若反应过程中转移的电子数为6.02×1023,则被还原的硝酸物质的量为
您最近一年使用:0次
11-12高二·辽宁·期末
名校
10 . 维生素C 又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+ 转变为易吸收的Fe2+ ,这说明维生素C具有
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
您最近一年使用:0次
2016-12-09更新
|
382次组卷
|
7卷引用:四川省绵阳南山中学2021-2022学年高一上学期半期考试化学试题



