名校
1 . 某兴趣小组为探究浓硫酸与铜的反应,设计了如下装置。_______ 。
(2)为验证品红被 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象_______ 。
(3)浸NaOH溶液的棉团作用是_______ 。
(4)为进一步探究 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)
①查阅资料 不同浓度的 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的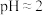 。
。
②提出猜想 猜想1: 被
被 氧化
氧化
猜想2: 在酸性条件下被
在酸性条件下被 氧化
氧化
猜想3:_______
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、 和
和 固体
固体
④交流讨论 小组同学认为,综合上述两个实验不足以证明猜想3成立。
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:_______ (只需提供设计思路,不需要写出具体操作步骤)。

(2)为验证品红被
 漂白的产物不稳定,简述操作步骤及现象
漂白的产物不稳定,简述操作步骤及现象(3)浸NaOH溶液的棉团作用是
(4)为进一步探究
 的还原性,将过量的
的还原性,将过量的 通入到200mL1.0mol/L的
通入到200mL1.0mol/L的 和过量
和过量 混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
混合溶液中,观察到装置中产生了白色沉淀。装置如图所示。
 产生的原因进行探究(不考虑溶液中
产生的原因进行探究(不考虑溶液中 的影响)
的影响)①查阅资料 不同浓度的
 被还原的产物不同且产物不单一、不同pH时,
被还原的产物不同且产物不单一、不同pH时, 的氧化性不同。1.0mol/L的
的氧化性不同。1.0mol/L的 的
的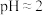 。
。②提出猜想 猜想1:
 被
被 氧化
氧化猜想2:
 在酸性条件下被
在酸性条件下被 氧化
氧化猜想3:
③设计实验、验证猜想
限选实验试剂:0.01mol/LHCl、0.02mol/LHCl、3.0mol/LHNO3、6.0mol/LHNO3、3.0mol/LNaNO3、6.0mol/LNaNO3、0.1mol/LKSCN、
 和
和 固体
固体| 实验步骤 | 实验现象和结论 |
| 实验1:取少量反应后的上层清液于试管中,滴入少量 | 出现 与 与 发生的离子方程式为 发生的离子方程式为 |
实验2:往图中的装置中加入100mL 固体,再通入过量 固体,再通入过量 。 。 | 出现白色沉淀,说明猜想2成立。 |
⑤优化实验 若要证明猜想3成立,还要进行实验3。
实验3:
您最近一年使用:0次
2022-04-29更新
|
1050次组卷
|
7卷引用:四川省泸州市古蔺县金兰高级中学校2022-2023学年高二下学期第一次月考化学试题
四川省泸州市古蔺县金兰高级中学校2022-2023学年高二下学期第一次月考化学试题广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题热点1实验方案设计(已下线)化学-2023年高考押题预测卷03(广东卷)(含考试版、全解全析、参考答案、答题卡)2024届四川省攀枝花市第十五中学校高三上学期12月第7次半月考理科综合试题-高中化学
名校
2 . 某小组同学探究不同条件下 与
与 的反应产物,设计的实验装置如图所示(夹持装置已省略)。
的反应产物,设计的实验装置如图所示(夹持装置已省略)。

已知:Ⅰ. 在一定条件下被
在一定条件下被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
Ⅱ.浓碱条件下, 可与
可与 反应生成
反应生成 和
和 。
。
Ⅲ. 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。
回答下列问题:
(1)仪器m的名称为___________ 。
(2)装置A中发生反应的化学方程式为___________ 。
(3)装置B中盛放的试剂为___________ 。
(4)装置D的作用为___________ 。
(5)根据表格推断,通入 前,实验Ⅱ、Ⅲ中产生的白色沉淀为
前,实验Ⅱ、Ⅲ中产生的白色沉淀为___________ (填化学式)。
(6)对比实验Ⅰ、Ⅱ通入 后的实验现象,在碱性条件下
后的实验现象,在碱性条件下___________ 能被 氧化为
氧化为___________ 。
(7)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,但实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入 导致溶液的碱性减弱。
导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:___________ 。
②取Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,紫色溶液迅速变为绿色,且绿色缓慢加深。溶液由紫色变为绿色的离子方程式为___________ ,溶液绿色缓慢加深,原因是 被
被___________ (填“化学式”)氧化,可证明Ⅲ的悬浊液中氧化剂过量。
 与
与 的反应产物,设计的实验装置如图所示(夹持装置已省略)。
的反应产物,设计的实验装置如图所示(夹持装置已省略)。
已知:Ⅰ.
 在一定条件下被
在一定条件下被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。Ⅱ.浓碱条件下,
 可与
可与 反应生成
反应生成 和
和 。
。Ⅲ.
 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。| 实验 | 物质a | 装置C中实验现象 | |
通入 前 前 | 通入 后 后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,但仍有棕黑色沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,但仍有棕黑色沉淀 |
(1)仪器m的名称为
(2)装置A中发生反应的化学方程式为
(3)装置B中盛放的试剂为
(4)装置D的作用为
(5)根据表格推断,通入
 前,实验Ⅱ、Ⅲ中产生的白色沉淀为
前,实验Ⅱ、Ⅲ中产生的白色沉淀为(6)对比实验Ⅰ、Ⅱ通入
 后的实验现象,在碱性条件下
后的实验现象,在碱性条件下 氧化为
氧化为(7)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,但实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入
 导致溶液的碱性减弱。
导致溶液的碱性减弱。原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,紫色溶液迅速变为绿色,且绿色缓慢加深。溶液由紫色变为绿色的离子方程式为
 被
被
您最近一年使用:0次
2023-11-06更新
|
137次组卷
|
2卷引用:四川省泸县第一中学2023-2024学年高一上学期11月期中化学试题
名校
3 . 化学小组同学设计如下实验验证氧气的部分性质,并探究氯水的成分和性质。
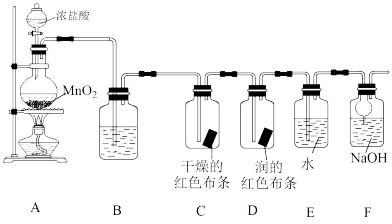
回答下列问题:
(1)装置A中装浓盐酸的仪器的名称是_______ 。
(2)装置A中发生反应的化学方程式为_______ 。
(3)验证干燥的氯气没有漂白性的现象为_______ 。
(4)装置F的作用(用离子方程式表示)是_______ 。
(5)资料:淀粉的特征反应——遇 变蓝色:
变蓝色: 。
。
研究新制氯水的成分和性质,分别取装置E中的溶液(氯水)进行下列实验:
①根据实验1,滴加淀粉碘化钾溶液,溶液变蓝,可知氧化性:
_______  (填“﹥”或“﹤”)。
(填“﹥”或“﹤”)。
②实验2中,将氯水滴入石蕊溶液中,石蕊溶液先变红,后褪色,褪色是因为溶液中含有_______ 分子。
③若用实验3证明氯水中含有氯离子,则操作、现象:_______ 。

回答下列问题:
(1)装置A中装浓盐酸的仪器的名称是
(2)装置A中发生反应的化学方程式为
(3)验证干燥的氯气没有漂白性的现象为
(4)装置F的作用(用离子方程式表示)是
(5)资料:淀粉的特征反应——遇
 变蓝色:
变蓝色: 。
。研究新制氯水的成分和性质,分别取装置E中的溶液(氯水)进行下列实验:
①根据实验1,滴加淀粉碘化钾溶液,溶液变蓝,可知氧化性:

 (填“﹥”或“﹤”)。
(填“﹥”或“﹤”)。②实验2中,将氯水滴入石蕊溶液中,石蕊溶液先变红,后褪色,褪色是因为溶液中含有
③若用实验3证明氯水中含有氯离子,则操作、现象:
您最近一年使用:0次
2022-12-07更新
|
115次组卷
|
2卷引用:四川省泸县第一中学2022-2023学年高二下学期开学考试化学试题
4 . 《南村辍耕录》中记载:“杭人削松木为小片,其薄如纸,熔硫磺涂木片顶端分许,名曰发烛。”《资治通鉴》中记载:“陈宣帝太建九年,齐后妃贫苦,至以卖烛为业。”文中的发烛就是原始的火柴。

 在工业中用作制造火柴头的氧化剂。
在工业中用作制造火柴头的氧化剂。
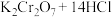 (浓)
(浓)
(1)__________ (填元素名称)元素被氧化,__________ (填化学式,下同)是氧化剂。
(2)__________ 是氧化产物,__________ 发生氧化反应。
(3)参加反应的盐酸,表现了__________ 性质(填“还原性”“氧化性”或“酸性”);
147g 参加反应时,被氧化的
参加反应时,被氧化的 为
为__________ g
(4)用单线桥表示出该反应电子转移的方向和数目__________ 。

 在工业中用作制造火柴头的氧化剂。
在工业中用作制造火柴头的氧化剂。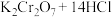 (浓)
(浓)
(1)
(2)
(3)参加反应的盐酸,表现了
147g
 参加反应时,被氧化的
参加反应时,被氧化的 为
为(4)用单线桥表示出该反应电子转移的方向和数目
您最近一年使用:0次
2023-11-02更新
|
35次组卷
|
2卷引用:四川省泸州市泸县第五中学2023-2024学年高一上学期12月月考化学试题
名校
5 . 储氢纳米碳管研究成功体现了科技的进步,但用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式为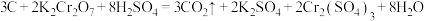 。回答下列问题。
。回答下列问题。
(1)该反应中,还原剂是___________ (填化学式),被还原的元素是___________ (填元素符号)。
(2)该反应中, 表现出
表现出___________ (选填“氧化性”或“还原性”), 发生了
发生了___________ (选填“氧化反应”或“还原反应”)。
(3) 在该反应中表现出___________(填字母)。
在该反应中表现出___________(填字母)。
(4)每生成2分子 ,该反应转移
,该反应转移___________ 个电子。
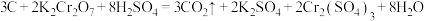 。回答下列问题。
。回答下列问题。(1)该反应中,还原剂是
(2)该反应中,
 表现出
表现出 发生了
发生了(3)
 在该反应中表现出___________(填字母)。
在该反应中表现出___________(填字母)。| A.只有酸性 | B.只有氧化性 | C.酸性和氧化性 | D.酸性和还原性 |
 ,该反应转移
,该反应转移
您最近一年使用:0次
名校
6 . 现有下列反应:
①
②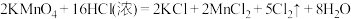
针对上述两个反应回答:
(1)用双线桥标出①中电子转移的方向和数目_________ ;其中氧化剂是_________ (填化学式),氧化产物是_________ (填化学式)。
(2)写出②的离子方程式_________ ;
(3) 、
、 和
和 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_________ 。
(4)反应②中氯化氢表现出的性质是_________ 。
a.还原性 b.酸性 c.氧化性
①

②
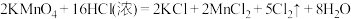
针对上述两个反应回答:
(1)用双线桥标出①中电子转移的方向和数目
(2)写出②的离子方程式
(3)
 、
、 和
和 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(4)反应②中氯化氢表现出的性质是
a.还原性 b.酸性 c.氧化性
您最近一年使用:0次
2022-11-30更新
|
203次组卷
|
2卷引用:四川省泸县第四中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
7 . 实验室用如下装置制取氯气,并用以下实验装置探究氯气相关性质。回答下列问题:
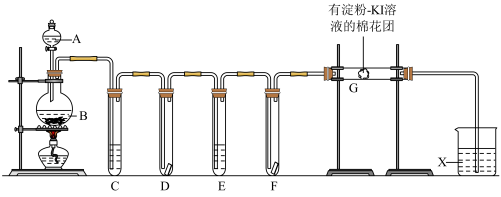
(1)已知实验室制取Cl2的原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,浓HCl的作用是
MnCl2+Cl2↑+2H2O,浓HCl的作用是_______ (填选项),每产生1个Cl2转移_______ 个电子。
A.氧化性 B.还原性 C.酸性
(2)连接好实验装置后,用酒精灯微热圆底烧瓶,X中导管口有气泡冒出,移开酒精灯,片刻之后,当X中导管出现_______ ,则证明气密性良好。
(3)试管C中的试剂为饱和食盐水,为了验证干燥的Cl2无漂白性,湿润的Cl2具有漂白性,E中试剂为_______ ,干燥的有色布条应该放在装置_______ (填D或F)
(4)装置G中,淀粉变蓝,根据实验现象,写出发生的离子方程式为_______ 。
(5)装置X中试剂为NaOH溶液,写出其离子反应方程式:_______ 。
(6)通过实验可得,MnO2、Cl2、I2的氧化性由强到弱依次是_______ 。
(7)用单线桥画出电子转移情况:____ MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O

(1)已知实验室制取Cl2的原理为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O,浓HCl的作用是
MnCl2+Cl2↑+2H2O,浓HCl的作用是A.氧化性 B.还原性 C.酸性
(2)连接好实验装置后,用酒精灯微热圆底烧瓶,X中导管口有气泡冒出,移开酒精灯,片刻之后,当X中导管出现
(3)试管C中的试剂为饱和食盐水,为了验证干燥的Cl2无漂白性,湿润的Cl2具有漂白性,E中试剂为
(4)装置G中,淀粉变蓝,根据实验现象,写出发生的离子方程式为
(5)装置X中试剂为NaOH溶液,写出其离子反应方程式:
(6)通过实验可得,MnO2、Cl2、I2的氧化性由强到弱依次是
(7)用单线桥画出电子转移情况:
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
您最近一年使用:0次
2022-12-09更新
|
59次组卷
|
2卷引用:四川省泸州市泸县第五中学2023-2024学年高一上学期11月期中化学试题
名校
8 . 硒( )是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
)是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
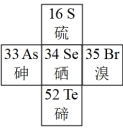
(1)硒在元素周期表中的位置如图所示:
① 在元素周期表中位置表示为
在元素周期表中位置表示为_______ ;
②用电子式表示 的形成过程:
的形成过程:_______ 。
(2)阳极泥中的硒主要以 和
和 的形式存在,工业上提取硒的流程如下:
的形式存在,工业上提取硒的流程如下:
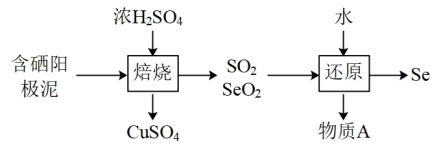
①请写出 与浓
与浓 反应的化学方程式:
反应的化学方程式:_______ 。
②写出“还原”步骤对应的化学方程式,并用单线桥标出电子转移情况:_______ 。
(3)下列说法正确的是_______。
 )是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
)是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
(1)硒在元素周期表中的位置如图所示:
①
 在元素周期表中位置表示为
在元素周期表中位置表示为②用电子式表示
 的形成过程:
的形成过程:(2)阳极泥中的硒主要以
 和
和 的形式存在,工业上提取硒的流程如下:
的形式存在,工业上提取硒的流程如下:
①请写出
 与浓
与浓 反应的化学方程式:
反应的化学方程式:②写出“还原”步骤对应的化学方程式,并用单线桥标出电子转移情况:
(3)下列说法正确的是_______。
A. 既有氧化性又有还原性 既有氧化性又有还原性 | B.原子半径由大到小顺序: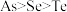 |
C.热稳定性: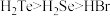 | D.酸性: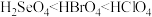 |
您最近一年使用:0次
2022-03-30更新
|
430次组卷
|
3卷引用:四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题
四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题江苏省泰州中学2021-2022学年高一上学期期末考试化学试题(已下线)专题09 原子结构 元素周期律和周期表-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)
名校
9 . 当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。其中,甲池为3mol·L-1的AgNO3溶液,乙池为1mol·L-1的AgNO3溶液A、B均为Ag电极。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法不正确的是
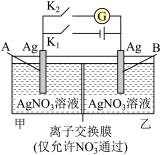

| A.当电流计指针归零后,断开K2,闭合K1,一段时间后B电极的质量增加 |
| B.断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等 |
| C.实验开始先断开K1,闭合K2,此时NO3-向B电极移动 |
| D.当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大 |
您最近一年使用:0次
2019-04-25更新
|
667次组卷
|
2卷引用:四川省泸县第二中学2020届高三下学期第四次学月考试理综化学试题
名校
解题方法
10 . 分类是学习的一种重要方法,“价一类”二维图对学习化学知识具有重要的指导意义。物质的化学反应常与外界条件密切相关。回答下列问题:
(1)含有同一元素的X、Y、Z、E、M五种物质,一定条件下有以下的转化关系。
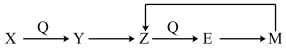
①若E为红棕色气体,则该气体的收集方法为___ ;X分子含有10个电子,则气体X水溶液中离子有___ 。
②若Y为淡黄色固体单质,写出Z→E的化学反应方程式___ 。
(2)盐酸、硫酸、硝酸是工业生产中常用的三种强酸。
①盐酸既有酸性,又能表现氧化性和还原性,其还原产物是___ ;若足量的MnO2与100mL12mol·L-1的浓盐酸反应,生成Cl2的物质的量___ 0.3mol(填:“大于”、“等于”、“小于”)。
②足量的锌与浓硫酸反应,反应开始时的化学方程式为___ ;反应快结束时的离子反应方程式为___ 。
③将6.4g铜与足量的浓硝酸反应,产生NO和NO2气体的体积为2.24L(STP),则参加反应的硝酸的物质的量为___ 。
(1)含有同一元素的X、Y、Z、E、M五种物质,一定条件下有以下的转化关系。

①若E为红棕色气体,则该气体的收集方法为
②若Y为淡黄色固体单质,写出Z→E的化学反应方程式
(2)盐酸、硫酸、硝酸是工业生产中常用的三种强酸。
①盐酸既有酸性,又能表现氧化性和还原性,其还原产物是
②足量的锌与浓硫酸反应,反应开始时的化学方程式为
③将6.4g铜与足量的浓硝酸反应,产生NO和NO2气体的体积为2.24L(STP),则参加反应的硝酸的物质的量为
您最近一年使用:0次
2020-02-04更新
|
266次组卷
|
4卷引用:四川省泸县第一中学2022-2023学年高一上学期12月月考化学试题



